Каталитическая функция. Большинство известных в настоящее время ферментов, называемых биологическими катализаторами, является белками. Транспортная функция
 Скачать 1.95 Mb. Скачать 1.95 Mb.
|
|
Соедини́тельная ткань — это ткань живого организма, не отвечающая непосредственно за работу какого-либо органа или системы органов, но играющая вспомогательную роль во всех органах, составляя 60—90 % от их массы. Выполняет опорную, защитную и трофическую функции. Соединительная ткань образует опорный каркас (строму) и наружные покровы (дерму) всех органов. Общими свойствами всех соединительных тканей является происхождение из мезенхимы, а также выполнение опорных функций и структурное сходство. Большая часть твёрдой соединительной ткани является фиброзной: состоит из волокон коллагена и эластина. К соединительной ткани относят костную,хрящевую, жировую и другие. К соединительной ткани относят также кровь и лимфу. Поэтому соединительная ткань — единственная ткань, которая присутствует в организме в 4-х видах — волокнистом (связки), твёрдом (кости), гелеобразном (хрящи) и жидком (кровь, лимфа, а также межклеточная, спинномозговая и синовиальная и прочие жидкости). Соединительная ткань состоит из внеклеточного матрикса и нескольких видов клеток. Клетки, относящиеся к соединительной ткани:
Коллаген. Характерным компонентом структуры соединительной ткани являются коллагеновые волокна. Они построены в основном из своеобразного белки – коллагена. Коллаген составляет 25–33% от общего количества белка организма взрослого человека, или 6% от массы тела. Видимые в оптическом микроскопе коллагеновые волокна состоят из различимых в электронном микроскопе фибрилл – вытянутых в длину белковых молекул, названных тропоколлагеном. Тропоколлаген – ос- новная структурная единица коллагена. Необходимо четко разграничивать понятия ≪коллагеновые волокна≫ и ≪коллаген≫. Первое понятие по существу является морфологическим и не может быть сведено к биохимическим представлениям о коллагене как о белке. Коллагеновое волокно представляет собой гетерогенное образование и содержит, кроме белка коллагена, другие химические компоненты. Молекула тропоколла - гена – это белок коллаген. Одной из отличительных черт данного белка является то, что 1/3 всех его аминокислотных остатков составляет глицин, 1/3 – пролин и 4-гидроксипролин, около 1% – гидроксилизин; некоторые молекулярные формы коллагена содержат также 3-гидроксипролин, хотя и в весьма ограниченном количестве. Молекулярная масса тропоколлагена около 285000. Тропоколлаген состоит из трех полипептидных цепей одинакового размера, которые сливаются в спиралевидный триплет. Тройная спираль стабилизируется многочисленными межцепочечными поперечными сшивками между лизиновыми и гидроксилизиновыми остатками. Каждая полипептидная цепь тропоколлагена содержит около 1000 аминокислотных остатков. Таким образом, основная структурная единица коллагена имеет очень большие размеры, например в 10 раз больше, чем химотрипсин. Изучение аминокислотного состава и последовательности чередования аминокислот в полипептидных цепях тропоколлагена показало, что существует два типа цепей – цепи α1 и α2, а также четыре разновидности цепи α1: α1 (I), α1 (II), α1 (III) и α1 (IV). В табл. 21.1 представлены данные о структуре коллагенов различных тканей. Как и все белки, коллаген синтезируется клетками из свободных аминокислотных остатков. Аминокислотные остатки, специфичные для молекулы коллагена, гидроксипролин и гидроксилизин не образуются из соответствующих свободных аминокислот. Эти аминокислотные остатки появляются после включения пролина и лизина в полипептидную цепь с участием ферментов пролилгидроксилазы или лизилгидроксилазы и кофактора – аскорбиновой кислоты. Эластин – основной белковый компонент, из которого состоят эластические волокна. Он отличается от коллагена по химическому составу и молекулярной структуре. Общими для эластина и коллагена являются большое содержание глицина и пролина, наличие оксипролина, хотя последнего в эластине примерно в 10 раз меньше, чем в коллагене. Как и в коллагене, в эластине мало метионина и отсутствуют триптофан и цистеин. В отличие от коллагена в эластине значительно больше валина и аланина и меньше глутаминовой кислоты и аргинина. В целом характерной особенностью первичной структуры эластина является слишком малое содержание полярных аминокислотных остатков. При ферментативном гидролизе эластина в гидролизате обнаруживаются десмозин и изодесмозин. Эти соединения содержатся только в эластине. Эластин вместе с коллагеном, протеогликанами и рядом глико- и мукопротеинов является продуктом биосинтетической деятельности фибробластов. Непосредственным продуктом клеточного биосинтеза считается не эластин, а его предшественник – тропоэластин (в коллагене – проколлаген). Тропоэластин не содержит поперечных связей, обладает растворимостью. В последующем тропоэластин превращается в зрелый эластин, нерастворимый, содержащий большое количество поперечных связей. 108.Интенсивный обмен всех структур соединительной ткани ребенка. Повышенное содержание коллагена. 109.Межклеточный матрикс соединительной ткани. Глюкозаминогликаны и протеогликаны: характеристика их полисахаридных групп. Гиалуроновая и хондроитинсерная кислоты, их функции. Образование и катаболизм протеогликанов. Роль гиалуронидазы в метаболизме основного вещества соединительной ткани. Нарушения обмена протеогликанов при патологии. Протеогликаны – высокомолекулярные углеводно-белковые соединения. Они образуют основную субстанцию межклеточного матрикса соединительной ткани. На долю протеогликанов приходится до 30% от сухой массы соединительной ткани. Полисахаридная группа протеогликанов сначала получила название мукополисахаридов. В дальнейшем эти соединения стали называть гликозаминогликанами. Это название и принято в настоящее время. Гликозаминогликаны (мукополисахариды) Гликозаминогликаны соединительной ткани – это линейные неразветвленные полимеры, построенные из повторяющихся дисахаридных единиц. В организме гликозаминогликаны не встречаются в свободном состоянии, т.е. в виде ≪чистых≫ углеводов. Они всегда связаны с большим или меньшим количеством белка. В их состав обязательно входят остатки мономера либо глюкозамина, либо галактозамина. Второй главный мономер дисахаридных единиц также представлен двумя разновидностями: D-глюкуроновой и L-идуроновой кислотами. В настоящее время четко расшифрована структура шести основных классов гликозаминогликанов. Гиалуроновая кислота впервые была обнаружена в стекловидном теле глаза. Из всех гликозаминогликанов гиалуроновая кислота имеет большую мол. массу (100000–10000000). Доля связанного с гиалуроновой кислотой белка в молекуле (частице) протеогликана составляет не более 1–2% от его общей массы. Считают, что основная функция гиалуроновой кислоты в соединительной ткани – связывание воды. В результате такого связывания межклеточное вещество приобретает характер желеобразного матрикса, способного ≪поддерживать≫ клетки. Важна также роль гиалуроновой кислоты в регуляции проницаемости тканей. Приводим структуру повторяющейся дисахаридной единицы в молекуле гиалуроновой кислоты. Дерматансульфат особенно характерен для дермы (кожи). Он резистентен к действию гиалуронидаз (тестикулярной и бактериальной). В этом одно из отличий дерматансульфата от хондроитинсульфатов. Кроме того, в состав дисахаридной единицы дерматансульфата входит L-идуроновая, а не D-глюкуроновая кислота (в малом количестве D-глюкуроновую кислоту можно обнаружить в повторяющихся единицах дерматансульфата). О биологической роли дерматансульфата почти ничего неизвестно. Роль этого гликозаминогликана не может быть сведена только к стабилизации коллагеновых пучков, так как дерматансульфат обнаруживается и в тканях эктодермального происхождения, не содержащих коллагена. Кератансульфат впервые был выделен из роговой оболочки глаза быка, отсюда и название этого гликозаминогликана. В противоположность всем остальным гликозаминогликанам кератансульфат не содержит ни D-глюкуроновой, ни L-идуроновой кислоты. Установлено, что кератансульфат, выделенный из роговицы глаза (кератансульфат I), и кератансульфат, полученный из хрящевой ткани (кератансульфат II), различаются по степени сульфатированности и строению связи между кератансульфатом и пептидной частью протеогликана. Гепарин известен прежде всего как антикоагулянт. Однако его следует относить к гликозаминогликанам, так как он синтезируется тучными клетками, которые являются разновидностью клеточных элементов соединительной ткани. Он может входить в состав протеогликанов; с гликозаминогликанами его объединяет и химическая. Гепаринсульфат в отличие от гепарина в дисахаридных единицах чаще содержит N-ацетильные группы, чем N-сульфатные. Кроме того, степень О-сульфатирования гепаринсульфата ниже, чем гепарина. Биосинтез гликозаминогликанов. Известно, что синтез глюкозамина и глюкуроновой кислоты, входящих в состав гиалуроновой кислоты, происходит из D-глюкозы. Непосредственные предшественники гиалуро- новой кислоты – нуклеотидные (уридиндифосфонуклеотидные) производные N-ацетилглюкозамина и глюкуроновой кислоты. Предшественником углеводных остатков сульфатированных гликозаминогликанов, как и у гиалуроновой кислоты, является молекула D-глюкозы. Далее происходит эпимеризация глюкозамина в галактозамин, а глюкуроновой кислоты при синтезе дерматансульфата – в идуроновую кислоту. Нуклеотидные производные этих соединений утилизируются при биосинтезе сульфатированных гликозаминогликанов, при этом сульфат включается в биосинтез гликозаминогликанов в виде 3'-фосфоаденозин-5'- фосфосульфата (ФАФС). В процессе биосинтеза гликозаминогликанов принимает участие большое количество различных ферментов, в том числе трансфераз. Образование и катаболизм протеогликанов В соединительной ткани все гликозаминогликаны находятся в соединении с белками. Термин ≪протеогликан≫ используют для обозначения веществ, в которых полипептидная и полисахаридная части молекулы соединены прочной ковалентной связью. Примером протеогликана может служить гиалуропротеин, выделенный из синовиальной жидкости и содержащий всего 2,2–2,3% белка. У разных протеогликанов белковые компоненты различны; они не имеют ничего общего с фибриллярными белками соединительной ткани – коллагеном и эластином. Считают, что в большинстве случаев остаток серина служит той точкой полипептидной цепи молекулы протеогликанов, к которой присоединяется гликозаминогликан. В соединительной ткани протеогликаны образуют ряд ≪монтажей≫ последовательно возрастающей сложности, своего рода ≪иерархии≫ макро- молекулярных агрегатов. Функции протеогликанов в соединительной ткани во многом определяются свойствами входящих в их состав гликозаминогликанов. Так, ионообменная активность гликозаминогликанов как полианионов обусловливает активную роль протеогликанов в распределении ряда катионов в соединительной ткани. 110. Мукополисахаридоз у детей – наследственная лизосомальная болезнь накопления. Мукополисахаридозы по характеру возникающих изменений костной системы относятся к заболеваниям, при которых поражаются эпифизы костей. Именно с этим обстоятельством связаны трудности в их распознавании, так как они имеют большое сходство с другими эпифизарными дисплазиями. В некоторых случаях, когда в условиях стационара отсутствуют возможности более полного обследования лиц с имеющейся патологией опорно-двигательного аппарата, возможна постановка неправильного диагноза. Это приводит к неправильному ортопедическому лечению и медико-генетическому консультированию по вопросам дальнейшего деторождения. Все мукополисахаридозы разделяются на две группы в зависимости от возникающих у человека проявлений этой патологии: Гурлер-подобные и Моркио-подобные. Все возможные проявления мукополисахаридозов в Гурлер-подобной группе являются однотипными и различаются между собой в большей степени только по тяжести проявления. В случае такого заболевания дети рождаются абсолютно нормальными, а с течением времени постепенно начинают появляться и прогрессивно нарастают различные костные деформации. Выделяют несколько вариантов: Наиболее тяжело протекает мукополисахаридоз типа 1Н. Первые проявления этого заболевания появляются в первые месяцы жизни ребенка и быстро прогрессируют. Наблюдается резкое снижение умственного развития. К 2—3 годам развивается типичная картина болезни. Но надо помнить, что проявления мукополисахаридоза типа 1Н на первом году жизни очень сходны с проявлениями врожденного гипотиреоза. В случае гипотиреоза у ребенка также отмечается отставание в умственном развитии. Другой тип мукополисахаридоза из Гурлер-подобной группыпо картине костных изменений похож на тип 1Н. Отличием является то, что страдают всегда только мальчики, большая часть из которых имеют светлые волосы и темные густые брови. Для этого типа мукополисахаридоза характерно исчезновение координации движений к 2—6 годам. Ребенок при этом начинает часто падать при ходьбе. Поведение детей становится неровным, а в некоторых случаях даже агрессивным. Они плохо едят твердую пищу. Между лопатками у некоторых детей можно увидеть появление узелкового поражения кожи. Черты лица изменяются не столь резко, как при вышеописанной форме мукополисахаридоза.При мукополисахаридозе типа IS, который также относится к этой группе мукополисахаридозов, первые признаки появляются поздно, как правило, в 3—6-летнем возрасте, и развиваются крайне медленно. Полная картина заболевания выявляется к моменту половой зрелости ребенка. В подростковом возрасте довольно часто при осмотре окулистом выявляется помутнение роговицы глаза. Увеличение размеров печени и селезенки бывает редко. Для данного типа мукополисахаридоза типичным является поражение клапана аорты, что проявляется характерными для этого заболевания признаками. Умственное развитие детей снижено не столь значительно, а иногда не страдает вовсе. Поражение костно-суставной системы при этом заболевании по тяжести является самым легким из всех мукополисахаридозов Гурлер-подобного типа. Следующим типом мукополисахаридоза из группы Гурлер-подобного типа является мукополисахаридоз VI типа — синдром Марото—Лами. Первые признаки данного синдрома появляются после 2-летнего возраста и к 7—9 годам становятся очень характерными. Такие дети достигают роста не более 145—155 см. У них также грубые черты лица, но не настолько, как при мукополисахаридозах VI типа, в суставах выражены контрактуры, дети как бы «скованы» при совершении каких-либо движений. Характерной чертой этого типа мукополисахаридоза является то, что, несмотря на резкую выраженность всех основных проявлений, умственное развитие детей никогда не страдает. Последние два рассмотренных типа мукополисахаридоза сопровождаются всеми характерными изменениями скелета, указанными выше. 111.Биохимия мышц. Состав мышечной ткани. Экстративные (миофибриллярные белки). Важнейшие экстративные вещества мышц: креатин и креатинфосфат. Значение миоглобина, регуляторные белки. Биохимические показатели при поражении мышечной системы. Креатинурия. Мышечный аппарат человека и животных характеризуется полифункциональностью. Однако основной функцией мышц является осуществление двигательного акта, т.е. сокращение и расслабление. При сокращении мышц осуществляется работа, связанная с превращением химической энергии в механическую. В данном разделе в основном рассматривается структурная основа процесса сокращения поперечно-полосатых мышц позвоночных, поскольку этот процесс изучен наиболее полно. Как отмечалось, сократительная система поперечно-полосатой мышцы состоит из перекрывающихся белковых нитей, которые скользят относительно друг друга. Сокращение происходит за счет энергии, освобождающейся пргидролизе АТФ. В поперечно-полосатой мышце сокращение зависит от концентрации ионов Са2+, которая в свою очередь регулируется саркоплазматическим ретикулумом – специализированной системой мембран, накапливающей Са2+ в состоянии покоя и высвобожающей его при воз- действии на мышечное волокно нервного импульса. Источники энергии мышечной деятельности. Прежде всего ресинтез АТФ обеспечивается трансфосфорилированием АДФ с креатинфосфатом. Данная реакция катализируется ферментом креатинкиназой. Креатинкиназный путь ресинтеза АТФ является чрезвычайно быстрым и максимально эффективным (за счет каждой молекулы креатинфосфата образуется молекула АТФ). Именно поэтому долгое время не удавалось установить уменьшение концентрации АТФ и соответственно повышение концентрации АДФ даже при достаточно продолжительном тетанусе. Применив специфический ингибитор креатинкиназы (1-фтор-2,4-динитрофенол), а также с помощью агентов, препятствующих окислительному фосфорилированию АДФ в АТФ, Т. При работе умеренной интенсивности мышца может покрывать свои энергетические затраты за счет аэробного метаболизма. Однако при больших нагрузках, когда возможность снабжения кислородом отстает от потребности в нем, мышца вынуждена использовать гликолитический путь снабжения энергией. При интенсивной мышечной работе скорость расщепления гликогена или глюкозы с образованием молочной кислоты увеличивается в сотни раз. Соответственно содержание молочной кислоты в мышечной ткани может повышаться до 1,0–1,2 г/кг и более. С током крови значительное количество молочной кислоты поступает в печень, где ресинтезируется в глюкозу и гликоген (глюконеогенез) за счет энергии окислительных процессов. Перечисленные механизмы ресинтеза АТФ при мышечной деятельности включаются в строго определенной последовательности. Наиболее экстренным является креатинкиназный механизм, и лишь примерно через 20 с максимально интенсивной работы начинается усиление гликолиза, интенсивность которого достигает максимума через 40–80 с. При более длительной, а следовательно, и менее интенсивной работе все большее значение приобретает аэробный путь ресинтеза АТФ. Содержание АТФ и креатинфосфата в сердечной мышце ниже, чем в скелетной мускулатуре, а расход АТФ велик. В связи с этим ресинтез АТФ в миокарде должен происходить намного интенсивнее, чем в скелетной мускулатуре. Для сердечной мышцы теплокровных животных и человека основным путем образования богатых энергией фосфорных соединений является путь окислительного фосфорилирования, связанный с поглощением кислорода. Регенерация АТФ в процессе анаэробного расщепления углеводов (гликолиз) в сердце человека практического значения не имеет. Именно поэтому сердечная мышца очень чувствительна к недостатку кислорода. Характерной особенностью обмена веществ в сердечной мышце по сравнению со скелетной является также то, что аэробное окисление веществ неуглеводной природы при работе сердечной мышцы имеет большее значение, чем при сокращении скелетной мышцы. Только 30–35% кислорода, поглощаемого сердцем в норме, расходуется на окисление углеводов и продуктов их превращения. Главным субстратом дыхания в сердечной мышце являются жирные кислоты. Окисление неуглеводных веществ обеспечивает около 65–70% потребности миокарда в энергии. Из свободных жирных кислот всердечной мышце особенно легко подвергается окислению олеиновая кислота. 112.Химизм мышечного сокращения. Связь химических процессов в мышце с функцией. Роль кальция в мышечном сокращении. Своеобразие обмена миокарда. Особенности обмена мышечной ткани в состоянии покоя и усиленной работы. Биохимические основы мышечного утомления, значение тренировки мышц. В настоящее время принято считать, что биохимический цикл мышечного сокращения состоит из 5 стадий: 1) миозиновая ≪головка≫ может гидролизовать АТФ до АДФ и Н3РО4 (Pi), но не обеспечивает освобождения продуктов гидролиза. Поэтому данный процесс носит скорее стехиометрический, чем каталитический, характер; 2) содержащая АДФ и Н3РО4 миозиновая ≪головка≫ может свободно вращаться под большим углом и (при достижении нужного положения) связываться с F-актином, образуя с осью фибриллы угол около 90°; 3) это взаимодействие обеспечивает высвобождение АДФ и Н3РО4 из актин-миозинового комплекса. Актомиозиновая связь имеет наименьшую энергию при величине угла 45°, поэтому изменяется угол миозина с осью фибриллы с 90° на 45° (примерно) и происходит продвижение актина (на 10–15 нм) в направлении центра саркомера; 4) новая молекула АТФ связывается с комплексом миозин–F-актин ; 5) комплекс миозин–АТФ обладает низким сродством к актину, и поэтому происходит отделение миозиновой (АТФ) ≪головки≫ от F-актина - расслабление, которое отчетливо зависит от связывания АТФ с актин-миозиновым комплексом. Затем цикл возобновляется. Регуляция сокращения и расслабления мышц. Сокращение любых мышц происходит по общему механизму, описанному ранее. Мышечные волокна разных органов могут обладать различными молекулярными механизмами регуляции сокращения и расслабления, однако всегда ключевая регуляторная роль принадлежит ионам Са2+ . Установлено, что миофибриллы обладают способностью взаимодействовать с АТФ и сокращаться в его присутствии лишь при наличии в среде определенных концентраций ионов кальция. Наибольшая сократительная активность наблюдается при концентрации ионов Са2+ около 10–6–10–5 М. При понижении концентрации до 10–7 М или ниже мышечные волокна теряют способность к укорочению и развитию напряжения в присутствии АТФ. По современным представлениям, в покоящейся мышце (в миофибриллах и межфибриллярном пространстве) концентрация ионов Са2+ поддерживается ниже пороговой величины в результате связывания их структурами (трубочками и пузырьками) саркоплазматической сети и так называемой Т-системой при участии особого Са2+-связывающего белка, получившего название кальсеквестрина, входящего в состав этих структур. Связывание ионов Са2+ разветвленной сетью трубочек и цистерн саркоплазматической сети не является простой адсорбцией. Это активный физиологический процесс, который осуществляется за счет энергии, освобождающейся при расщеплении АТФ Са2+-зависимой. Возможность пребывания живой мышцы в расслабленном состояниипри наличии в ней достаточно высокой концентрации АТФ объясняется снижением в результате действия кальциевой помпы концентрации ионов Са2+ в среде, окружающей миофибриллы, ниже того предела, при котором еще возможны проявление АТФазной активности и сократимость актомиозиновых структур волокна. 113.Роль креатинфосфата в мышечном сокращении у ребенка. Физиологическая креатинурия. Врожденные энзимопатии (фосфорилаза и фосфоглюкомутаза), приводящие к патологии мышечной системы. Креатинфосфат — продукт обратимого метаболического N-фосфорилирования креатина, являющийся, подобно АТФ, высокоэнергетическим соединением. Креатинфосфат содержится преимущественно в возбудимых тканях (мышечная и нервная ткани) и его биологической функцией является поддержание постоянной концентрации АТФ за счёт обратимой реакции перефосфорилирования: креатинфосфат + АДФ ⇔ креатин + АТФ Эта реакция катализируется цитоплазматическими и митохондриальными ферментами-креатинкиназами; при расходе АТФ, например, при сокращении клеток мышечной ткани, равновесие реакции сдвигается в вправо, что ведёт к восстановлению нормальной концентрации АТФ. В тканях креатинфосфат подвергается самопроизвольному неферментативному гидролизу с циклизацией в креатинин, выводящийся с мочой, уровень выделения креатинина зависит от состояния организма, меняясь при патологических состояниях, и является диагностическим признаком. 114.Биохимия мышечной ткани у детей. Скелетные мышцы у новорождённого анатомически сформированы и сравнительно хорошо развиты, их общая масса составляет 20-22% массы тела. К 2 годам относительная масса мышц несколько уменьшается (до 16,6%), а затем в связи с нарастанием двигательной активности ребёнка вновь увеличивается и к 6 годам достигает 21,7%, к 8 - 2728%, а к 15 - 3233%. У взрослых она составляет в среднем 40-44% массы тела. Фасции у новорождённого тонкие, рыхлые, легко отделяются от мышц. Мышцы ребёнка характеризуются рядом функциональных особенностей. Так, у детей отмечают повышенную чувствительность мышц к некоторым гуморальным агентам (в частности, к ацетилхолину). Во внутриутробном периоде скелетные мышцы отличаются низкой возбудимостью. Мышца воспроизводит лишь 3-4 сокращения в секунду. С возрастом число сокращений доходит до 60-80 в секунду. Созревание нервномышечного синапса приводит к значительному ускорению перехода возбуждения с нерва на мышцу. У новорождённых мышцы не расслабляются не только во время бодрствования, но и во сне. Постоянную их активность объясняют участием мышц в теплопродукции (так называемый сократительный термогенез) и метаболических процессах организма, стимуляции развития самой мышечной ткани. Мышечный тонус может быть ориентиром при определении гестационного возраста новорождённого. Гипоксия — состояние кислородного голодания как всего организма в целом, так и отдельных органов и тканей, вызванное различными факторами: задержкой дыхания, болезненными состояниями, малым содержанием кислорода в атмосфере. Вследствие гипоксии в жизненно важных органах развиваются необратимые изменения. Наиболее чувствительными к кислородной недостаточности являются центральная нервная система, мышца сердца, ткани почек, печени. Может вызывать появление необъяснимого чувства эйфории, приводит к головокружениям, низкому мышечному тонусу. В общем случае гипоксию можно определить как несоответствие энергопродукции энергетическим потребностям клетки. Основное звено патогенеза — нарушение окислительного фосфорилирования в митохондриях, имеющее 2 последствия:1. Нарушение образования АТФ → энергодефицит → нарушение энергозависимых процессов, а именно: сокращения — контрактура всех сократимых структур, синтеза — белков, липидов, нуклеиновых кислот, активного транспорта — потеря потенциала покоя, поступление в клетку ионов кальция и воды. 2. Накопление молочной кислоты и кислот цикла Кребса → ацидоз, вызывающий: блокаду гликолиза, единственного пути получения АТФ без кислорода; повышение проницаемости плазматической мембраны; активацию лизосомальных ферментов в цитоплазме с последующим аутолизом клетки. 115.Наличие общей тенденции к повышенной активности окислительно-восстановительных ферментов и усиление сопряженности окисления с фосфорилированием в раннем постанальном онтогенезе. Причины этого явления. 116.Особенности химического состава и метаболизма нервной ткани (дыхание, обмен глюкозы и гликогена, обмен макроэргов, липидов, белков и аминокислот). Обмен мозга при гипоксии. Пептиды и болевые реакции. Дыхание. На долю головного мозга приходится 2–3% от массы тела. В то же время потребление кислорода головным мозгом в состоянии физического покоя достигает 20–25% от общего потребления его всем организмом, а у детей в возрасте до 4 лет мозг потребляет даже 50% кислорода, утилизируемого всем организмом. Во время прохождения через мозг кровь теряет около 8 об.% кислорода. В 1 мин на 100 г мозговой ткани приходится 53–54 мл крови. Следовательно, 100 г мозга потребляет в 1 мин 3,7 мл кислорода, а весь головной мозг (1500 г) – 55,5 мл кислорода. Метаболизм углеводов. Основным субстратом дыхания мозговой ткани является глюкоза. В 1 мин 100 г ткани мозга потребляют в среднем 5 мг глюкозы. Подсчитано, что более 90% утилизируемой глюкозы в ткани мозга окисляется до СО2 и Н2О при участии цикла трикарбоновых кислот. В физиологических условиях роль пентозофосфатного пути окисления глюкозы в мозговой ткани невелика, однако этот путь окисления глюкозы присущ всем клеткам головного мозга. Образующаяся в процессе пентозофосфатного цикла восстановленная форма НАДФ (НАДФН) используется для синтеза жирных кислот и стероидов. Интересно отметить, что в расчете на всю массу головного мозга содержание глюкозы в нем составляет около 750 мг. За 1 мин тканью мозга окисляется 75 мг глюкозы. Следовательно, количество глюкозы, имеющееся в ткани головного мозга, могло бы быть достаточным лишь на 10 мин жизни человека. Метаболизм макроэргов. Интенсивность обновления богатых энергией фосфорных соединений в го- ловном мозге очень велика. Именно этим можно объяснить, что содержание АТФ и креатинфосфата в мозговой ткани характеризуется значитель- ным постоянством. В случае прекращения доступа кислорода мозг может ≪просуществовать≫ немногим более минуты за счет резерва лабильных фосфатов. Метаболизм аминокислот и белков Общее содержание аминокислот в ткани мозга человека в 8 раз превышает концентрацию их в крови. Аминокислотный состав мозга отличается определенной специфичностью. Так, концентрация свободной глутаминовой кислоты в мозге выше, чем в любом другом органе млекопитающих (10 мкмоль/г). На долю глутаминовой кислоты вместе с ее амидом глутамином и трипептидом глутатионом приходится более 50% α-аминоазота головного мозга. Известно, что обмен аминокислот в мозговой ткани протекает в разных направлениях. Прежде всего пул свободных аминокислот используется как источник ≪сырья≫ для синтеза белков и биологически активных аминов. Метаболизм липидов Липиды составляют около половины сухой массы головного мозга. Как отмечалось, в нервных клетках серого вещества особенно много фосфоглицеридов, а в миелиновых оболочках нервных стволов – сфингомиелина. Из фосфоглицеридов серого вещества мозга наиболее интенсивно обновляются фосфатидилхолины и особенно фосфатидилинозитол. Обмен липидов миелиновых оболочек протекает с небольшой скоростью. Холестерин, цереброзиды и сфингомиелины обновляются очень медленно. Ткань головного мозга взрослого человека содержит много холестерина (около 25 г). У новорожденных в головном мозге всего 2 г холестерина; количество его резко возрастает в первый год жизни (примерно в 3 раза), при этом биосинтез холестерина происходит в самой мозговой ткани. У взрослых людей синтез холестерина в головном мозге резко снижается. Основная часть холестерина в зрелом мозге находится в неэтерифици- рованном состоянии, эфиры холестерина обнаруживаются в относительно высокой концентрации в участках активной миелинизации. 117.Химическая основа возникновения и проведения нервного импульса. Механизмы синаптической передачи. Медиаторы: ацетилхолин, катехоламины, серотонин, гаммааминомасляная кислота, гистамин, глутаминовая кислота. Нарушение обмена биогенных аминов. При определенных условиях резко повышается проницаемость мембраны для ионов Na+. В состоянии покоя внутренняя сторона клеточной мембраны заряжена электроотрицательно по отношению к наружной поверхности. Таким образом, на мембранах, ограничивающих нервные клетки, поддерживается разность электрических потенциалов (трансмембранная разность электрических потенциалов); эти мембраны электрически возбудимы. При возбуждении, вызванном тем или иным агентом, селективно изменяется проницаемость мембраны нервной клетки (аксона): увеличиваетсяизбирательно для ионов Na+ (примерно в 500 раз) и остается без изменения для ионов К+. В результате ионы Na+ устремляются внутрь клетки. Компенсирующий поток ионов К+, направляющийся из клетки, несколько запаздывает. Это приводит к возникновению отрицательного заряда на наружной поверхности клеточной мембраны. Внутренняя поверхность мембраны приобретает положительный заряд; происходит перезарядка клеточной мембраны (в частности, мембраны аксона, т.е. нервного волокна), и возникает потенциал действия, или спайк. Продолжительность спайка не превышает 1 мс. Он имеет восходящую фазу, пик и нисходящую фазу. Нисходящая фаза (падение потенциала) связана с нарастающим преобла- данием выхода ионов К+ над поступлением ионов Na+ – мембранный потенциал возвращается к норме. После проведения импульса в клетке восстанавливается состояние покоя. Некоторые заболевания, например рассеянный склероз, характеризуются демиелинизацией и нарушением проведения нервного импульса. Другим не менее важным процессом для нервной ткани является передача нервного импульса от одной нервной клетки к другой или воздействие на клетки эффекторного органа. Роль медиаторов в передаче нервных импульсов Связь миллиардов нейронов мозга осуществляется посредством медиаторов. Химическое вещество можно отнести к числу медиаторов лишь в том случае, если оно удовлетворяет ряду критериев. В нервных волокнах должны содержаться ферменты, необходимые для синтеза этого вещества. При раздражении нервов это вещество должно выделяться, реагировать со специфическим рецептором на постсинаптической клетке и вызывать биологическую реакцию – ацетилхолин и норадреналин. Содержащие их нервы называют соответственно холинергическими и адренергическими. В соответствии с этим все эфферентные системы делят на холинорецепторы и адренорецепторы. Ряд других химических веществ удовлетворяют многим, но не всем перечисленным критериям. К таким медиаторам относят дофамин, адреналин, серотонин, октопамин, гистамин, ГАМК и др. Обширная группа холинорецепторов весьма неоднородна как в струк- турном, так и в функциональном отношении. Объединяют их медиатор ацетилхолин и общая схема строения синапса. Ацетилхолин - представляет собой сложный эфир уксусной кислоты и холина. Он синтезируется в нервной клетке из холина и активной формы ацетата – ацетилкоэнзима А при помощи специального фермента холинацетилтрансферазы (холинацетилазы). Этот фермент удаляет аминогруппу (—NH2) у норадреналина, серотонина, дофамина и адреналина, тем самым инактивируя указанные медиаторы. Норадреналин быстро исчезает из синаптической щели в результате вторичного поглощения симпатическими нервами; вновь оказавшись в нервном волокне, медиатор, естественно, не может воздействовать на постсинаптические клетки. Адренергическая и холинергическая системы головного мозга тесно взаимодействуют с другими системами мозга, в часто использующими серотонин в качестве медиатора. В основном серотонинсодержащие нейроны сосредоточены в ядрах мозгового ствола. Нейромедиаторная роль серотонина осуществляется в результате взаимодействия серотонина со специфическими серотонинергическими рецепторами. Исследования, проведенные с ингибитором синтеза серотонина n-хлорфенилаланином, а также с другими ингибиторами, дают основания считать, что серотонин влияет на процессы сна. Выявлено также, что торможение кортикостероидами секреторной активности гипофиза оказывается менее эффективным у тех животных, мозг которых беднее серотонином. Важным нейромедиатором, выполняющим тормозные функции, является γ-аминомасляная кислота (ГАМК), количество которой в головном мозге во много раз больше, чем других нейромедиаторов. Так, в гипоталамусе суммарное содержание ацетилхолина, норадреналина, дофамина и серотонина не превышает 10 мкг/г, в то время как ГАМК в этом отделе головного мозга более 600 мкг/г. ГАМК увеличивает проницаемость постсинаптических мембран для ионов К+ и тем самым отдаляет мембранный потенциал от порогового уровня, при котором возникает потенциал действия; таким образом, ГАМК – это тормозной нейромедиатор. ГАМК образуется при декарбоксилировании глутамата в реакции, катализируемой глутаматдекарбоксилазой: 118.Своеобразие химического состава и метаболических процессов мозга плода и у ребенка раннего возраста. Серое вещество головного мозга представлено в основном телами нейронов, а белое вещество – аксонами. В связи с этим указанные отделы мозга значительно различаются по своему химическому составу. Эти различия носят прежде всего количественный характер. Содержание воды в сером веществе головного мозга заметно больше, чем в белом. В сером веществе белки составляют половину плотных веществ, а в белом веществе – одну треть. На долю липидов в белом веществе приходится более половины сухого остатка, в сером веществе – лишь около 30%. Масса мозга у плода в 18 нед. равна 67 г, у плода в 24 нед. — 127 г, в 32 нед. — 170 г. В дальнейшем продолжается более быстрое развитие мозга плода и в 40 нед. масса мозга плода составляет 382 г. 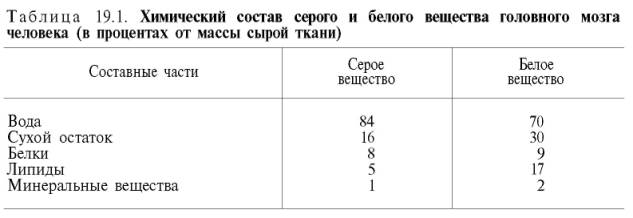 119.Биохимия печени. Структура и химический состав ткани печени. Регуляция углеводного и липидного обменов. Регуляция обмена белков, аминокислот, азотистых оснований, синтеза мочевины. Участие печени в метаболизме витаминов, водно-солевом обмене. Роль печени как депо. Экскреторная функция обезвреживания: реакции конъюгации с таурином и глицином, глюкуроновой и серной кислотами, реакции метилирования. Участие печени в обезвреживании экотоксинов при микросомальном окислении. У взрослого здорового человека масса печени составляет в среднем 1,5 кг. В печени может содержаться 150–200 г гликогена. Количество железа, меди, марганца, никеля и некоторых других элементов превышает их содержание в других органах и тканях. Основная роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы в крови. Синтез гликогена из глюкозы обеспечивает в норме временный резерв углеводов, необходимый для поддержания концентрации глюкозы в крови в тех случаях, если ее содержание значительно уменьшается (например, у человека это происходит при недостаточном поступлении углеводов с пищей или в период ночного ≪голодания≫). Ферментные системы печени способны катализировать все реакции или значительное большинство реакций метаболизма липидов. Совокупность этих реакций лежит в основе таких процессов, как синтез высших жирных кислот, триглицеридов, фосфолипидов, холестерина и его эфиров, а также липолиз триглицеридов, окисление жирных кислот, образование ацетоновых (кетоновых) тел и т.д. При высоком содержании жирных кислот в плазме их поглощение печенью возрастает, усиливается синтез триглицеридов, а также окисление жирных кислот, что может привести к повышенному образованию кетоновых тел. Печень играет центральную роль в обмене белков. Она выполняет следующие основные функции: синтез специфических белков плазмы; образование мочевины и мочевой кислоты; синтез холина и креатина; трансаминирование и дезаминирование аминокислот, что весьма важно для взаимных превращений аминокислот, а также для процесса глюконеогенеза и образования кетоновых тел. В организме образование мочевины в основном происходит в печени. Детоксикация различных веществ в печени. Чужеродные вещества (ксенобиотики) в печени нередко превращаются в менее токсичные и даже индифферентные вещества. Происходит это путем окисления, восстановления, метилирования, ацетилирования и конъюгации с теми или иными веществами. Необходимо отметить, что в печени окисление, восстановление и гидролиз чужеродных соединений осуществляют в основном микросомальные ферменты. Наряду с микросомальным в печени существует также пероксисомальное окисление. Пероксисомы – микротельца, обнаруженные в гепатоцитах; их можно рассматривать как специализированные окислительные органеллы. Эти микротельца содержат оксидазу мочевой кислоты, лактатоксидазу, оксидазу D-аминокислот, а также каталазу. Последняя катализирует расщепление перекиси водорода, которая образуется при действии указанных оксидаз; отсюда и название этих микротелец – пероксисомы. 120.Важность определения функционального состояния печени в детском возрасте. Печень у детей относительно большая, у новорожденных она составляет около 4 % массы тела (у взрослых — 2 % массы тела). У детей раннего возраста желчеобразование менее интенсивное, чем у детей более старшего возраста. Желчь детей бедна желчными кислотами, холестерином, лецитином, солями и щелочью, но богата водой, муцином, пигментами и мочевиной, а также больше содержит таурохолевой, чем гликохолевой кислоты. Важно отметить, что таурохолевая кислота является антисептиком. Желчь нейтрализует кислую пищевую кашицу, что делает возможной деятельность поджелудочного и кишечного секретов. Кроме того, желчь активирует панкреатическую липазу, эмульгирует жиры, растворяет жирные кислоты, превращая их в мыла, усиливает перистальтику толстого отдела кишечника. Таким образом, система органов пищеварения у детей отличается рядом анатомо-физиологических особенностей, которые отражаются на функциональной способности этих органов. У ребенка на первом году жизни потребность в пище относительно большая, чем у детей старшего возраста. Хотя у ребенка имеются все необходимые пищеварительные ферменты, функциональная способность органов пищеварения ограничена и может быть достаточной только при условии, если ребенок получает физиологическую пищу, а именно женское молоко. Даже небольшие отклонения в количестве и качестве пищи могут вызвать у грудного ребенка расстройства пищеварения (особенно часты они на 1-м году жизни) и в конечном итоге привести к отставанию физического развития. 121.Возрастные особенности процессов гниения в желудочно-кишечном тракте ребенка. В условиях ослабления защитных свойств организма, преимущество в размножении могут получить гнилостные микробы или грибковая флора, что приводит к развитию местных воспалительных процессов (стоматит, заеды, бронхит, энтерит, налеты на слизистых и т.д.). Развитие гнилостной флоры в кишечнике приводит к возникновению процессов гниения (разложение белков с образованием фенола, скатола, индола, крезола, сероводорода, аммиака и др. токсических веществ), и процессов брожения. Образующиеся продукты гниения и брожения, а также растяжение кишечника газами обуславливает возникновение ряда симптомов: расстройство стула, метеоризм, отрыжку, неприятный вкус во рту, боли разного характера (колики, спазмы). Внутрикишечное образование токсических веществ ведет к повышенному проникновению их в кровоток, что сопровождается нарушением общего самочувствия (утомляемость, раздражительность, головные боли, сосудистая дистония и др.), а также развитием симптомов непереносимости определенных пищевых продуктов (аллергия). Нарушение пищеварительных процессов при дисбактериозе приводит к нарушению обмена веществ - жирового, углеводного, белкового, водно-солевого, обмена витаминов. К признакам нарушения обмена относят потерю веса, недостаток выделения желчных кислот, дефицит жирорастворимых витаминов (сухость кожи, ухудшение зрения). При дисбиозе происходит активное снижение усвоения кальция, что приводит к остеопорозу (ломкость костей, онемение пальцев рук и ног, судороги). 122.Перинатальный период в развитии организма. Эмбриональный и фетальный этапы. Особенности обмена веществ в фетальном периоде. Единая функциональная биохимическая система: мать – плацента – плод. Специфика обмена плаценты. В эмбриональном периоде выделяют три основных этапа: дробление, гаструляцию и первичный органогенез. Эмбриональный период онтогенеза начинается с момента оплодотворения и продолжается до выхода зародыша из яйцевых оболочек. Фетальный этап развития организма – часть внутриутробного периода жизнедеятельности организма, характеризующаяся образованием, становлением, ростом органов, сменяет эмбриональный и продолжается до родов (рождения детеныша). Перинатальный период — период от 28 недели беременности, включающий период родов и заканчивающийся через 168 часов после рождения. Перинатальный период является важнейшим этапом, обусловливающим в дальнейшем физическое, нервно-психическое и интеллектуальное развитие ребенка. В перинатальном периоде происходит созревание функций, необходимых для самостоятельного существования организма новорожденного. Его функциональные системы к моменту родов хотя и несовершенны, но достаточны для обеспечения жизнеспособности в ходе родов, когда плод испытывает воздействие изгоняющих сил матки и недостаток кислорода. Во время физиологических родов наблюдается выраженная активация гипофизарно-надпочечниковой системы роженицы и эндокринных желез плода, что проявляется повышением концентрации кортазола и гормонов роста, особенно выраженной при гипоксии плода. Характер родов и способ родоразрешения определяют степень и характер реакций адаптации плода и новорожденного. Так, при родах через естественные родовые пути у плода наблюдается последовательная активация функций коры надпочечников, щитовидной железы и гипофиза. У новорожденных, извлеченных путем кесарева сечения, отмечаются одновременная активация функций коры надпочечников и щитовидной железы, усиленный выброс в кровеносные сосуды эритроцитов и лейкоцитов впервые же минуты после рождения. Система "мать – плацента – плод" – функциональная система, возникшая сразу же после зачатия. Направлена система "мать – плацента – плод" на поддержание оптимальных условий развития эмбриона, а затем плода в организме и связана со сложными и взаимообусловливающими адаптационными процессами. Функциональная система "мать – плацента – плод" имеет ряд особенностей: 1) срок существования данной функциональной системы ограничен сроком беременности, т. е. непосредственно временем развития эмбриона и плода до момента рождения; 2) данная функциональная система может сформироваться только в организме женщины со всеми присущими ему физиологическими особенностями; 3) при формировании и становлении функциональной системы мать – плацента – плод задействованы как нормальные с точки зрения анатомии и физиологии процессы, так и патологические, которые также необходимы для прогрессирования гестационного процесса и развития плода (инвазивный рост трофобласта, гестационные изменения спиральных артерий и др.); 4) во время становления и существования данной функциональной системы имеют место определенные «критические периоды». 123.Характеристика периода новорожденности и его биохимические аспекты. Биохимические сдвиги новорожденного впервые часы постнатального периода. Период новорожденности, или неонатальный, начинается с момента рождения ребенка, первого вдоха и перевязки пуповины. Первые минуты и дни жизни характеризуются реакциями адаптации систем и органов к новым условиям окружающей среды. Адаптация ребенка протекает благополучно при продолжающейся тесной физической, иммунобиологической и психоэмоциональной связи с мамой. У доношенных детей целесообразно пережимать пуповину через 1-1,5 минуты после рождения, у недоношенных - через 1,5-2 минуты, т.е. после первого вдоха. Пережатие пуповины и выключение плацентарного кровотока приводит к перестройке кровообращения у ребенка: повышению давления в большом круге кровообращения. Под воздействием первого вдоха и рефлекторного сокращения дыхательных мышц (в большей степени диафрагмы) в грудной клетке создается отрицательное давление, способствующее засасыванию атмосферного воздуха в дыхательные пути. В механизме расправления легких большое значение имеет сосудистый компонент. Заполнение кровью легочных сосудов приводит к медленному расширению мелких ветвей легочной артерии и заканчивается к 4-5 дням жизни. Сурфактантная система, выстилающая эпителий бронхов и бронхиол, изменяет в них силу поверхностного натяжения во время вдоха и выдоха. Эта саморегулирующая многокомпонентная система, в которой большое значение имеют дисдилимеры, отличающиеся высоким содержанием ненасыщенных жирных кислот, играет особую роль в расправлении и остаточной функциональной емкости легких. В первую неделю жизни у новорожденного частота дыхания колеблется от 30 до 60 в минуту и зависит от функционального состояния органов и систем и особенностей метаболизма. В первую неделю жизни выявляется физиологический ацидоз и снижение напряжения кислорода в крови, изменяются глюкоза и липиды крови. В качестве источников энергии в этот момент используются высокие концентрации неэстерифицированных жирных кислот. Метаболические процессы в жировой ткани протекают активно. 124.Своеобразие метаболизма ребенка и его регуляция в различные возрастные периоды. Биохимические критерии, характеризующие отдельные возрастные этапы. Особенностью метаболизма растущего организма является анаболическая направленность, которую определяет специфичное функционирование генного аппарата и возрастающее в процессе роста регуляторное влияние нейроэндокринной системы. Процессы обмена у растущего организма могут быть замедлены или нарушены под влиянием внешних воздействий (дефекты вскармливания и питания, инфекционные болезни), а также наследственных факторов (наследственные болезни обмена веществ). Особенно легко нарушается обмен веществ в критические периоды, когда меняется интенсивность реакций обмена или происходит его качественная перестройка.
|
