Классификация основных процессов химической технологии
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
|
Кристаллизация. Способы проведения,назначение и области применения К 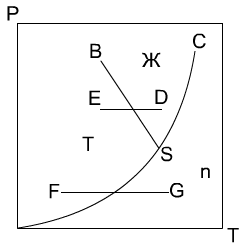 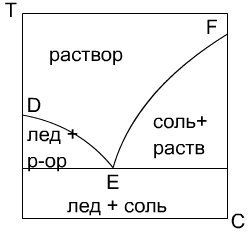 ристалл-ей наз-ют выделение тв-ой фазы в виде кристаллов из растворов, расплавов или паров. Кристаллы представляют собой твердые однородные тела различной геом-ой формы ограниченной плоскими гранями. К каждому хим-му соединению обычно соответствует одна или несколько кристаллических форм, отличающиеся положением и числом осей симметрии и наз-ся полиморфными разновидностями или модификациями. Кристаллы, включ-ие в состав молекулы воды, наз-ся кристаллогидратами. Равновесие в процессах кристаллизации. Равновесные соотношения между паром, жид-ю и тв-ой фазой в широком интервале темп-ур и давлением отображаются на фазовой диаграмме или диаграмме состояния (т.е. давление от темп-ры). На этой диаграмме линия AS характеризует равновесие между тв-ой и паровой фазами. Линия SC - между расплавом и паровой фазой и линия SB - между кристаллами и расплавом. Точка S - так наз-ая тройная точка, соответствует давлению и темп-ре при которых равновесие находится все три фазы. Кристаллизация из расплавов осуществляется путем их охлаждения. Этот процесс изображается на диаграмме DE. При более низких давлениях, чем давление соответствующее точки S, тв-ое вещ-о не может расплавиться и в этих условиях происходит процесс сублимации, т.е. перехода вещ-ва из тв-го сост-ия в паровое минуя ж-го. Сублимацию применяют для очистки веществ от не летучих примесей. На фазовой диаграмме процесс сублимации изображается рабочей линией FG. Обратному процессу десублимации соответствует рабочая линия GF. На фазовое равновесие двухкомпонентных систем могут оказывать влияние три параметра: температур, давление и концентрация. Но при кристалл-ии из раст-ов основной интерес представляет равновесие между ж-ой и тв-ой фазами мало зависящие от давления. Поэтому фазовые превращения могут быть представлены на диаграмме темп-ра-конц-ия. На фазовой диаграмме двухкомпонентной системы линия FE явл-ся геом-им местом точек соответствующих насыщенным раст-ам, а линия ED, находящаяся в равновесии со льдом, т.е. линия FE является кривой растворимости соли в воде, линия ED соответствует условиям выделения льда в системе соль-вода. Т.е. явл-ся эвтектической т-ой сист-ы, в которой р-ор находится в равновесии с двумя тв-ми фазами: солью и льдом. ристалл-ей наз-ют выделение тв-ой фазы в виде кристаллов из растворов, расплавов или паров. Кристаллы представляют собой твердые однородные тела различной геом-ой формы ограниченной плоскими гранями. К каждому хим-му соединению обычно соответствует одна или несколько кристаллических форм, отличающиеся положением и числом осей симметрии и наз-ся полиморфными разновидностями или модификациями. Кристаллы, включ-ие в состав молекулы воды, наз-ся кристаллогидратами. Равновесие в процессах кристаллизации. Равновесные соотношения между паром, жид-ю и тв-ой фазой в широком интервале темп-ур и давлением отображаются на фазовой диаграмме или диаграмме состояния (т.е. давление от темп-ры). На этой диаграмме линия AS характеризует равновесие между тв-ой и паровой фазами. Линия SC - между расплавом и паровой фазой и линия SB - между кристаллами и расплавом. Точка S - так наз-ая тройная точка, соответствует давлению и темп-ре при которых равновесие находится все три фазы. Кристаллизация из расплавов осуществляется путем их охлаждения. Этот процесс изображается на диаграмме DE. При более низких давлениях, чем давление соответствующее точки S, тв-ое вещ-о не может расплавиться и в этих условиях происходит процесс сублимации, т.е. перехода вещ-ва из тв-го сост-ия в паровое минуя ж-го. Сублимацию применяют для очистки веществ от не летучих примесей. На фазовой диаграмме процесс сублимации изображается рабочей линией FG. Обратному процессу десублимации соответствует рабочая линия GF. На фазовое равновесие двухкомпонентных систем могут оказывать влияние три параметра: температур, давление и концентрация. Но при кристалл-ии из раст-ов основной интерес представляет равновесие между ж-ой и тв-ой фазами мало зависящие от давления. Поэтому фазовые превращения могут быть представлены на диаграмме темп-ра-конц-ия. На фазовой диаграмме двухкомпонентной системы линия FE явл-ся геом-им местом точек соответствующих насыщенным раст-ам, а линия ED, находящаяся в равновесии со льдом, т.е. линия FE является кривой растворимости соли в воде, линия ED соответствует условиям выделения льда в системе соль-вода. Т.е. явл-ся эвтектической т-ой сист-ы, в которой р-ор находится в равновесии с двумя тв-ми фазами: солью и льдом. С 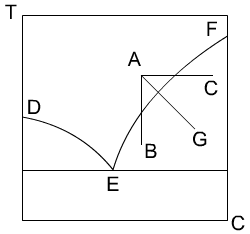 пособы проведения кристаллизации: 1. Кристалл-ия с измен-ем темп-ры раствора. Такой способ наз-тся изогидрическим, т.к. он осущ-ся при пост-ом содержании раств-ля в растворе. На фазовой диаграмме он изображается рабочей линией AB. Этот процесс проводят в ап-ах как периодического, так и непрерывного действия, одиночных и многокорпусных располагаемых каскадом. В качестве охлаждающей среды принимают воздух, воду, холодильные рассолы. Для кристалл-ии солей, растворимость которых понижается с увел-ем темп-ры, применяют нагревание. 2. Кристалл-ия с удал-ем части раств-ля. Частичное удаление раств-ля производят его испарением, реже вымораживанием. Растворитель испаряют в выпарных ап-ах, подводя к нему тепло через стенку. Как правило, и в тех же ап-ах осущ-ся кристалл-ия. Отделение кристалла от раствора производят вне ап-та на фильтрах или центрифугах. Этот способ кристалл-ии наз-ся изотермическим. На диаграмме он изображается рабочей линией AC. 3. Комбинированный способ – вакуум – кристаллизация. В этом способе испарение раств-ля происходит не путем подвода тепла через стенку, а за счет отдачи раствором своего физического тепла. Пары растворителя откачиваются вакуум-насосом, раствор при этом охлаждается до темп-ры кипения соответст-ей данному остаточному давлению. Процесс протекает адиабатически. Рабочая линия процесса AG. 4. Кристалл-ия с испарением части раств-ля в токе носителя. В этом способе раствор-ль испар-ся в движущийся непосредственно над раствором воздух, одновременно раствор охлаждается. Кроме рассматриваемых способов кристалл-ю осуществляют высаливанием, когда перенасыщение в растворе создается путем добавления в систему какого-либо вещ-ва снижающего растворимость вещ-ва в раств-ле. Добавляемое вещ-во наз-ют высаливателем. пособы проведения кристаллизации: 1. Кристалл-ия с измен-ем темп-ры раствора. Такой способ наз-тся изогидрическим, т.к. он осущ-ся при пост-ом содержании раств-ля в растворе. На фазовой диаграмме он изображается рабочей линией AB. Этот процесс проводят в ап-ах как периодического, так и непрерывного действия, одиночных и многокорпусных располагаемых каскадом. В качестве охлаждающей среды принимают воздух, воду, холодильные рассолы. Для кристалл-ии солей, растворимость которых понижается с увел-ем темп-ры, применяют нагревание. 2. Кристалл-ия с удал-ем части раств-ля. Частичное удаление раств-ля производят его испарением, реже вымораживанием. Растворитель испаряют в выпарных ап-ах, подводя к нему тепло через стенку. Как правило, и в тех же ап-ах осущ-ся кристалл-ия. Отделение кристалла от раствора производят вне ап-та на фильтрах или центрифугах. Этот способ кристалл-ии наз-ся изотермическим. На диаграмме он изображается рабочей линией AC. 3. Комбинированный способ – вакуум – кристаллизация. В этом способе испарение раств-ля происходит не путем подвода тепла через стенку, а за счет отдачи раствором своего физического тепла. Пары растворителя откачиваются вакуум-насосом, раствор при этом охлаждается до темп-ры кипения соответст-ей данному остаточному давлению. Процесс протекает адиабатически. Рабочая линия процесса AG. 4. Кристалл-ия с испарением части раств-ля в токе носителя. В этом способе раствор-ль испар-ся в движущийся непосредственно над раствором воздух, одновременно раствор охлаждается. Кроме рассматриваемых способов кристалл-ю осуществляют высаливанием, когда перенасыщение в растворе создается путем добавления в систему какого-либо вещ-ва снижающего растворимость вещ-ва в раств-ле. Добавляемое вещ-во наз-ют высаливателем.При выделении неорганических соединений используют органические вещества (напр., Na2SO4 кристаллизуют, добавляя к его водному раствору метанол, этанол либо NH3). |
