10 гидролиз. Конспект Гидролиз солей 10 класс Тип урока изучения нового материала Цели урока сформировать у учащихся понятие гидролиза солей Планируемые результаты
 Скачать 71.5 Kb. Скачать 71.5 Kb.
|
|
План- конспект «Гидролиз солей» 10 класс Тип урока: изучения нового материала Цели урока:сформировать у учащихся понятие гидролиза солей Планируемые результаты: Сформировать понятие о гидролизе солей; углубить знания учащихся об обратимых химических реакциях,; научиться составлять ионные уравнения гидролиза; закрепить практические навыки определения среды раствора; установить взаимосвязи между строением и свойствами солей; самостоятельно применить усвоенные и закрепленные ранее знания для получения и систематизации информации о классификации солей;Оборудование: универсальный индикатор;набор солей;оборудование и реактивы для демонстрационного эксперимента и эксперимента учащихся. Ход урока: 1.Организационный момент. 2.Актуализация. опорных знаний Как и любой вопрос, имеющий большое практическое значение и применение, основан на теории, а именно теории протекания химических явлений, теории растворов. Поэтому мы должны повторить основные идеи и понятия, имеющие непосредственное отношение к теме урока. Назовите формулы сильных оснований. Назовите формулы слабых оснований. Назовите формулы сильных кислот. Назовите формулы слабых кислот. По какому признаку эти вещества классифицируют на сильные и слабые? Какие ионы образуются при диссоциации оснований? Какова среда раствора в данном случае? Какие ионы образуются при диссоциации кислот? Какова среда раствора? Сделайте вывод, присутствие каких ионов обуславливает щелочную и кислотную реакцию среды. Как изменится цвет лакмуса в щелочной и кислотной среде? Постановка проблемного вопроса .Какова окраска лакмуса в растворах солей хлорида натрия, сульфата цинка, карбоната натрия. Ответы учащихся, обоснование предположений. Подтвердим ваши ответы экспериментом. Создание проблемной ситуации Химический эксперимент. Перед вами три пробирки, в которых растворы хлорида натрия, сульфата цинка, карбоната натрия. Добавляем раствор лакмуса Какова окраска лакмуса в растворах данных солей. Какова среда растворов? Какие ионы обусловливают данную среду? Откуда они появились? Можем ли мы, основываясь на имеющихся знаниях, объяснить результаты опыта? Действительно, вы столкнулись с неизвестным пока для вас явлением, которое не можете грамотно истолковать на основании имеющегося у вас опыта и знаний. 3 Мотивация учебной деятельности Это явление – гидролиз солей в водных растворах, и ему мы посвятим сегодняшний урок. Он логически продолжает изучение закономерностей протекания химических реакций, смещения равновесия обратимых процессов и является одним из существенных вопросов теории растворов. Понимание процессов, происходящих при гидролизе солей, необходимо для объяснения явлений, происходящих в живых организмах, природных комплексах и системах. Многие вопросы биологии, медицины, гидрологии связаны с явлением гидролиза солей, поскольку он является основой их устойчивости и равновесия. 4. Изучение нового материала Рассмотрим название явления «гидролиз». Данный термин состоит из двух составных частей от греческого «гидро» – вода, «лизис» – разложение. Дословно, гидролиз – разложение водой. Гидролиз — одно из важнейших химических свойств солей. Рассмотрим подробнее процесс их гидролиза. Соль мы рассматриваем как продукт взаимодействия кислоты и основания. Можно выделить 4 типа солей. Обратимся к схеме: Соль, образованная сильным основанием и сильной кислотой Соль, образованная слабым основанием и сильной кислотой. Соль, образованная сильным основанием и слабой кислотой. Соль, образованная слабым основанием и слабой кислотой. эксперимент с раствором соли хлорид натрия. Поместим в пробирку раствор данной соли и добавим лакмусовую бумагу. Что вы наблюдаете? (Изменение окраски - не происходит). Для сравнения в другую пробирку пометим дистиллированную воду и так же добавим лакмусовую бумагу. Что мы наблюдаем? (изменение окраски, также не происходит). Какой вывод мы можем сделать на основе этих наблюдений? (Раствор соли хлорид натрия так же как и дистиллированная вода имеет pH=7, среда нейтральная). Используя таблицу растворимости, проанализируем состав соли. (Соль NaCl образованна кислотой HCl и гидроксидом натрия NaOH). Какой силы эти электролиты? (Соляная кислота – сильный электролит, гидроксид натрия – сильное растворимое основание, щелочь). Предлагаю одному из учащихся составить уравнение реакции гидролиза, записав его на доске: NaCl ↔ Na+ + Cl –   HOH ↔ OH – + H+  NaCl + HOH ↔ NaOH + HCl Na+ + Cl – + HOH ↔ Na+ + OH – + H+ + Cl – HOH ↔ OH – + H+ pH=7, [H+] = [OH –]. Учащиеся делают вывод: силы электролитов равны и записывают определение: Раствор соли, образованной сильным основанием и сильной кислотой имеет нейтральную среду, т.к. равенство концентраций ионов водорода и гидроксид-ионов не нарушено. Можно сказать, что такие соли гидролизу не подвергаются. Эксперимент с раствором хлорида меди (II). В раствор хлорида меди (II) и опустим в него индикаторную бумагу (лакмус). Что мы наблюдаем? (Окраска раствора становится красной.) Для сравнения в другую пробирку поместим раствор соляной кислоты и также опустим в него лакмусовую бумагу. Что мы наблюдаем теперь? (Окраска раствора так же становится красной.) Какой вывод мы можем сделать на основе этих наблюдений? (Раствор соли хлорида меди (II) также как и раствор кислоты имеет pH<7, среда кислая). Действительно, убедимся в этом используя данные таблицы растворимости. Проанализируем состав соли. Соль можно рассматривать как продукт реакции нейтрализации основания кислотой. Каким основанием и какой кислотой может быть образованна эта соль? какими электролитами являются эти основание и кислота? (Соль СиCl2 образована слабым основанием Сu(OH)2 (нерастворимое основание) и сильной кислотой HCl). Рассмотрим, что же происходит при взаимодействии соли с водой? Составим уравнение реакции: молекулярное, полное и сокращенное ионные. C 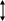 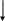 uCl2 ↔ Cu2+ + 2Cl – uCl2 ↔ Cu2+ + 2Cl – HOH ↔ OH – + H+ C  uCl2 + HOH ↔ HCl + CuOHCl uCl2 + HOH ↔ HCl + CuOHClCu2+ + 2Cl – + HOH ↔ H+ + Cl – + CuOH+ + 2Cl – Cu2+ + HOH ↔ CuOH+ + H+ pH<7, [H+] > [OH –]. Учащиеся делают вывод: что сильнее, того и больше. И записывают определение: Раствор соли, образованной слабым основанием и сильной кислотой, имеет кислую среду, т.к. имеется избыток ионов водорода.(гидролиз по КАТИОНУ) Объясним эксперимент с раствором карбоната натрия. Поместим в пробирку раствор данной соли и опустим в него лакмусовую бумагу. Что вы наблюдаете? (бумага окрасилась в синий цвет). Для сравнения в другую пробирку пометим раствор гидроксида натрия и так же опустим лакмус. Что мы наблюдаем? (бумага окрасилась в синий цвет). Какой вывод мы можем сделать на основе этих наблюдений? (Раствор соли карбонат натрия так же как и раствор гидроксида натрия имеет pH>7, среда щелочная). Используя таблицу растворимости, проанализируем состав соли. (Соль Na2CO3 образованна угольной кислотой H2CO3 и гидроксидом натрия NaOH). Какой силы эти электролиты? (Угольная кислота – слабая летучая кислота, гидроксид натрия – сильное растворимое основание, щелочь). Предлагаю одному из учащихся составить уравнение реакции гидролиза, записав его на доске: H 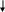 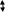 2O ↔ H+ + OH- 2O ↔ H+ + OH- Na2CO3 ↔ CO32-+ 2Na+  Na2CO3 + HOH ↔ NaOH + NaHCO3 2Na+ + CO32 – + HOH ↔ Na+ + OH – + Na+ + HCO3 – CO32 – + HOH ↔ OH – + HCO3 – pH>7, [H+] < [OH –]. Учащиеся убеждаются в правильности вывода: что сильнее, того и больше. И записывают определение: Раствор соли, образованной сильным основанием и слабой кислотой, имеет щелочную среду, т.к. имеется избыток гидроксид-анионов.(гидролиз по АНИОНУ) Какой еще может быть случай образования солей? (Соль может быть образованна слабым основанием и слабой кислотой) C 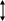 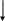 uCO3 ↔ Cu2+ + CO32 – uCO3 ↔ Cu2+ + CO32 – HOH ↔ OH – + H+ CuCO3 + 2HOH → Cu(OH)2↓+ CO2↑+ H2O Раствор соли, образованной слабым основанием и слабой кислотой имеет среду разную, т.к. равенство концентраций ионов водорода и гидроксид-ионов определяется константой диссоциации образующихся при гидролизе веществ. (гидролиз и по КАТИОНУ и по АНИОНУ) Очевидно, такому же необратимому гидролизу подвергается соль карбонат меди (II) Учащийся делает вывод: Соли, образованные слабым основанием и слабой летучей кислотой, подвергаются необратимому гидролизу, т.е. полностью разлагаются 5. Закрепление изученного материала ( 3группы. Каждой группе провести опыт и заполнить таблицу на основе раствора одной соли: сульфат калия, нитрат магния, сульфид натрия) Работать будет три группы, в которых вы распределяете свои роли: теоретики, аналитики, оформители, докладчики. Планируете свою работу, активно работаете, каждый в соответствии со своей ролью и сообща. При необходимости консультируетесь. Продумываете форму презентации своего мини – проекта. Осуществляете презентацию своей деятельности. Отвечаете на вопросы. По мере выступления члены каждой группы заполняют таблицу. Презентация мини-проектов.Внести эти данные в таблицу: Гидролиз солей
6. Рефлексия Думаю, теперь мы сможем сформулировать определение понятия «гидролиз» Проанализируйте записи молекулярных уравнений рассмотренных процессов: К какому типу мы отнесем данные реакции? Какие вещества в них участвуют? В чем заключается сущность гидролиза? Какие продукты данных взаимодействий с точки зрения теории электролитической диссоциации мы получили? Итак, гидролиз – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита. -Оценка деятельности групп - Оценка деятельности учащихся работы своей группы 6. Домашнее задание: |
