Письмова робота
1. Охарактеризуйте кислотно-основну природу гідроген пероксиду. Наведіть приклади.
2. Які методи застосовують для одержання s-елементів ІІ групи? Напишіть рівняння реакцій, укажіть умови.
3. З якими простими речовинами реагує бор? Напишіть рівняння відповідних реакцій.
4. Чим пояснити велику комплексоутворюючу здатність СО? Що таке карбоніли металів, яка природа хімічного зв’язку у цих сполуках?
5. Як можна одержати гідразин? Чи полярна його молекула?
6. Чому розчини SbCl3 та Bi(NO3)3 мутніють при розведенні їх водою? Як можна зробити їх знову прозорими, не виділяючи осад?
7. Наведіть приклади солетворних оксидів з різними хімічними властивостями. Напишіть рівняння реакцій, що характеризують хімічний характер наведених оксидів.
8. Які сполуки сульфуру з хлором існують? Як вони відносяться до води? Напишіть рівняння реакцій.
9. Напишіть рівняння реакцій:
а) NaBr + H2SO4к ; б) HF + SiO2 →
10. Напишіть рівняння реакцій:
а) ClO2 + KOH б) HClO + H2S
11. Чому вироби із срібла з часом чорніють? Написати рівняння реакцій, що відбуваються зі сріблом на повітрі.
12. Закінчити рівняння реакцій:
Mn(CN)2 + KCN → MnSO4 + KMnO4 + КОH →
MnO2 + KClO3 + KOH →
13. Як розчиняється кобальт у кислотах? Які сполуки при цьому утворюються? Як отримати Co(OH)2 та Co(OH)3? Яка сполука утворюється при нагріванні Со(ОН)3? Навести рівняння реакцій.
Варіант № 4
1. Деякі метали можуть реагувати з водою. Який гідроксид утворюється при взаємодії металічного натрію з водою?
A. TlOH
B. NaOH
C. LiOH
D. Cr(OH)3
E. Cu(OH)2
2. При взаємодії хлору з водою утворюється:
A. HClO + HClO3
B. HClO + HClO4
C. HClO + HClO3
D. HClO + HCl
E. HClO + Cl2O7
3. Склад питної соди виражається формулою:
A. Na2CO3
B. Na2CO3 · 10H2O
C. NaHCO3
D. K2CO3
E. CaCO3
4. Яка з наступних речовин при дисоціації утворює іони Н+ і ОН- одночасно?
A. H2O
B. Ca(OH)2
C. NaOH
D. H3PO4
E. Sr(OH)2
5. Метал, що поширений у природі в самородному стані:
A. Кальцій
B. Натрій
C. Золото
D. Алюміній
E. Хром
6. Яка з наведених взаємодій можлива за кімнатної температури?
A. Fe + H2SO4 (конц.) =
B. Na + H2O =
C. Au + HCl =
D. Сr2O3 + H2 =
E. Cu + H2O =
7. Одна з класифікацій хімічних елементів ґрунтується на будові їх електронних оболонок. Згідно неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать до s-елементів?
A. P, S, Cr
B. Be, Mg, Al
C. S, P, Cl
D. Mn, Br, Mo
E. K, Ca, Sr
8. Вкажіть, яка з наведених солей не підлягає гідролізу:
A. CrCrCl3
B. KNO2
C. ZnSO4
D. Al2(SO4)3
E. KI
9. Одна з класифікацій хімічних елементів ґрунтується на будові їх електронних оболонок. Згідно неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать до р-елементів?
A. K, Ca, Sc
B. Mn, Br, Mo
C. S, P, Cl
D. Be, Mg, Al
E. P, S, Cr
10. Які з вказаних пар речовин можна використовувати для одержання нітроген (ІІ)оксиду?
A. HNO3, NaOH
B. NH3, O2
C. Cu, HNO3 [конц.]
D. N2O3, NaOH
E. NO, O2
|
11. Арґентум нітрат застосовують в офтальмології як бактерицидний, протизапальний засіб. AgNO3 можна одержати в результаті взаємодії між такими двома речовинами:
A. AgCl + NaNO3
B. Ag + KNO3
C. AgСl + NH4NO3
D. Ag2O + KNO3
E. Ag + НNO3
12. Нітроген (І) оксид (N2O) використовується для інгаляційного наркозу. Його одержують при нагріванні:
A. NH3
B. NH3·H2O
C. NH4NO3
D. Cu(NO3)2
E. NaNO3
13. Який з наведених металів не реагує з хлоридною кислотою?
A. Al
B. Ag
C. Zn
D. Ca
E. Fe
14. Вкажіть молекулярну формулу оксиду, якому відповідає перманганатна кислота
A. Mn3O4
B. MnO2
C. Mn2O7
D. Mn2O3
E. MnO
15. Яка молекулярна маса невідомого газу, якщо його густина за воднем дорівнює 15?
A. 30 г/моль
B. 7,5 г/моль
C. 15 г/моль
D. 45 г/моль
E. 60 г/моль
16. З хлоридною кислотою не взаємодіють наступні метали:
A. Zn, Mg
B. Cu, Ag
C. Fe, Co
D. Na, Ca
E. Mg, Cr
17. Яка із сполук характеризується найнижчим ступенем окиснення Нітрогену?
A. NO2
B. HNO3
C. HNO2
D. N2O5
E. NH3
18. Яку хімічну формулу і забарвлення має продукт відновлення перманганату калію в нейтральному середовищі?
A. MnO2, коричневий
B. MnO2, зелений
C. K2MnO4, зелений
D. K2MnO4, фіолетовий
E. MnSO4, безбарвний
19. Одним з показників якості води є її твердість. Яка з наведених солей може зумовлювати постійну твердість води?
A. Mg(HCO3)2
B. СаSO4
C. Ca(HCO3)2
D. K2SO4
E. NaCl
20. З якою з вказаних речовин взаємодіє концентрована сульфатна кислота з утворенням сульфур (IV) оксиду?
A. NaCl
B. MgO
C. Ca
D. Ag
E. CuO
|
Письмова робота
1. Яка молярна концентрація NaOH у розчині з масовою часткою NaOH 40% та густиною розчину 1,43г/см3?
2. Порівняйте розчинність у воді сульфатів, оксалатів, хроматів лужноземельних металів. У чому їх можна розчинити? Напишіть рівняння відповідних реакцій.
3. Напишіть рівняння реакцій:
а) B+HNO3конц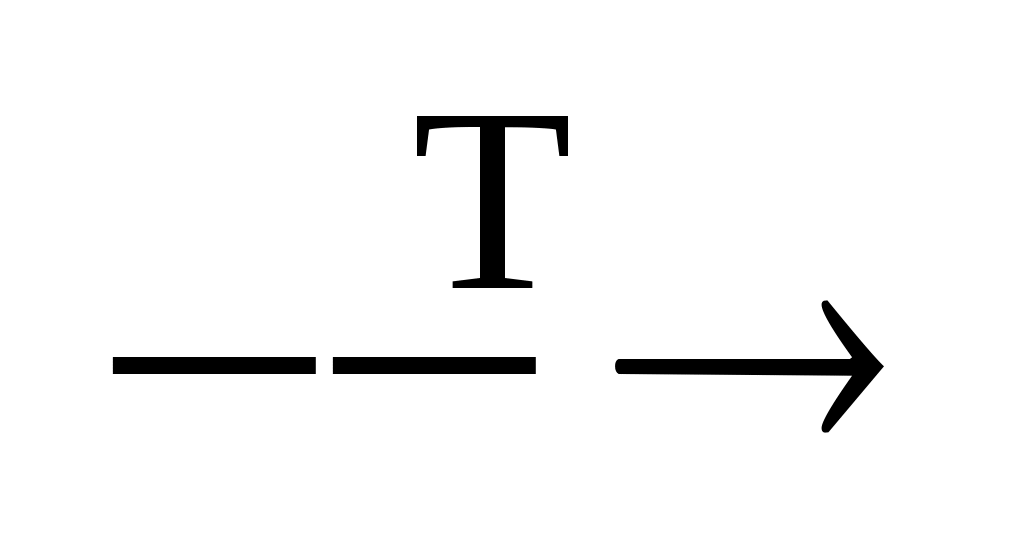
б)Na2B4O7+H2SO4+H2O
в) Na2B4O7+HNO3+H2O
г) B2H6+H2O
д) CaO+B2O3
е) Al+NaOH+H2O
є) AlCl3+NaOHнадл.
ж) Tl+H2O
з) Tl+HNO3конц
4. Який об’єм СО2 (н.у.) можна одержати термічним розкладом 12 кг вапняку, що має 5% домішок, якщо ступінь розкладу складає 96%?
5. Напишіть рівняння таких реакцій:
а) NH3 + O2 б) NH3 + NaClO
в) N2H4 + O2 г) KNO2 + KJ + Н2SO4
д) KNO2 + KMnO4 + H2SO4 е) NH3 + Cl2
ж) HNO3конц + S
6. Як можна одержати озон? Які особливості протікання окисно-відновних реакцій за участю озону? Наведіть приклади.
7. Напишіть рівняння реакцій:
-
а) ZnS + HCl
б) Na2S + S
в) H2S + I2
г) H2S + KMnO4 + H2SO4
|
д) Na2S2 + HCl
е) H2SO3 + H2S
к) H2SO3 + I2 + H2O
ж) H2SO3 + H2O2
|
8. Напишіть рівняння реакцій одержання галогеноводневих кислот.
9. Що таке ”жавелева вода”, хлорне вапно, як їх одержують?
10. Чому купрум (ІІ) хлорид розчиняється у водному розчині аміаку, а у водному розчині натрій гідроксиду не розчиняється? Написати рівняння реакцій утворення і дисоціації комплексної сполуки.
11. Як хімічно розділити суміш цинку та кадмію? Написати рівняння відповідних реакцій.
12. Визначити процентний вміст натрій дихромату в технічному продукті, якщо для відновлення 1кг останнього потрібно 3,38кг КІ.
13. Що трапиться, якщо до розчину ферум (ІІІ) сульфату додати натрій карбонат? Навести рівняння реакції та дати пояснення.
Варіант № 5
1. Вкажіть, яка з наведених солей не підлягає гідролізу:
A. KNO2
B. CrCrCl3
C. Al2(SO4)3
D. KI
E. ZnSO4
2. Яка з наступних речовин при дисоціації утворює іони Н+ і ОН- одночасно?
A. Sr(OH)2
B. NaOH
C. Ca(OH)2
D. H3PO4
E. H2O
3. Деякі метали можуть реагувати з водою. Який гідроксид утворюється при взаємодії металічного натрію з водою?
A. Cu(OH)2
B. TlOH
C. NaOH
D. LiOH
E. Cr(OH)3
4. Яка з наведених взаємодій можлива за кімнатної температури?
A. Fe + H2SO4 (конц.) =
B. Na + H2O =
C. Au + HCl =
D. Сr2O3 + H2 =
E. Cu + H2O =
5. Калій перманганат KMnO4 використовують у медичній практиці як бактерицидний засіб. Вкажіть, які хімічні властивості KMnO4 обумовлюють його бактерицидність.
A. Кислотні.
B. Відновні.
C. Окисні.
D. Основні.
E. Амфотерні
6. Сульфур – типовий неметал, який знаходиться у VI групі головної підгрупі Періодичної системи. Яка валентність сульфуру у молекулі сульфітної кислоти?
A. III
B. II
C. IV
D. VI
E. V
7. З хлоридною кислотою не взаємодіють наступні метали:
A. Mg, Cr
B. Zn, Mg
C. Cu, Ag
D. Fe, Co
E. Na, Ca
8. Нітроген (І) оксид (N2O) використовується для інгаляційного наркозу. Його одержують при нагріванні:
A. Cu(NO3)2
B. NaNO3
C. NH3·H2O
D. NH4NO3
E. NH3
9. В якій із сполук Оксиген виявляє позитивний ступінь окиснення?
A. KO3
B. H2O2
C. CO2
D. KO2
E. OF2
10. Максимальна ступінь окислення елемента, як правило, дорівнює
A. номеру періоду
B. числу нейтронів
C. числу протонів
D. номеру групи в періодичній системі
E. порядковому номеру в періодичній системі
|
11. Оксиди елементів VA групи, які використовують у фармації:
A. NO, NO2
B. NO, P2O5
C. As2O3, P2O5
D. NO2, As2O5
E. N2O, As2O3
12. У ряду НF – HCI – HBr – HI
A. збільшується стійкість молекули, сила кислот спадає
B. зменшується стійкість молекули, сила кислот зростає
C. зменшується стійкість молекули, сила кислот спадає
D. сила кислот однакова
E. зростає стійкість молекули, сила кислот зростає
13. Який галоген у вигляді простої речовини за кімнатних умов є рідиною:
A. Азот
B. Сірка
C. Фосфор
D. Водень
E. Бром
14. При взаємодії хлору з водою утворюється:
A. HClO + HClO4
B. HClO + HClO3
C. HClO + Cl2O7
D. HClO + HClO3
E. HClO + HCl
15. Вкажіть молекулярну формулу оксиду, якому відповідає перманганатна кислота
A. Mn2O7
B. Mn3O4
C. Mn2O3
D. MnO2
E. MnO
16. Максимальний ступінь окиснення елемента, як правило, дорівнює
A. різниці між позитивним ступенем окиснення та числом 8
B. номеру періоду
C. номеру підгрупи в періодичній системі
D. номеру ряду
E. номеру групи в періодичній системі
17. Ферум у сполуках може знаходитись у різних ступенях окиснення. Який найвищий ступінь окиснення феруму у сполуках:
A. +4
B. +6
C. +3
D. +2
E. +8
18. Який з наведених металів не реагує з хлоридною кислотою?
A. Al
B. Ag
C. Zn
D. Ca
E. Fe
19. Вкажіть сполуку хрому, яка проявляє амфотерні властивості:
A. Cr2O3
B. CrO
C. Cr(OH)2
D. CrO3
E. K2CrO4
20. Склад питної соди виражається формулою:
A. Na2CO3 · 10H2O
B. NaHCO3
C. K2CO3
D. CaCO3
E. Na2CO3
|
Письмова робота
1. Як одержати оксиди лужних металів? Напишіть рівняння реакцій.
2. Відношення берилію та магнію до води, кислот і лугів. Напишіть рівняння відповідних реакцій. Зіставте взаємодію лужноземельних металів з цими реагентами.
3. Напишіть рівняння гідролізу BF3 та BCl3.
4. Напишіть рівняння реакцій:
а) СО + Cl2;
б) CO + Fe2O3;
в) C + N2;
г) C2N2 + KOH;
д) KCN + S;
е) CaC2 + H2O;
ж) CaCO3 + С;
з) Al4C3 + H2O.
5. Чи подібні за хімічними властивостями аміак та гідразин? Наведіть приклади.
6. Суміш As2S3, Sb2S3, Bi2S3 обробили надлишком розчину (NH4)2S? Що залишиться у осаді, що перейде у розчин?
7. Які ступені окиснення проявляють елементи підгрупи сульфуру в сполуках?
8. Як одержати хлористий тіоніл та хлористий сульфурил? Як вони відносяться до води?
9. Напишіть рівняння реакцій:
а) NaI + H2SO4к
б) MnO2 + HCl
10. Напишіть рівняння реакцій:
а) CaOCl2 + CO2 + H2O
б) KClO4 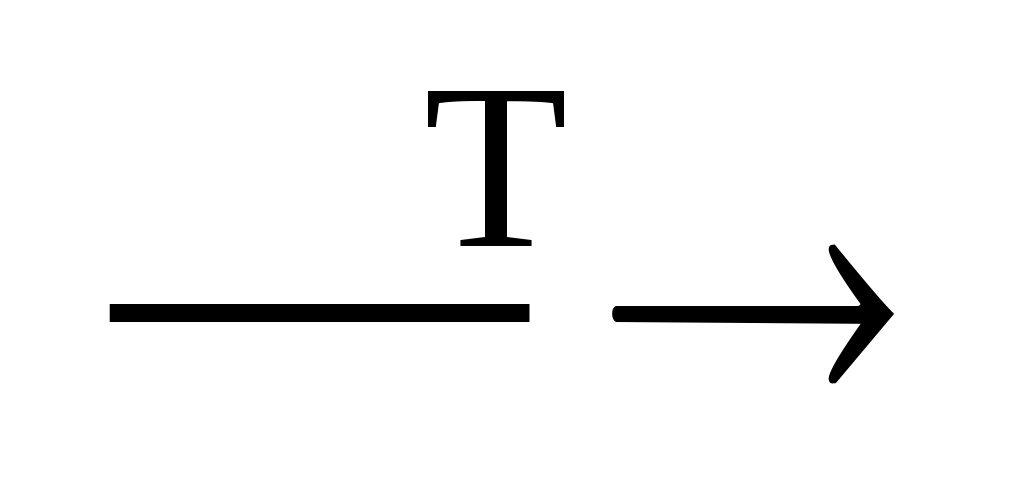
11. Написати рівняння реакцій:
а) H[AuCl4] + FeSO4 + H2SO4 → б) AgCl + Na2S2O3 →
в) AuCl3 + H2O → г) CuI + КСNнадл →
12. Яка сполука мангану широко використовується у медицині та лабораторіях? Завдяки яким властивостям? Як поводить себе ця сполука реагуючи з Na2SO3 у середовищах з різним значенням рН? Написати рівняння відповідних реакцій.
13. Закінчити рівняння реакцій:
K4[Fe(CN)6] + Cl2 →
Fe(OH)2 + O2 + H2O →
Варіант № 6
1. Метал, що поширений у природі в самородному стані:
A. Хром
B. Алюміній
C. Кальцій
D. Натрій
E. Золото
2. Деякі метали можуть реагувати з водою. Який гідроксид утворюється при взаємодії металічного натрію з водою?
A. NaOH
B. Cu(OH)2
C. LiOH
D. TlOH
E. Cr(OH)3
3. Один із способів класифікації хімічних елементів ґрунтується на врахування будови валентних електронних оболонок їх атомів (s-, p-, d- та f- елементи). Вкажіть який з елементів належіть до p -елементів:
A. Fe
B. K
C. Mg
D. Р
E. Сu
4. Максимальна ступінь окислення елемента, як правило, дорівнює
A. числу протонів
B. номеру групи в періодичній системі
C. номеру періоду
D. числу нейтронів
E. порядковому номеру в періодичній системі
5. Який галоген у вигляді простої речовини за кімнатних умов є рідиною:
A. Азот
B. Сірка
C. Фосфор
D. Водень
E. Бром
6. Вкажіть молекулярну формулу оксиду, якому відповідає перманганатна кислота
A. MnO
B. Mn2O3
C. Mn3O4
D. MnO2
E. Mn2O7
7. Яка з галогеновмісних кислот міститься в організмі людини?
A. HCl
B. HClO
C. HClO4
D. HBrO
E. HI
8. Який з наведених металів за кімнатної температури не реагує з концентрованою нітратною кислотою?
A. Ba
B. Na
C. Al
D. Zn
E. Ca
9. Яка із сполук характеризується найнижчим ступенем окиснення Нітрогену?
A. HNO2
B. N2O5
C. NH3
D. HNO3
E. NO2
10. З якою з вказаних речовин взаємодіє концентрована сульфатна кислота з утворенням сульфур (IV) оксиду?
A. Ca
B. Ag
C. NaCl
D. MgO
E. CuO
11. При пропусканні хлору через холодний розчин калій гідроксиду утворюються:
A. KCl, H2O
B. KClO3, H2O
C. KClO3, KClO, H2O
D. KCl, KClO, H2O
E. KCl, KClO2, H2O
|
12. В якій із сполук Оксиген виявляє позитивний ступінь окиснення?
A. CO2
B. KO2
C. OF2
D. H2O2
E. KO3
13. Формулою хлорного вапна, що використовується як дезінфікуючий засіб, є:
A. NaOCl
B. CaCO3
C. СaCl2
D. MgCO3
E. CaOCl2
14. Арґентум нітрат застосовують в офтальмології як бактерицидний, протизапальний засіб. AgNO3 можна одержати в результаті взаємодії між такими двома речовинами:
A. AgCl + NaNO3
B. Ag + KNO3
C. AgСl + NH4NO3
D. Ag2O + KNO3
E. Ag + НNO3
15. Яка з наступних речовин при дисоціації утворює іони Н+ і ОН- одночасно?
A. Sr(OH)2
B. NaOH
C. Ca(OH)2
D. H3PO4
E. H2O
16. Яка сполука Гідрогену з елементами VA групи періодичної системи є найбільш стійкою?
A. BiH3
B. AsH3
C. PH3
D. SbH3
E. NH3
17. При взаємодії заліза з хлором утворюється:
A. Ферум (ІІІ) хлорит
B. Ферум хлорат
C. Ферум (ІІ) хлорат
D. Ферум гіпохлорит.
E. Ферум (ІІІ) хлорид
18. Які з вказаних пар речовин можна використовувати для одержання нітроген (ІІ)оксиду?
A. HNO3, NaOH
B. NH3, O2
C. Cu, HNO3 [конц.]
D. N2O3, NaOH
E. NO, O2
19. Вкажіть, яка з наведених солей не підлягає гідролізу:
A. Al2(SO4)3
B. KI
C. KNO2
D. CrCrCl3
E. ZnSO4
20. Склад питної соди виражається формулою:
A. K2CO3
B. CaCO3
C. Na2CO3 · 10H2O
D. NaHCO3
E. Na2CO3
|
|
 Скачать 342.5 Kb.
Скачать 342.5 Kb.