Письмова робота
1. Які речовини утворюються при пропусканні через розчин гідроксиду натрію: H2S, Cl2, CO2, SO2? Напишіть рівняння можливих реакцій.
2. Напишіть рівняння реакцій:
а) CaH2 + O2 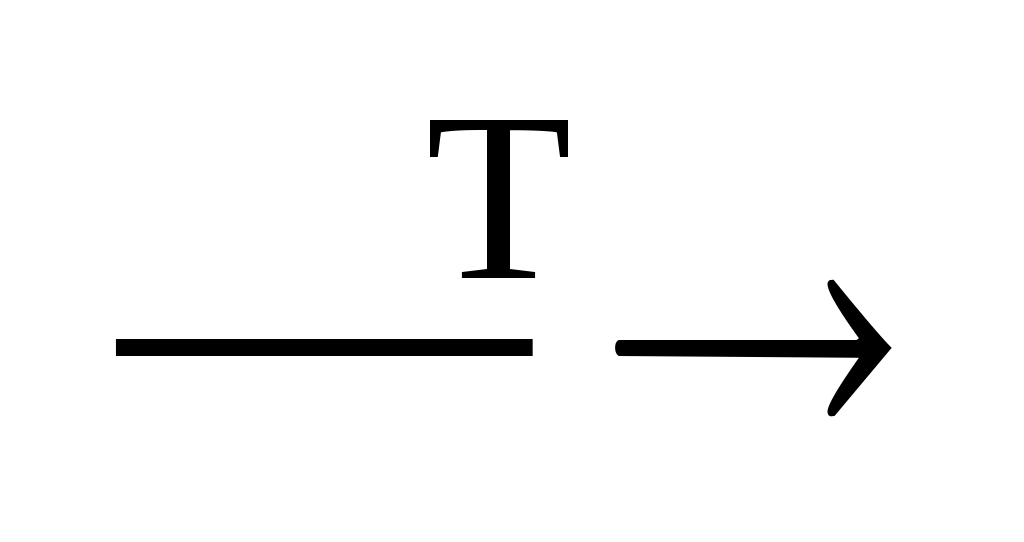
б) CaO + C
в) Be(OH)2 + CH3COOH
г) Be(OH)2 + NaOH
д) BaSO4 + C 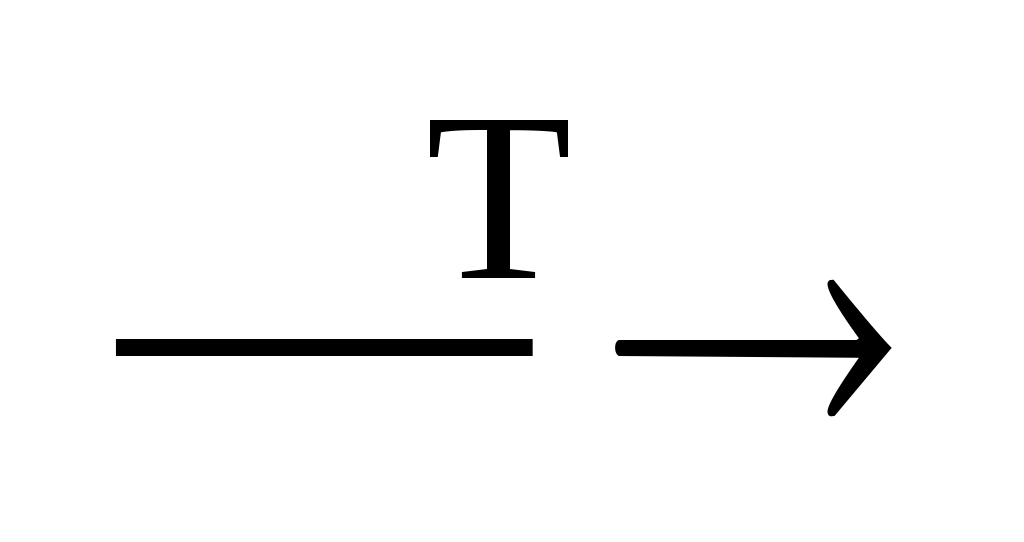
3. Яку масу ортоборної кислоти можна одержати при окисленні бору 1 л розчину нітратної кислоти з масовою часткою HNO3 65,3%, густина розчину 1,4г/см3?
4. Опишіть будову молекули аміаку. Вкажіть її полярність. Чи може аміак бути донором, акцептором електронів, брати участь в утворенні водневого зв’язку?
5. Напишіть рівняння реакцій , в яких утворюються N2O, NO, NO2.
6. Цинкову пластинку масою 19,5г занурили у розчин солі бісмуту. Через деякий час її маса збільшилась до 26,6г. Яка маса бісмуту виділилась на пластинці?
7. При добуванні сульфатної кислоти сірчаний ангідрид поглинають концентрованою сульфатною кислотою. Що при цьому утворюється? Наведіть склад продукту.
8. Як змінюється відновна здатність у ряду НF – НІ? Наведіть приклади.
9. Як змінюється сила та окисні властивості кислот у ряду HClO3 ‑ HBrO3 ‑ ‑ HIO3?
10. Написати рівняння реакцій взаємодії купруму з концентрованою сульфатною кислотою, з розбавленою нітратною кислотою; аргентуму з розбавленою нітратною кислотою.
11. Як одержати гідроксид цинку(ІІ)? Які його хімічні властивості? Чому він розчиняється в розчинах сильних кислот, лугів і аміаку? Відповідь підтвердити рівняннями реакцій.
12. Скільки мілілітрів розчину гідроксиду калію з с(КОН) 8моль/л потрібно гідроксиду хрому(ІІІ) для розчинення 78г гідроксиду хрому(ІІІ), якщо при цьому утворюється комплексна сполука, координаційне число 6?
13. Яка реакція відбувається, якщо через розчин хлориду феруму(ІІІ) пропускати сірководень? Навести рівняння реакції.
Варіант № 13
1. Формулою хлорного вапна, що використовується як дезінфікуючий засіб, є:
A. NaOCl
B. CaCO3
C. СaCl2
D. MgCO3
E. CaOCl2
2. Сульфур – типовий неметал, який знаходиться у VI групі головної підгрупі Періодичної системи. Яка валентність сульфуру у молекулі сульфітної кислоти?
A. V
B. VI
C. III
D. II
E. IV
3. Який з наведених металів за кімнатної температури не реагує з концентрованою нітратною кислотою?
A. Al
B. Ba
C. Zn
D. Na
E. Ca
4. Яка сполука Гідрогену з елементами VA групи періодичної системи є найбільш стійкою?
A. NH3
B. PH3
C. AsH3
D. SbH3
E. BiH3
5. Склад питної соди виражається формулою:
A. Na2CO3 · 10H2O
B. NaHCO3
C. K2CO3
D. CaCO3
E. Na2CO3
6. Яку хімічну формулу і забарвлення має продукт відновлення перманганату калію в нейтральному середовищі?
A. K2MnO4, фіолетовий
B. MnO2, коричневий
C. K2MnO4, зелений
D. MnSO4, безбарвний
E. MnO2, зелений
7. З розведеним розчином сульфатної кислоти не реагує:
A. Ag
B. Fe
C. Zn
D. Ca
E. Mg
8. З якою з вказаних речовин взаємодіє концентрована сульфатна кислота з утворенням сульфур (IV) оксиду?
A. Ca
B. Ag
C. NaCl
D. MgO
E. CuO
9. В якій із сполук Оксиген виявляє позитивний ступінь окиснення?
A. CO2
B. KO2
C. OF2
D. H2O2
E. KO3
10. Вкажіть сполуку хрому, яка проявляє амфотерні властивості:
A. CrO3
B. Cr2O3
C. Cr(OH)2
D. K2CrO4
E. CrO
|
11. Одна з класифікацій хімічних елементів ґрунтується на будові їх електронних оболонок. Згідно неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать до р-елементів?
A. Mn, Br, Mo
B. S, P, Cl
C. Be, Mg, Al
D. P, S, Cr
E. K, Ca, Sc
12. Оксиди елементів VA групи, які використовують у фармації:
A. NO, P2O5
B. NO, NO2
C. NO2, As2O5
D. N2O, As2O3
E. As2O3, P2O5
13. Калій перманганат KMnO4 використовують у медичній практиці як бактерицидний засіб. Вкажіть, які хімічні властивості KMnO4 обумовлюють його бактерицидність.
A. Амфотерні
B. Основні.
C. Кислотні.
D. Відновні.
E. Окисні.
14. Яка з наступних речовин при дисоціації утворює іони Н+ і ОН- одночасно?
A. Ca(OH)2
B. H3PO4
C. H2O
D. NaOH
E. Sr(OH)2
15. Одним з показників якості води є її твердість. Яка з наведених солей може зумовлювати постійну твердість води?
A. K2SO4
B. Ca(HCO3)2
C. NaCl
D. Mg(HCO3)2
E. СаSO4
16. Які з вказаних пар речовин можна використовувати для одержання нітроген (ІІ)оксиду?
A. N2O3, NaOH
B. Cu, HNO3 [конц.]
C. NO, O2
D. HNO3, NaOH
E. NH3, O2
17. Максимальна ступінь окислення елемента, як правило, дорівнює
A. номеру періоду
B. числу нейтронів
C. числу протонів
D. номеру групи в періодичній системі
E. порядковому номеру в періодичній системі
18. Максимальний ступінь окиснення елемента, як правило, дорівнює
A. номеру ряду
B. номеру групи в періодичній системі
C. номеру періоду
D. різниці між позитивним ступенем окиснення та числом 8
E. номеру підгрупи в періодичній системі
19. При порівнянні оксигеновмісних кислот Хлору за силою і окисними властивостями можна зробити висновок - зі збільшенням ступеня окиснення Хлору:
A. окисна здатність та сила кислот збільшується
B. окисна здатність та сила кислот не змінюється
C. окисна здатність збільшується, сила кислот зменшується
D. окисна здатність зменшується, сила кислот збільшується
E. окисна здатність та сила кислот зменшується
20. Яка з галогеновмісних кислот міститься в організмі людини?
A. HClO
B. HBrO
C. HCl
D. HClO4
E. HI
|
Письмова робота
1. Що спільного та відмінного є в будові та властивостях води та пероксиду гідрогену?
2. Чи можна одержати гідроксиди s-елементів ІІ А групи:
а) реакцією металу з водою;
б) реакцією оксиду металу з водою;
в) реакціями обміну у розчині за участю гідроксиду натрію чи аміаку?
Якщо так, то які? Відповідь мотивуйте.
3. Чому алюміній, незважаючи на велику хімічну активність, стійкий на повітрі?
4. Напишіть рівняння реакцій силіцію, германію, стануму і плюмбуму з розчинами лугів.
5. Які хімічні властивості аміаку? Чи бере він участь в окисно-відновних реакціях, в процесах комплексоутворення? Навести приклади.
6. Як реагує Ортофосфатна кислота з металами? Наведіть приклади.
7. Напишіть рівняння реакцій утворення сірководню.
8. Як із оксидів селену(IV) та телуру(IV) можна одержати кислоти складу Н2ЕО3? Напишіть рівняння реакцій.
9. Йод практично не розчиняється у воді, але розчиняється у розчині йодиду калію. Чому?
10. Як одержати Cl2O7?
11. Чому аміачні розчини хлориду купруму(І) на повітрі швидко забарвлюються? Написати рівняння реакцій, дати пояснення.
12. Яка сполука мангану називається манганатом? Написати рівняння реакцій утворення манганату калію:
MnO2 + O2 + KOH →
MnO2 + KNO3 + KOH →
MnO2 + KClO3 + KOH →
13. Яка сполука мангану називається манганатом? Написати рівняння реакцій утворення манганату калію:
MnO2 + O2 + KOH →
MnO2 + KNO3 + KOH →
MnO2 + KClO3 + KOH →
14. Які сполуки утворюються при взаємодії галогенідів платини(ІV) з галогенідами лужних металів? Як дисоціюють ці сполуки? Як змінюється заряд комплексного іону, якщо платина (ІV) координує аміак?
Варіант № 14
1. Які з вказаних пар речовин можна використовувати для одержання нітроген (ІІ)оксиду?
A. NH3, O2
B. NO, O2
C. Cu, HNO3 [конц.]
D. HNO3, NaOH
E. N2O3, NaOH
2. При взаємодії хлору з водою утворюється:
A. HClO + HClO3
B. HClO + HCl
C. HClO + HClO3
D. HClO + HClO4
E. HClO + Cl2O7
3. Оксиди елементів VA групи, які використовують у фармації:
A. As2O3, P2O5
B. NO2, As2O5
C. N2O, As2O3
D. NO, P2O5
E. NO, NO2
4. Метал, що поширений у природі в самородному стані:
A. Кальцій
B. Натрій
C. Золото
D. Алюміній
E. Хром
5. У ряду НF – HCI – HBr – HI
A. збільшується стійкість молекули, сила кислот спадає
B. зменшується стійкість молекули, сила кислот зростає
C. зменшується стійкість молекули, сила кислот спадає
D. сила кислот однакова
E. зростає стійкість молекули, сила кислот зростає
6. Яка з галогеновмісних кислот міститься в організмі людини?
A. HClO4
B. HI
C. HBrO
D. HCl
E. HClO
7. Калій перманганат KMnO4 використовують у медичній практиці як бактерицидний засіб. Вкажіть, які хімічні властивості KMnO4 обумовлюють його бактерицидність.
A. Відновні.
B. Окисні.
C. Основні.
D. Амфотерні
E. Кислотні.
8. Один із способів класифікації хімічних елементів ґрунтується на врахування будови валентних електронних оболонок їх атомів (s-, p-, d- та f- елементи). Вкажіть який з елементів належіть до p -елементів:
A. Mg
B. Р
C. Fe
D. K
E. Сu
9. Яка із сполук характеризується найнижчим ступенем окиснення Нітрогену?
A. NO2
B. HNO3
C. HNO2
D. N2O5
E. NH3
10. В якій із сполук Оксиген виявляє позитивний ступінь окиснення?
A. CO2
B. KO2
C. OF2
D. H2O2
E. KO3
|
11. Формулою хлорного вапна, що використовується як дезінфікуючий засіб, є:
A. CaOCl2
B. СaCl2
C. CaCO3
D. MgCO3
E. NaOCl
12. В якій з наведених сполук ступінь окиснення Нітрогену дорівнює –2?
A. NO
B. NO2
C. N2O
D. N2H4
E. NH3
13. При пропусканні хлору через холодний розчин калій гідроксиду утворюються:
A. KCl, KClO, H2O
B. KCl, KClO2, H2O
C. KCl, H2O
D. KClO3, KClO, H2O
E. KClO3, H2O
14. Максимальна ступінь окислення елемента, як правило, дорівнює
A. порядковому номеру в періодичній системі
B. числу протонів
C. номеру групи в періодичній системі
D. номеру періоду
E. числу нейтронів
15. Одним з показників якості води є її твердість. Яка з наведених солей може зумовлювати постійну твердість води?
A. Mg(HCO3)2
B. СаSO4
C. Ca(HCO3)2
D. K2SO4
E. NaCl
16. Вкажіть сполуку хрому, яка проявляє амфотерні властивості:
A. Cr(OH)2
B. K2CrO4
C. CrO3
D. Cr2O3
E. CrO
17. Яка молекулярна маса невідомого газу, якщо його густина за воднем дорівнює 15?
A. 60 г/моль
B. 15 г/моль
C. 7,5 г/моль
D. 45 г/моль
E. 30 г/моль
18. Яка з наведених взаємодій можлива за кімнатної температури?
A. Au + HCl =
B. Сr2O3 + H2 =
C. Fe + H2SO4 (конц.) =
D. Na + H2O =
E. Cu + H2O =
19. Оксид нітрогену (I), відомий під назвою „звеселяючий газ”, у суміші з киснем використовують у медицині для наркозу. Вкажіть формулу цього оксиду.
A. N2O
B. NO
C. NO2
D. N2O3
E. N2O4
20. З розведеним розчином сульфатної кислоти не реагує:
A. Ca
B. Ag
C. Zn
D. Mg
E. Fe
|
Письмова робота
1. Які з наведених солей натрію гідролізують: Na2CO3, Na3PO4, NaNO3? Напишіть іонні рівняння гідролізу.
2. Охарактеризуйте здатність елементів ІІ А групи до комплексоутворення, наведіть приклади комплексних сполук цих елементів.
3. Напишіть електронні формули атомів C, Si, Ge, Sn, Pb. Які ступені окиснення характерні для цих елементів? Як змінюється стійкість сполук з різними ступенями окиснення в ряду C – Pb та чому?
4. Напишіть рівняння реакцій:
а) PbO2 + CaO;
б) SnCl2 + HgCl2;
в) SnCl2 + FeCl3;
г) SnCl2 + H2O2 + HCl;
д) PbO2 + HCl.
5. Як реагує NO2 з водою, лугами?
6. Яку масу розчину з масовою часткою ортофосфорної кислоти 40% можна добути з 10кг Са3(РО4)2?
7. Як реагує сульфатна кислота з металами ? Наведіть приклади.
8. Напишіть рівняння реакцій:
а) KMnO4 + KI +H2SO4 ; б) PCl3 + H2O →
9. Чому алюміній і силіцій утворюють з фторид-іонами [AlF6]3-та [SiF6]2-, а бор та берилій – [BF4]- та [BeF4]2-?
10. Написати реакції термічного розкладу нітрату купруму(ІІ) та нітрату аргентуму.
11. Коротко охарактеризувати елементи підгрупи цинку, вказавши електронну конфігурацію їх атомів, характерні ступені окиснення у сполуках, окисно-відновні властивості елементів у характерних ступенях окиснення, кислотно-основні характеристики оксидів та гідроксидів (на прикладах реакцій).
12. На відновлення 300мл розчину дихромату калію, с(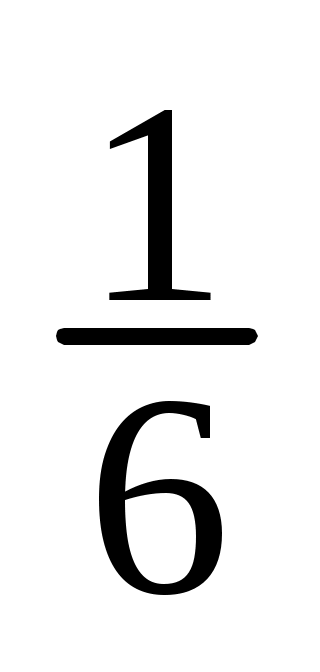 K2Cr2O7) 0,2моль/л у кислому середовищі витрачено 500мг розчину хлориду стануму(ІІ). Визначити масову та молярну концентрацію розчину хлориду стануму(ІІ). Навести рівняння реакції, яка відбувається. K2Cr2O7) 0,2моль/л у кислому середовищі витрачено 500мг розчину хлориду стануму(ІІ). Визначити масову та молярну концентрацію розчину хлориду стануму(ІІ). Навести рівняння реакції, яка відбувається.
13. Написати рівняння взаємодії феруму з соляною та концентрованою нітратною кислотами.
Варіант № 15
1. Одна з класифікацій хімічних елементів ґрунтується на будові їх електронних оболонок. Згідно неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать до s-елементів?
A. Be, Mg, Al
B. P, S, Cr
C. Mn, Br, Mo
D. K, Ca, Sr
E. S, P, Cl
2. Нітроген (І) оксид (N2O) використовується для інгаляційного наркозу. Його одержують при нагріванні:
A. Cu(NO3)2
B. NaNO3
C. NH3·H2O
D. NH4NO3
E. NH3
3. Яка з наведених взаємодій можлива за кімнатної температури?
A. Na + H2O =
B. Cu + H2O =
C. Au + HCl =
D. Fe + H2SO4 (конц.) =
E. Сr2O3 + H2 =
4. Деякі метали можуть реагувати з водою. Який гідроксид утворюється при взаємодії металічного натрію з водою?
A. NaOH
B. Cu(OH)2
C. LiOH
D. TlOH
E. Cr(OH)3
5. При взаємодії заліза з хлором утворюється:
A. Ферум хлорат
B. Ферум (ІІІ) хлорит
C. Ферум гіпохлорит.
D. Ферум (ІІІ) хлорид
E. Ферум (ІІ) хлорат
6. При пропусканні хлору через холодний розчин калій гідроксиду утворюються:
A. KCl, KClO2, H2O
B. KClO3, KClO, H2O
C. KCl, KClO, H2O
D. KCl, H2O
E. KClO3, H2O
7. При порівнянні оксигеновмісних кислот Хлору за силою і окисними властивостями можна зробити висновок - зі збільшенням ступеня окиснення Хлору:
A. окисна здатність зменшується, сила кислот збільшується
B. окисна здатність та сила кислот зменшується
C. окисна здатність та сила кислот збільшується
D. окисна здатність збільшується, сила кислот зменшується
E. окисна здатність та сила кислот не змінюється
8. Який з наведених металів за кімнатної температури не реагує з концентрованою нітратною кислотою?
A. Al
B. Ba
C. Zn
D. Na
E. Ca
9. Одна з класифікацій хімічних елементів ґрунтується на будові їх електронних оболонок. Згідно неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать до р-елементів?
A. S, P, Cl
B. K, Ca, Sc
C. Be, Mg, Al
D. Mn, Br, Mo
E. P, S, Cr
10. Формулою хлорного вапна, що використовується як дезінфікуючий засіб, є:
A. CaCO3
B. NaOCl
C. MgCO3
D. CaOCl2
E. СaCl2
|
11. Який галоген у вигляді простої речовини за кімнатних умов є рідиною:
A. Азот
B. Сірка
C. Фосфор
D. Водень
E. Бром
12. Яку хімічну формулу і забарвлення має продукт відновлення перманганату калію в нейтральному середовищі?
A. K2MnO4, зелений
B. MnSO4, безбарвний
C. K2MnO4, фіолетовий
D. MnO2, коричневий
E. MnO2, зелений
13. В якій з наведених сполук ступінь окиснення Нітрогену дорівнює –2?
A. N2O
B. N2H4
C. NO
D. NO2
E. NH3
14. Одним з показників якості води є її твердість. Яка з наведених солей може зумовлювати постійну твердість води?
A. NaCl
B. Mg(HCO3)2
C. СаSO4
D. Ca(HCO3)2
E. K2SO4
15. Оксид нітрогену (I), відомий під назвою „звеселяючий газ”, у суміші з киснем використовують у медицині для наркозу. Вкажіть формулу цього оксиду.
A. N2O3
B. N2O
C. NO2
D. N2O4
E. NO
16. Яка з наступних речовин при дисоціації утворює іони Н+ і ОН- одночасно?
A. H2O
B. Ca(OH)2
C. NaOH
D. H3PO4
E. Sr(OH)2
17. Який з наведених металів не реагує з хлоридною кислотою?
A. Ca
B. Zn
C. Fe
D. Al
E. Ag
18. Максимальна ступінь окислення елемента, як правило, дорівнює
A. числу протонів
B. номеру групи в періодичній системі
C. номеру періоду
D. числу нейтронів
E. порядковому номеру в періодичній системі
19. Яка із сполук характеризується найнижчим ступенем окиснення Нітрогену?
A. HNO3
B. NO2
C. N2O5
D. NH3
E. HNO2
20. Максимальний ступінь окиснення елемента, як правило, дорівнює
A. різниці між позитивним ступенем окиснення та числом 8
B. номеру періоду
C. номеру підгрупи в періодичній системі
D. номеру ряду
E. номеру групи в періодичній системі
|
|
 Скачать 342.5 Kb.
Скачать 342.5 Kb.