Письмова робота
1. Напишіть рівняння реакцій, що підтверджують основний характер оксидів натрію і калію.
2. Що таке гіпс? Які сполуки утворюються при його термічному розкладі?
3. Напишіть рівняння таких перетворень:
а) BB2O3H3BO3Na2B4O7H3BO3;
б) Al → Al(NO3)3 → Al2O3 → K3[Al(OH)6] → Al2(SO4)3 → Al(HSO4)3 → → Al2(SO4)3 → AlCl3;
в) AlNa3[Al(OH)6]AlCl3Al(OH)Cl2Al(OH)3Al2O3.
4. Чи випаде осад при змішуванні рівних об’ємів розчинів Pb(NO3)2 та КІ, молярна концентрація яких 0,04моль/л?
5. У чому полягають основні відмінності у хімічних властивостях нітрогену і фосфору? Чим вони пояснюються?
6. Напишіть рівняння реакцій:
PH3 + KMnO4 + H2SO4 → H3PO4 + …
H3PO4 + Zn + H 2SO4 → PH3 + …
Sb + KСlO3 + H2SO4 → Sb2(SO4)3 + …
H3AsO3 + Zn + HCl →
AsH3 + KМnO4 + H2SO4 → H3AsO4 + …
7. Які хімічні перетворення відбуваються при розчиненні SО2 у воді?
8. Чому фтороводень має найбільш високу температуру кипіння, маючи найменшу молекулярну масу?
9. Як змінюється сила, стійкість та окисні властивості кислот у ряду HClO –HBrO – HIO?
10. Як одержати купрум (ІІ)гідроксид? Як на нього діють кислоти, луги, нагрівання. Написати рівняння відповідних реакцій.
11. Як діє надлишок розчину аміаку на солі цинку і ртуті (ІІ). Написати рівняння реакцій і назвати комплексні сполуки.
12. Скільки мілілітрів розчину калій дихромату з с(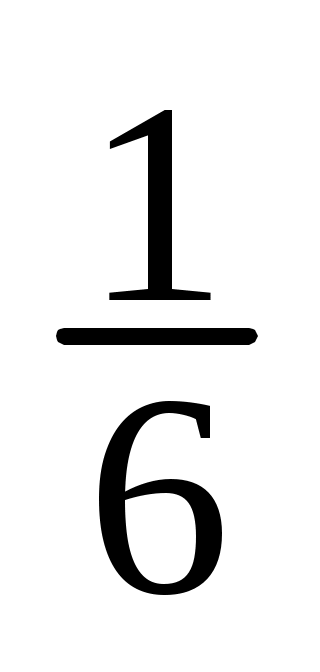 K2Cr2O7) = 0,5моль/л потрібно для повного окиснення 22г калій йодиду у кислому середовищі? Навести рівняння реакції, яка відбувається. K2Cr2O7) = 0,5моль/л потрібно для повного окиснення 22г калій йодиду у кислому середовищі? Навести рівняння реакції, яка відбувається.
13. Яка маса нітратної кислоти з ω(HNO3) 15% потрібна для розчинення 7г заліза, якщо при цьому утвориться NO?
Варіант № 7
1. Який з наведених металів за кімнатної температури не реагує з концентрованою нітратною кислотою?
A. Ca
B. Zn
C. Ba
D. Na
E. Al
2. Одна з класифікацій хімічних елементів ґрунтується на будові їх електронних оболонок. Згідно неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать до s-елементів?
A. K, Ca, Sr
B. S, P, Cl
C. Be, Mg, Al
D. Mn, Br, Mo
E. P, S, Cr
3. Які з вказаних пар речовин можна використовувати для одержання нітроген (ІІ)оксиду?
A. N2O3, NaOH
B. Cu, HNO3 [конц.]
C. NO, O2
D. HNO3, NaOH
E. NH3, O2
4. Один із способів класифікації хімічних елементів ґрунтується на врахування будови валентних електронних оболонок їх атомів (s-, p-, d- та f- елементи). Вкажіть який з елементів належіть до p -елементів:
A. K
B. Fe
C. Сu
D. Mg
E. Р
5. Яка молекулярна маса невідомого газу, якщо його густина за воднем дорівнює 15?
A. 15 г/моль
B. 60 г/моль
C. 45 г/моль
D. 30 г/моль
E. 7,5 г/моль
6. Максимальний ступінь окиснення елемента, як правило, дорівнює
A. номеру ряду
B. номеру групи в періодичній системі
C. номеру періоду
D. різниці між позитивним ступенем окиснення та числом 8
E. номеру підгрупи в періодичній системі
7. При взаємодії заліза з хлором утворюється:
A. Ферум (ІІІ) хлорит
B. Ферум хлорат
C. Ферум (ІІ) хлорат
D. Ферум гіпохлорит.
E. Ферум (ІІІ) хлорид
8. Яка із сполук характеризується найнижчим ступенем окиснення Нітрогену?
A. NH3
B. HNO2
C. HNO3
D. N2O5
E. NO2
9. В якій з наведених сполук ступінь окиснення Нітрогену дорівнює –2?
A. NH3
B. N2O
C. N2H4
D. NO
E. NO2
10. Максимальна ступінь окислення елемента, як правило, дорівнює
A. порядковому номеру в періодичній системі
B. числу протонів
C. номеру групи в періодичній системі
D. номеру періоду
E. числу нейтронів
|
11. Одним з показників якості води є її твердість. Яка з наведених солей може зумовлювати постійну твердість води?
A. NaCl
B. Mg(HCO3)2
C. СаSO4
D. Ca(HCO3)2
E. K2SO4
12. Яка з наведених взаємодій можлива за кімнатної температури?
A. Na + H2O =
B. Cu + H2O =
C. Au + HCl =
D. Fe + H2SO4 (конц.) =
E. Сr2O3 + H2 =
13. З розведеним розчином сульфатної кислоти не реагує:
A. Mg
B. Zn
C. Fe
D. Ca
E. Ag
14. Сульфур – типовий неметал, який знаходиться у VI групі головної підгрупі Періодичної системи. Яка валентність сульфуру у молекулі сульфітної кислоти?
A. IV
B. III
C. VI
D. II
E. V
15. Вкажіть, яка з наведених солей не підлягає гідролізу:
A. KI
B. ZnSO4
C. KNO2
D. Al2(SO4)3
E. CrCrCl3
16. Арґентум нітрат застосовують в офтальмології як бактерицидний, протизапальний засіб. AgNO3 можна одержати в результаті взаємодії між такими двома речовинами:
A. Ag2O + KNO3
B. Ag + НNO3
C. Ag + KNO3
D. AgCl + NaNO3
E. AgСl + NH4NO3
17. У результаті реакції надлишку ртуті з розведеною нітратною кислотою виділяється газ:
A. N2O4
B. NO
C. N2
D. N2O
E. NH3
18. Оксид нітрогену (I), відомий під назвою „звеселяючий газ”, у суміші з киснем використовують у медицині для наркозу. Вкажіть формулу цього оксиду.
A. N2O
B. NO
C. NO2
D. N2O3
E. N2O4
19. Вкажіть сполуку хрому, яка проявляє амфотерні властивості:
A. CrO
B. CrO3
C. Cr2O3
D. Cr(OH)2
E. K2CrO4
20. Яку хімічну формулу і забарвлення має продукт відновлення перманганату калію в нейтральному середовищі?
A. K2MnO4, зелений
B. MnSO4, безбарвний
C. K2MnO4, фіолетовий
D. MnO2, коричневий
E. MnO2, зелений
|
Письмова робота
1. Які ступені окиснення характерні для гідрогену у його сполуках? Які типи хімічного зв’язку утворює атом гідрогену в бінарних сполуках з іншими елементами?
2. Запропонуйте спосіб розділення суміші порошків берилію та магнію.
3. Чому B2O3 розчиняється у HF і не розчиняється у HCl?
4. З якими простими та складними речовинами реагує силіцій? Напишіть рівняння реакцій.
5. Яка сполука більш стійка: аміак чи гідразин?
6. Напишіть найпростіші та справжні формули оксидів фосфору. Які хімічні властивості вони проявляють?
7. З яких молекул складається твердий, рідкий та газоподібний сульфур?
8. Чи реагують селен та телур з лугами? Напишіть рівняння реакцій.
9. Чому йодоводнева кислота на повітрі буріє?
10. Напишіть рівняння реакцій:
а) HClO4 + P2O5
б) Cl2O6 + KOH
11. При зливанні водних розчинів сульфату купруму(ІІ) і карбонату натрію утворюється осад основної солі. Написати рівняння реакції в молекулярній та іонній формі.
12. Яка найважливіша природна сполука мангану? Як вилучають манган з руд? Коротко охарактеризувати хімічні властивості мангану. Навести по одній формулі сполук для всіх ступенів окиснення, що проявляє манган.
13. Яка найважливіша природна сполука мангану? Як вилучають манган з руд? Коротко охарактеризувати хімічні властивості мангану. Навести по одній формулі сполук для всіх ступенів окиснення, що проявляє манган.
14. Яку масу розчину аміаку з масовою часткою NH3 10% треба взяти, щоб перевести в аміачний комплекс 5г сполуки NiSO4∙7H2O?
Варіант № 8
1. Одним з показників якості води є її твердість. Яка з наведених солей може зумовлювати постійну твердість води?
A. Ca(HCO3)2
B. K2SO4
C. Mg(HCO3)2
D. СаSO4
E. NaCl
2. З розведеним розчином сульфатної кислоти не реагує:
A. Zn
B. Mg
C. Ca
D. Ag
E. Fe
3. Які з вказаних пар речовин можна використовувати для одержання нітроген (ІІ)оксиду?
A. N2O3, NaOH
B. Cu, HNO3 [конц.]
C. NO, O2
D. HNO3, NaOH
E. NH3, O2
4. Яка з наведених взаємодій можлива за кімнатної температури?
A. Cu + H2O =
B. Fe + H2SO4 (конц.) =
C. Na + H2O =
D. Au + HCl =
E. Сr2O3 + H2 =
5. Який з наведених металів за кімнатної температури не реагує з концентрованою нітратною кислотою?
A. Ca
B. Zn
C. Ba
D. Na
E. Al
6. Формулою хлорного вапна, що використовується як дезінфікуючий засіб, є:
A. CaOCl2
B. СaCl2
C. CaCO3
D. MgCO3
E. NaOCl
7. З якою з вказаних речовин взаємодіє концентрована сульфатна кислота з утворенням сульфур (IV) оксиду?
A. MgO
B. NaCl
C. CuO
D. Ca
E. Ag
8. Арґентум нітрат застосовують в офтальмології як бактерицидний, протизапальний засіб. AgNO3 можна одержати в результаті взаємодії між такими двома речовинами:
A. AgCl + NaNO3
B. Ag + KNO3
C. AgСl + NH4NO3
D. Ag2O + KNO3
E. Ag + НNO3
9. Яка з наступних речовин при дисоціації утворює іони Н+ і ОН- одночасно?
A. Ca(OH)2
B. H3PO4
C. H2O
D. NaOH
E. Sr(OH)2
10. Вкажіть сполуку хрому, яка проявляє амфотерні властивості:
A. K2CrO4
B. Cr(OH)2
C. CrO
D. CrO3
E. Cr2O3
|
11. Одна з класифікацій хімічних елементів ґрунтується на будові їх електронних оболонок. Згідно неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать до р-елементів?
A. K, Ca, Sc
B. Mn, Br, Mo
C. S, P, Cl
D. Be, Mg, Al
E. P, S, Cr
12. Яка із сполук характеризується найнижчим ступенем окиснення Нітрогену?
A. N2O5
B. NH3
C. HNO3
D. NO2
E. HNO2
13. Один із способів класифікації хімічних елементів ґрунтується на врахування будови валентних електронних оболонок їх атомів (s-, p-, d- та f- елементи). Вкажіть який з елементів належіть до p -елементів:
A. K
B. Fe
C. Сu
D. Mg
E. Р
14. Яка з галогеновмісних кислот міститься в організмі людини?
A. HI
B. HClO4
C. HClO
D. HBrO
E. HCl
15. Яку хімічну формулу і забарвлення має продукт відновлення перманганату калію в нейтральному середовищі?
A. MnO2, коричневий
B. MnO2, зелений
C. K2MnO4, зелений
D. K2MnO4, фіолетовий
E. MnSO4, безбарвний
16. Яка сполука Гідрогену з елементами VA групи періодичної системи є найбільш стійкою?
A. NH3
B. PH3
C. AsH3
D. SbH3
E. BiH3
17. Вкажіть молекулярну формулу оксиду, якому відповідає перманганатна кислота
A. Mn2O3
B. MnO
C. MnO2
D. Mn2O7
E. Mn3O4
18. У результаті реакції надлишку ртуті з розведеною нітратною кислотою виділяється газ:
A. N2O4
B. NO
C. N2
D. N2O
E. NH3
19. Метал, що поширений у природі в самородному стані:
A. Золото
B. Кальцій
C. Алюміній
D. Натрій
E. Хром
20. Сульфур – типовий неметал, який знаходиться у VI групі головної підгрупі Періодичної системи. Яка валентність сульфуру у молекулі сульфітної кислоти?
A. III
B. II
C. IV
D. VI
E. V
|
Письмова робота
1. Як одержують гідриди лужних металів? Які властивості вони проявляють? Який тип хімічного зв’язку у цих сполуках?
2. Напишіть рівняння реакцій таких перетворень:
а) Ca(HCO3)2 CaCO3 Ca(HCO3)2;
б) BaS BaCO3 BaCl2 BaSO4;
в) Ca CaO Ca(OH)2 CaCl2 Ca(NO3)2 CaSO4;
3. Назвіть комплексні сполуки, вкажіть тип гібридизації атомних орбіталей комплексоутворювача: K[BF4], Na3[AlF6], [Al(H2O)6]Cl3.
4. Напишіть електронну формулу атома нітрогену. Перерахуйте його можливості утворювати ковалентні зв’язки. За допомогою методу МО поясніть , чи має молекула N2 парамагнітні властивості?
5. Напишіть рівняння хімічних реакцій, в яких фосфор є окисником, відновником, диспропорціонує.
6. Як можна розпізнати арсенове та стибієве «дзеркала»?
7. Які солі можуть утворитися при пропусканні сірчистого газу через розчин лугу? Напишіть рівняння реакцій.
8. Як змінюється здатність утворювати водневі зв’язки у ряду НF – НІ?
9. Як одержати хлорати, бромати, йодати? Напишіть рівняння відповідних реакцій.
10. Чому хлорид аргентуму розчиняється в надлишку аміаку, а йодид аргентуму не розчиняється? Як діє на бромід аргентуму тіосульфат натрію? Написати рівняння реакцій утворення і дисоціації комплексних сполук.
11. Які сполуки утворюються при розчиненні цинку в концентрованій та в розбавленій сульфатній кислоті? Написати рівняння реакцій.
12. Що являє собою “хромова суміш”? Як її готують та де використовують? Чим зумовлені властивості цієї суміші?
13. Маємо суміш солей FeSO4 та Fe2(SO4)3. Яким реактивом можна одностадійно перевести цю суміш у сульфат феруму(ІІІ)?
Варіант № 9
1. З розведеним розчином сульфатної кислоти не реагує:
A. Fe
B. Ca
C. Ag
D. Zn
E. Mg
2. Які з вказаних пар речовин можна використовувати для одержання нітроген (ІІ)оксиду?
A. Cu, HNO3 [конц.]
B. N2O3, NaOH
C. HNO3, NaOH
D. NH3, O2
E. NO, O2
3. При взаємодії хлору з водою утворюється:
A. HClO + Cl2O7
B. HClO + HClO3
C. HClO + HCl
D. HClO + HClO3
E. HClO + HClO4
4. Який з наведених металів не реагує з хлоридною кислотою?
A. Fe
B. Al
C. Ag
D. Zn
E. Ca
5. Максимальна ступінь окислення елемента, як правило, дорівнює
A. порядковому номеру в періодичній системі
B. числу протонів
C. номеру групи в періодичній системі
D. номеру періоду
E. числу нейтронів
6. Оксиди елементів VA групи, які використовують у фармації:
A. NO2, As2O5
B. N2O, As2O3
C. NO, P2O5
D. NO, NO2
E. As2O3, P2O5
7. Одна з класифікацій хімічних елементів ґрунтується на будові їх електронних оболонок. Згідно неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать до р-елементів?
A. Be, Mg, Al
B. P, S, Cr
C. Mn, Br, Mo
D. S, P, Cl
E. K, Ca, Sc
8. З якою з вказаних речовин взаємодіє концентрована сульфатна кислота з утворенням сульфур (IV) оксиду?
A. NaCl
B. MgO
C. Ca
D. Ag
E. CuO
9. В якій з наведених сполук ступінь окиснення Нітрогену дорівнює –2?
A. NO2
B. NO
C. NH3
D. N2O
E. N2H4
10. Який з наведених металів за кімнатної температури не реагує з концентрованою нітратною кислотою?
A. Ba
B. Na
C. Al
D. Zn
E. Ca
|
11. У результаті реакції надлишку ртуті з розведеною нітратною кислотою виділяється газ:
A. NO
B. NH3
C. N2
D. N2O4
E. N2O
12. У ряду НF – HCI – HBr – HI
A. сила кислот однакова
B. зменшується стійкість молекули, сила кислот спадає
C. зростає стійкість молекули, сила кислот зростає
D. збільшується стійкість молекули, сила кислот спадає
E. зменшується стійкість молекули, сила кислот зростає
13. Нітроген (І) оксид (N2O) використовується для інгаляційного наркозу. Його одержують при нагріванні:
A. NH3·H2O
B. NH4NO3
C. Cu(NO3)2
D. NaNO3
E. NH3
14. Один із способів класифікації хімічних елементів ґрунтується на врахування будови валентних електронних оболонок їх атомів (s-, p-, d- та f- елементи). Вкажіть який з елементів належіть до p -елементів:
A. Fe
B. K
C. Mg
D. Р
E. Сu
15. При взаємодії заліза з хлором утворюється:
A. Ферум (ІІІ) хлорит
B. Ферум хлорат
C. Ферум (ІІ) хлорат
D. Ферум гіпохлорит.
E. Ферум (ІІІ) хлорид
16. Вкажіть сполуку хрому, яка проявляє амфотерні властивості:
A. CrO3
B. Cr2O3
C. Cr(OH)2
D. K2CrO4
E. CrO
17. Ферум у сполуках може знаходитись у різних ступенях окиснення. Який найвищий ступінь окиснення феруму у сполуках:
A. +2
B. +3
C. +8
D. +4
E. +6
18. Який галоген у вигляді простої речовини за кімнатних умов є рідиною:
A. Сірка
B. Азот
C. Водень
D. Бром
E. Фосфор
19. В якій із сполук Оксиген виявляє позитивний ступінь окиснення?
A. KO2
B. OF2
C. H2O2
D. KO3
E. CO2
20. З хлоридною кислотою не взаємодіють наступні метали:
A. Cu, Ag
B. Mg, Cr
C. Fe, Co
D. Zn, Mg
E. Na, Ca
|
|
 Скачать 342.5 Kb.
Скачать 342.5 Kb.