Контрольная работа Физиколлоидная химия. Контрольная работа физкаллоидная хмия и физикохимическе методы анализа
 Скачать 40.79 Kb. Скачать 40.79 Kb.
|
|
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ ЗАОЧНЫЙ УНИВЕРСИТЕТ ФАКУЛЬТЕТ ДЕКОРАТИВНОЕ САДОВОДСТВО И ЛАНДШАФТНЫЙ_ДИЗАЙН (БАК. 5 ЛЕТ) КАФЕДРААГРОХИМИИ, ЗАЩИТЫ РАСТЕНИЙ И ХИМИИ им. А.С. ГУЗЕЯ КОНТРОЛЬНАЯ РАБОТА «ФИЗКАЛЛОИДНАЯ ХМИЯ И ФИЗИКО-ХИМИЧЕСКЕ МЕТОДЫ АНАЛИЗА» ВЫПОЛНИЛ: СТУДЕНТ БАКАЛАВРИАТА ЯРОВАЯ Д.В. шифр№__1307_ ПРОВЕРИЛ: ___________________________ БАЛАШИХА – 2019 №8 Дайте определение понятиям термодинамики: «система (открытая, закрытая, изолированная)»; «состояние системы»; «параметры состояния»; «функции состояния»; «процесс». Охарактеризуйте различные процессы: самопроизвольные и несамопроизвольные; обратимые и необратимые. Охарактеризуйте понятия «энергия», «теплота», «работа». Сформулируйте 1 закон термодинамики и закон Гесса. Найдите стандартную энтальпию реакции по величинам энтальпий образования исходных веществ и продуктов реакции (в соответствии со своим вариантом). Укажите, будет ли данная реакция экзо - или эндотермической. Система – это совокупность объектов, выделенных по тем или иным соображениям и находящихся в определенном ограниченном пространстве (объеме). Открытые системы могут обмениваться с окружающей средой и энергией, и веществом. Закрытые системы могут обмениваться с окружающей средой только энергией. Изолированные системы не могут обмениваться с окружающей средой ни энергией, ни веществом. Состояние системы – совокупность всех физических и химических свойств системы. Параметры состояния – это такие свойства, которые можно измерить для данной системы и далее количественные величины измеренных параметров применять как для предсказания поведения системы, так и для расчета других неизвестных параметров. Функции состояния – термодинамические потенциалы, величины, значение которых зависит только от состояния системы и не зависит от пути, по которому это состояние получено. Их нельзя экспериментально измерить и рассчитать, можно только вычислить их изменение. U – внутренняя энергия, Дж H – энтальпия, Дж F – свободная энергия Гельмогольца, Дж G – энергия Гиббса, Дж/моль S – энтропия, Дж/К Процесс – изменение состояния системы, сопровождающийся изменением хотя бы одного из параметров системы во времени. Самопроизвольные процессы – процессы, которые совершаются в системе без вмешательства со стороны окружающей среды. В этих процессах всегда уменьшается внутренняя энергия системы. Энергия передается в окружающую среду в виде теплоты или работы. В самопроизвольном процессе работа превращается в теплоту. Несамопроизвольные процессы – процессы, для протекания которых требуется затрата работы извне в количестве, пропорциональном производимому изменению состояния системы. Обратимый процесс – процесс, который может быть проведен в прямом и обратном направлении без остаточных изменений в окружающей среде. Необратимый процесс – связан с диссипацией энергии. Большинство процессов в природе необратимы. Внутренняя энергия – определяется как энергия случайных, находящихся в неупорядоченном движении молекул. Тепло – энергия, передаваемая от объекта с высокой температурой к объекту с менее высокой температурой. Работа – процесс изменения внутренней энергии системы за счет обмена энергией упорядоченного движения между системой и окружающими телами. Первый закон термодинамики: - при всех взаимных превращениях энергии она не теряется и не создается; - всякий двигатель, производящий работу без затрат энергии, невозможен; - в изолированной системе сумма всех видов энергии постоянна; - количество теплоты, полученное системой, равно увеличению ее внутренней энергии и произведенной ею работы. Закон Гесса – тепловой эффект реакции зависит только от начального и конечного состояния системы и не зависит от пути процесса. С6Н12О6 (т) = 2С2Н5ОН (ж) + 2СО2 (г) Из приложения 1 находим: ΔH(C6H12O6) = -1273 кДж/моль; ΔH(CO2) = -393,5; ΔH(С2Н5ОН) = -277,6 ΔHреакц = [2(-393,5) + 2(-277,6)] – [(-1273)] = 69,2; ΔHреакц > 0, значит реакция эндотермичская. №27 Что такое энергия активации химического процесса? Как она влияет на скорость реакции? Как влияют ферменты на величину энергии активации? Представьте уравнение Михаэлиса-Ментен и поясните все входящие в него величины. А. Для химических реакций Вашего варианта составьте кинетические уравнения. Б. Найдите количество анестезирующего препарата фенобарбитала, которое требуется ввести (однократно) животному, если предполагается, что операция продлится в течение указанного в таблице времени. Доза, вызывающая анестезию, равна 30мг на 1кг веса, период полураспада фенобарбитала 4,5 часа, его распад – реакция первого порядка. Энергия активации химического процесса — эмпирически определяемый параметр, характеризующий показательную зависимость константы скорости реакции от температуры. Выражается в джоулях на моль. Скорость реакции непосредственно зависит от энергии активации. Если энергия активации мала, то реакция идет с большой скоростью (реакции между ионами идут практически мгновенно). Ферменты, действуя как катализаторы, снижают энергию активации, которая требуется для того, чтобы могла произойти реакция. Они повышают общую скорость реакции, не изменяя в сколько-нибудь значительной степени температуру, при которой эта реакция протекает. Фермент, соединяясь с субстратом, образует короткоживущий фермент-субстратный комплекс (E-S-комплекс). В таком комплексе шанс на то, что реакция произойдет, значительно возрастают. По завершении реакции E-S-комплекс распадается на продукт (или продукты) и фермент. Фермент в реакции не изменяется: по окончании реакции он остается таким же, каким был до нее, и может теперь взаимодействовать с новой молекулой субстрата. Уравнение Михаэлиса – Ментен – основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата. Уравнение названо в честь физикохимиков Леонора Михаэлиса и Мод Леоноры Ментен, опубликовавших в 1913 году статью, в которой они провели математический анализ ферментативной кинетики. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса: E + S ↔ ES → E + P Уравнение имеет вид: 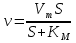 где: 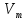 – максимальная скорость реакции, равная – максимальная скорость реакции, равная 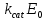 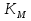 – константа Михаэлиса. По определению, – константа Михаэлиса. По определению,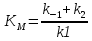 , где , где 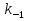 есть константа скорости реакции распада фермент-субстратного комплекса на фермент и исходный субстрат, есть константа скорости реакции распада фермент-субстратного комплекса на фермент и исходный субстрат, 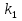 есть константа скорости реакции образования фермент-субстратного комплекса и есть константа скорости реакции образования фермент-субстратного комплекса и 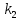 есть константа скорости реакции распада фермент-субстратного комплекса на фермент и продукт. Константа Михаэлиса численно равна концентрации субстрата, при которой скорость реакции составляет половину от максимальной. есть константа скорости реакции распада фермент-субстратного комплекса на фермент и продукт. Константа Михаэлиса численно равна концентрации субстрата, при которой скорость реакции составляет половину от максимальной.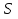 – концентрация субстрата. – концентрация субстрата.А. NH3 (г) + HClO4 (ж) = NH4ClO4 (тв) Кинетическое уравнение: 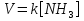 Б. масса животного – 50 кг, время операции – 3 ч, 30 мг/кг, период полураспада – 4,5 часа 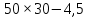 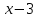 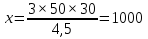 Ответ: 1000 мг №42 Сформулируйте принцип Ле–Шателье и возможность применения этого принципа к анализу равновесий в животных системах. Каким образом осуществляется равновесие между фазами в чистых веществах. Дайте определение понятиям «фаза», «компонент», «степень свободы», приведите правило фаз. А. Составьте выражение константы равновесия и вычислите ее значение. (Равновесие концентрации моль/л реагирующих веществ приведены под соответствующими химическими формулами в уравнении реакции). Какова связь между константой равновесия и изобарно–изотермическим потенциалом? Б. Рассчитайте ∆G0 для данной химической реакции при температуре 298 Принцип Ле-Шателье – если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные в сторону противодействия изменениям. Этот общеизвестный принцип также может быть применен к квазизакрытым биосистемам любой природы и иерархичности. Его называют принципом наименьшего принуждения и в упрощенном варианте часто формулируют следующим образом: поведенческие реакции закрытой системы направлены на компенсацию внешнего возмущения. А. 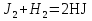 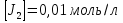 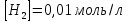 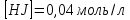 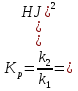 Стандартная константа равновесия связана со стандартной энергиейГиббса реакции соотношением: 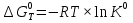 Б. 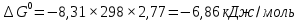 №52 Что такое осмос? Осмотическое давление? Какую роль играет величина осмотического давления клеточного сока в регулировке тока воды в клетку и из клетки? Какие растворы называются изотоническими, гипертоническими, гипотетическими? Для приведенных ниже растворов рассчитайте величину осмотического давления и среднюю молекулярную массу растворенных веществ для биологических объектов. Растворитель во всех случаях – вода, ее криоскопическая постоянная 1,86 град г/моль. Почему расчетное значение осмотического давления в растворах белков ниже измеряемого? Осмос - процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентрации растворённого вещества из объёма с меньшей концентрацией растворенного вещества. Осмотическое давление - избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя. Осмос приводит к возникновению тургорного давления в клетках. Изотонические растворы - растворы с одинаковым осмотическим давлением; в биологии и медицине - природные или искусственно приготовленные растворы с таким же осмотическим давлением, как и в содержимом животных и растительных клеток, в крови и тканевых жидкостях. Гипертонические растворы - растворы, осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях. Гипотонические растворы - в биологии, различные растворы, осмотическое давление которых ниже, чем в клетках растительных или животных тканей. 7,24% 2,42 мочевина 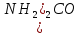 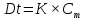 ɷ (растворителя) = 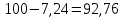 пусть масса раствора = 100г, тогда 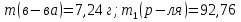 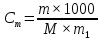 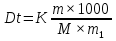 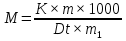 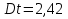 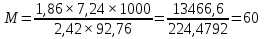 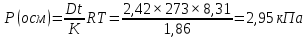 Белки могут вести себя как электролиты (аминокислоты, образующие белки, могут находиться в виде биполярных ионов), следовательно, в уравнение 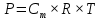 необходимо вводить изотонический коэффициент i, т.е. наблюдаемое значение P в этом случае будет выше расчетного по формуле выше в i раз. необходимо вводить изотонический коэффициент i, т.е. наблюдаемое значение P в этом случае будет выше расчетного по формуле выше в i раз.№67 Составьте ионные и молекулярные уравнения гидролиза по всем ступеням приведенных в вашем задании солей. Укажите реакцию среды в растворе соли. Напишите выражения для константы гидролиза. Для гидролиза соли по аниону рассчитайте величину константы гидролиза. Укажите направление смещения равновесия гидролиза при подкислении раствора рассматриваемой соли. Хлорид железа (III), сульфид натрия FeCl3 – соль слабого основания и сильной кислоты, поэтому гидролиз протекает по катиону. 1 ступень. Молекулярное уравнение: FeCl3 + HOH ⇄ FeOHCl2 + HCl Полное ионное уравнение: Fe3+ + 3Cl- + HOH ⇄ FeOH2+ + 2Cl- + H+ + Cl- Краткое ионное уравнение: Fe3+ + HOH ⇄ FeOH2+ + H+ 2 ступень. Молекулярное уравнение: FeOHCl2 + H2O ⇄ Fe(OH)2Cl + HCl Полное ионное уравнение: FeOH2+ + 2Cl- + H2O ⇄ Fe(OH)2+ + Cl- + H+ + Cl- Краткое ионное уравнение: FeOH2+ + H2O ⇄ Fe(OH)2+ + H+ 3 ступень. Молекулярное уравнение: Fe(OH)2Cl + H2O ⇄ Fe(OH)3 + HCl Полное ионное уравнение: Fe(OH)2+ + Cl- + H2O ⇄ Fe(OH)3 + H+ + Cl- Краткое ионное уравнение: Fe(OH)2+ + H2O ⇄ Fe(OH)3 + H+ Так как в результате гидролиза образовались ионы водорода (H+), раствор будет иметь кислую среду. 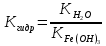 При подкислении раствора направление равновесия сместится влево. Na2S – соль сильного основания и слабой кислоты, поэтому гидролиз протекает по аниону. 1 ступень. Молекулярное уравнение: Na2S + H2O ⇄ NaOH + NaHS Полное ионное уравнение: 2Na+ + S2- + H2O ⇄ Na+ + OH- + Na+ + HS- Краткое ионное уравнение: S2- + H2O ⇄ HS- + OH- 2 ступень. Молекулярное уравнение: NaHS + H2O ⇄ NaOH + H2S Полное ионное уравнение: Na+ + HS- + H2O ⇄ Na+ + OH- + H2S Краткое ионное уравнение: HS- + H2O ⇄ H2S + OH- Так как в результате гидролиза образовались гидроксид-ионы (OH-), раствор будет иметь щелочную среду.  При подкислении раствора равновесие сместится вправо. №72 Составьте ионные и молекулярные уравнения гидролиза по всем ступеням приведенных в вашем задании солей. Укажите реакцию среды в растворе соли. Напишите выражения для константы гидролиза. Для гидролиза соли по аниону рассчитайте величину константы гидролиза. Укажите направление смещения равновесия гидролиза при подкислении раствора рассматриваемой соли. (Хлорид цинка, силикат калия). ZnCl2 – соль слабого основания и сильной кислоты, поэтому гидролиз протекает по катиону. 1 ступень. Молекулярное уравнение: ZnCl2 + HOH ⇄ ZnOHCl + HCl Полное ионное уравнение: Zn2+ + 2Cl- + HOH ⇄ ZnOH+ + Cl- + H+ + Cl- Краткое ионное уравнение: Zn2+ + HOH ⇄ ZnOH+ + H+ 2 ступень. Молекулярное уравнение: ZnOHCl + H2O ⇄ Zn(OH)2 + HCl Полное ионное уравнение: ZnOH+ + Cl- + H2O ⇄ Zn(OH)2 + H+ + Cl- Краткое ионное уравнение: ZnOH+ + H2O ⇄ Zn(OH)2 + H+ Так как в результате гидролиза образовались ионы водорода (H+), то раствор будет иметь кислую среду.  При подкислении раствора направление равновесия сместится влево. K2SiO3 – соль сильного основания и слабой кислоты, поэтому гидролиз протекает по аниону. 1 ступень. Молекулярное уравнение: K2SiO3 + HOH ⇄ KHSiO3 + KOH Полное ионное уравнение: 2K+ + SiO32- + HOH ⇄ K+ + HSiO3- + K+ + OH- Краткое ионное уравнение: SiO32- + HOH ⇄ HSiO3- + OH- 2 ступень. Молекулярное уравнение: KHSiO3 + H2O ⇄ H2SiO3 + KOH Полное ионное уравнение: K+ + HSiO3- + H2O ⇄ H2SiO3 + K+ + OH- Краткое ионное уравнение: HSiO3- + H2O ⇄ H2SiO3 + OH- Так как в результате гидролиза образовались гидроксид-ионы (OH-), то раствор имеет щелочную среду.  При подкислении раствора равновесие сместится вправо. №82 Ответить на общие теоретические вопросы и решить индивидуальные задачи. В чем сущность процесса электролиза? Виды электролиза и его законы. Опишите процесс «полярография» и «амперометрическое титрование». Составить схемы электролиза водных растворов H2SO4, СuCl2, Pb(NO3)2 с платиновыми электродами. Электролиз – это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролитов. Для осуществления электролиза к отрицательному полюсу внешнего источника постоянного тока присоединяют катод, а к положительному полюсу – анод, после чего погружают их в электролизер с раствором или расплавом электролита. На поверхности электрода, подключенного к отрицательному полюсу источника постоянного тока (катоде), ионы, молекулы или атомы присоединяют электроны, то есть протекает реакция электрохимического восстановления. На положительном электроде (аноде) происходит отдача электронов, то есть реакция окисления. Таким образом, сущность электролиза состоит в том, что на катоде происходит процесс восстановления, а на аноде — процесс окисления. Минимальное напряжение электролитического тока, приложенное к электродам, при котором начинается электролиз вещества, называется его потенциалом разложения. Процессы электролиза подчиняются законам Фарадея: Первый закон: Масса электролита, подвергшаяся химическому превращению, а также массы веществ, выделившихся на электродах, прямо пропорциональны количеству электричества, прошедшему через расплав или раствор электролита.  m – масса вещества, выделившегося на электроде (кг) k – электрохимический эквивалент вещества q – заряд, прошедший через электролит t – время прохождения заряда (с) I – сила тока (А) Второй закон: При пропускании одинакового количества электричества через растворы или расплавы различных электролитов масса веществ, выделяющихся на электродах, пропорциональна их химическим эквивалентам. 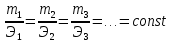 m1, m2, m3 – массы прореагировавших веществ, Э1, Э2, Э3 – химические эквиваленты. Химический эквивалент может быть определен по формуле: 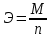 M – молекулярная масса реагента, n – число электронов, участвующих в реакции. Второй закон Фарадея можно представить в виде формулы: k = cx. Если данной выражение использовать вместе с первым законом Фарадея, то в результате получится следующее выражение: m = kq = cxq = cxlt. Здесь категория с представляет собой универсальную постоянную, в размере 0,00001036 г-экв/к. Подобная формулировка дает возможность понять, что одни и те же токи, пропущенные через одинаковый промежуток времени в двух различных электролитах, выделят из них вещества с соблюдением рассмотренного химического эквивалента. Поскольку x = A/n, то масса выделяемого вещества будет выглядеть как m = cA/nlt, с соблюдением прямой пропорции с атомным весом и обратной пропорции с валентностью. Полярография — один из важнейших электрохимических методов анализа веществ, исследования кинетики химических процессов. Протекание электрического тока в водном растворе связано с движением ионов, образованных в результате электролитической диссоциации. Протекание тока через ртуть, другие металлические и углеродные материалы — с движением электронов. Поэтому на границе электрод/раствор должен существовать какой-то процесс, обеспечивающий переход потока ионов в поток электронов, иначе ток не пойдет. Такой процесс представляет собой электрохимическую реакцию. Количество прореагировавшего вещества определяется законом Фарадея, то есть пропорционально прошедшему через электрод заряду. Метод основан на анализе кривых зависимостей силы тока от приложенного к электрохимической ячейке напряжения — так называемых полярограмм. В зависимости от формы и скорости изменения поляризующего напряжения различают постояннотоковую (классическую), переменнотоковую, высокочастотную, импульсную, осциллографическую полярографию, варианты метода имеют различные чувствительность (минимально определяемая концентрация вещества) и разрешающую способность (допустимое отношение концентраций определяемого компонента и сопутствующих). В ячейке для полярографии присутствуют поляризуемый и неполяризуемый электроды, площадь первого должна быть значительно меньше площади второго — в таком случае идущая на нём электродная реакция не вызывает заметных химических изменений в растворе или изменения разности потенциалов. В качестве поляризуемого электрода могут быть использованы ртутно-капающий электрод, стационарный ртутный электрод, твёрдые электроды из графита, благородных металлов. Амперометрическое титрование представляет собой объемный метод анализа, в котором для индикации конечной точки используется явление диффузионного тока, наблюдаемое на ртутном капельном или вращающемся платиновом электроде. Амперометрическое титрование сочетает объемные и полярографические методы анализа. Полярографический метод основан на пропорциональности между величиной диффузионного предельного тока электрода и концентрацией вещества, участвующего в электрохимическом процессе. При полярографировании регистрируют изменения тока, проходящего через индикаторный ртутный электрод, при изменении потенциала. С увеличением отрицательного потенциала сначала происходит увеличение силы тока, характеризующее начало восстановления на катоде ионов металла, затем происходит эффект насыщения, вызванный местным уменьшением концентрации ионов данного металла вблизи ртутного электрода. Ионы металла, попадающие на электрод благодаря диффузии их через раствор, немедленно восстанавливаются. Скорость диффузии определяется разностью между концентрацией ионов металла в общем объеме раствора и концентрацией ионов металла на поверхности катода, где она равна нулю. Возникает участок кривой, где не происходит увеличения тока при изменении потенциала. Ток на этом участке кривой называется диффузионным током, последний линейно связан с концентрацией С ионов металла в растворе. При амперометрическом титровании можно добавлением титрапта снизить концентрацию ионов, дающих электродную реакцию, при этом снижается и величина диффузионного тока. Зависимость между количеством добавленного титраита и величиной диффузионного тока представляет собой кривую амперометрического титрования. При проведении амперометрического титрования на индикаторном электроде устанавливают потенциал, соответствующий области диффузионного тока того вещества, которое участвует в электродном процессе и концентрация которого меняется в процессе титрования. Схема электролиза водного раствора H2SO4: Из-за наличия перенапряжения выделения O2 на платине, на электродах будут происходить следующие процессы: на аноде: 2(SO4)2- − 2e- = (S2O8)2- на катоде: 2(H3O)+ + 2e- = H2↑ + 2H2O суммарное уравнение: 2H2SO4 = H2S2O8 (на аноде) + H2↑ (на катоде). Схема электролиза водного раствора Pb(NO3)2: Из-за наличия перенапряжения выделения O2 на платине, на электродах будут происходить следующие процессы: на аноде: первоначально образуется пероксонитрат нитрония N2O6, но затем он разлагается на NO2 и O2: 2(NO3)- − 2e- = N2O6, N2O6 = 2NO2↑ + O2↑ на катоде: Pb2+ + 2e- = Pb суммарное уравнение: Pb(NO3)2 = 2NO2↑ + O2↑ (на аноде) + Pb (на катоде). №86 Что такое адсорбция? Каковы причины этого явления? Какие факторы влияют на величину адсорбции? Как описывает связь величины адсорбция с концентрацией адсорбирующего вещества теории Ленгмюра? Где применяют уравнение Фрейндлиха? Рассчитайте величину адсорбции уксусной кислоты почвой по данным концентрациям кислоты в моль/л, представленным в таблице. Адсорбция – процесс самопроизвольного концентрирования газов или растворенных веществ на поверхности раздела фаз. В зависимости от природы контактирующих фаз различают адсорбцию на границах: газ – твердое тело, газ – жидкость, жидкость – твердое тело и жидкость – жидкость. Адсорбция является следствием снижения ненасыщенности молекулярных, атомных или ионных сил на поверхности раздела фаз и обусловлена накоплением вещества, снижающего свободную поверхностную энергию. Адсорбция – процесссамопроизвольный, т.к. в результате процесса адсорбции происходит уменьшение свободной поверхностной энергии, а по второму закону термодинамики такие процессы являются самопроизвольными. Вещества, которые адсорбируются, называют адсорбатами, а вещества, которые адсорбируют на своей поверхности - адсорбентами. В зависимости от характера сил, действующих между частицами (молекулы, атомы, ионы) адсорбата и адсорбента, различают физическую или ван-дер-ваальсову адсорбцию и химическую или хемосорбцию. Изотерма адсорбции по Ленгмюру является уравнением гиперболы и может быть представлена в виде: 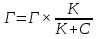 Г – величина адсорбции на единицу поверхности Г - предельное количество вещества, адсорбированного единицей поверхности при полном насыщении поверхности С – равновесная концентрация. В уравнении Ленгмюра также имеются две константы - Г и К. Вывод уравнения Ленгмюра основан на предположении о мономолекулярном слое адсорбированного вещества. Молекулы адсорбата поглощаются лишь на отдельных точках поверхности адсорбента. Эти точки – активные центры – обладают остаточными валентностями и способны связывать только одну молекулу адсорбата. Заполнение всех активных центров соответствует насыщению поверхности. Таким образом, насыщенный адсорбционный слой мономолекулярен, то есть только один слой молекул связан силами молекулярного сцепления с поверхностью. На твердой поверхности при постоянной температуре устанавливается подвижное равновесие между молекулами, адсорбирующимися на поверхности, и молекулами, отрывающимися от поверхности. Концентрация адсорбата на момент установления динамического адсорбционного равновесия называется равновесной. Следовательно, активные центры удерживают адсорбированные молекулы только в течение определенного промежутка времени. На самом деле поверхность большинства адсорбентов неоднородна, между адсорбционными частицами имеет место взаимодействие, и адсорбция часто не ограничивается образованием мономолекулярного слоя. В этом случае уравнение изотермы адсорбции усложняется. Г.Фрейндлих предположил, что масса адсорбированного газа или растворенного вещества, приходящаяся на единицу массы адсорбента, должна быть пропорциональна равновесному давлению (для газа) или равновесной концентрации (для твердого вещества, адсорбируемого из раствора), возведенной в какую-то степень. Другими словами, чем выше давление и чем больше концентрация растворенного вещества, тем больше вещества будет адсорбироваться на поверхности, однако пропорциональность должна носить не прямой, а экспоненциальный характер. Это положение выражается эмпирическим уравнением: 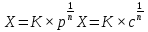 х – масса адсорбированного вещества, приходящаяся на 1 г адсорбирующего материала, г; р – равновесное давление; с – равновесная концентрация; К и n – константы. Константа К колеблется в широких пределах и зависит от природы адсорбента и адсорбата, а также от температуры. К представляет собой величину адсорбции при давлении или концентрации равных единице. Константа 1/n –адсорбционный показатель, её значения обычно лежат в пределах 0,1-1 и зависят от природы адсорбата и температуры. С повышением температуры константа К уменьшается, а 1/n увеличивается. №97 В чем сущность правила Шульце–Гарди? Представьте в таблице строение мицеллы для коллоидов, полученных по реакциям в таблице. Расположите нижеперечисленные электролиты в порядке увеличения их коагулирующей силы для этих коллоидов, NaCl, Na2SO4, CuCl2, Al2(SO4)3, AlCl3, K4[Fe(CN)6]. Правило Шульце-Гарди: из двух ионов электролита коагулирующим действием обладает тот, знак которого противоположен знаку заряда коллоидной частицы, причем это действие тем сильнее, чем выше валентность коагулирующего иона. Na2SiO3 + 2HCl → H2SiO3↓+2NaClизб Строение мицеллы: {[mSiO2·jH2O] nSiO32-·2(n – x)H+·yH2O}2х- 2xH+·zH2O Электролиты в порядке увеличения их коагулирующей силы: NaCl, Na2SO4, K4[Fe(CN)6], CuCl2, AlCl3, Al2(SO4)3. №117 Окислительно-восстановительный потенциал (ОВП), уравнение для расчета ОВП, ОВП почвы, его зависимость от величины рН, влияние ОВП на состояние макро- и микроэлементов в почве. Записать указанную в задаче электрохимическую цепь. Индикаторный электрод во всех задачах – платиновый. Рассчитать отсутствующую в таблице величину по имеющимся в таблице данным. Интенсивность присоединения или отдачи электронов различными ионами измеряется окислительно-восстановительным редокс-потенциалом (ОВП). Редокс-потенциал определяют электрохимическими методами. Чем больше редокс-потенциал данного вещества, тем интенсивнее окисляющее действие, а чем меньше потенциал, тем интенсивнее восстанавливающее действие данного вещества. Величину ОВП рассчитывают по уравнению Нернста-Петерса: 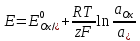 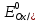 – стандартный окислительно-восстановительный потенциал, В – стандартный окислительно-восстановительный потенциал, ВR – универсальная газовая постоянная Т – абсолютная температура, К z – число электронов, участвующих в полуреакции F – число Фарадея, 96500 Кл aOxи aRed – активная концентрация окисленной (Ox) и восстановленной (Red) форм При Т = 298 К уравнение Нернста-Петерса имеет вид: 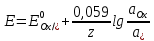 Список использованной литературы. 1) Физическая и коллоидная химия: учебник/ Под. ред. А.П. Беляева.–М.: ГЭОТАР-Медиа, 2010. – 704 с. 2) Гельфман М.И. Коллоидная химия. Учебник для вузов / М.И. Гельфман, О.В. Ковалевич, В.П. Юстратов. – СПб.: Изд. «Лань», 2010. – 336 с. 3) Физическая и коллоидная химия: учебник/ Под. ред. А.П. Беляева.–М.: ГЭОТАР- Медиа, 2010. – 704 с. 4) Хмельницкий Р.А. Физическая и коллоидная химия: учеб. пособие для с.-х. вузов. – М.: Изд. Дом Альянс, 2009. – 400 с. 5) Болдырев А.И. Физическая и коллоидная химия: учеб. пособие для с.-х. вузов. – М.: Высш. шк., 1983. – 408 с. |
