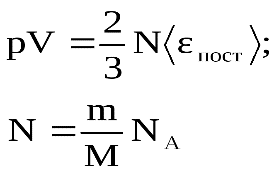Контрольные вопросы к зачету Предмет физики. Связь физики с другими науками и техникой. Характеристики поступательного движения точки
 Скачать 1.81 Mb. Скачать 1.81 Mb.
|
20. Основное уравнение молекулярно – кинетической теории идеальных газов и его следствия.Рассмотрим одноатомный идеальный газ, занимающий некоторый объем V(рис.1.1.) Пусть число столкновений между молекулами пренебрежимо мало по сравнению с числом столкновений со стенками сосуда. В 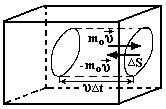 Рис.1.1. К выводу основного уравнения молекулярно-кине тической теории. ыделим на стенке сосуда некоторую элементарную площадку ΔSи вычислим давление, оказываемое на эту площадку. При каждом соударении молекула, массойm0, движущаяся перпендикулярно площадке со скоростьюυ, передает ей импульс, который представляет собой разницу импульсов молекулы до и после соударения: m0υ-(-m0υ) = 2m0υ. За время Δtплощадки ΔSдостигнут только те молекулы, которые заключены в объеме цилиндра с основанием ΔSи длинойυΔt. Это число молекул будетnυΔSΔt, гдеn– концентрация молекул. Необходимо, однако, учитывать, что реально молекулы движутся к площадке под разными углами и имеют различные скорости, причем скорость молекул при каждом соударении меняется. Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трех взаимно перпендикулярных координатных осей, так что в любой момент времени вдоль каждого из них движется 1/3 молекул, причем половина – 1/6 – движется в одну сторону, половина – в противоположную. Тогда число ударов молекул, движущихся в заданном направлении, о площадку ΔSбудетnυΔSΔt/6. При столкновении с площадкой эти молекулы передадут ей импульс 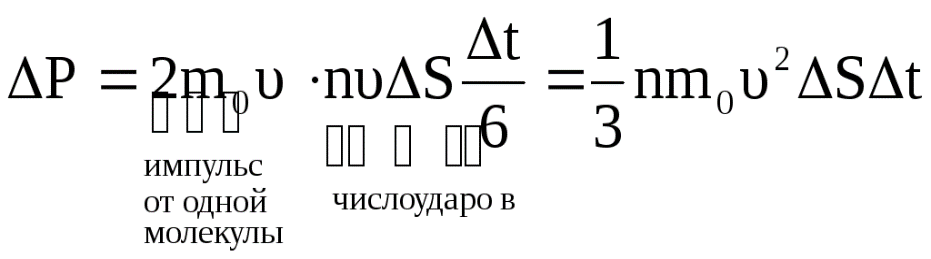 . .В данном случае, когда сила, действующая на единицу площади, постоянна, для давления газа на стенку сосуда мы можем записать р = F/ΔS= ΔP/ΔSΔt= =nm0υ2/3. Молекулы в сосуде движутся с самыми различными скоростямиυ1,υ2….υn,общее число их –N. Поэтому необходимо рассматривать среднюю квадратичную скорость, которая характеризует всю совокупность молекул: Таким образом, давление газа, оказываемое им на стенку сосуда, будет равно Приведенное выше уравнение и есть основное уравнение молекулярно-кинетической теории идеальных газов. Посколькуm0‹υкв›2/2 – это средняя энергия поступательного движения молекулы ‹ εпост›, уравнение можно переписать в виде: Следствия: 1. Учитывая, что концентрация n=N/V, получаем гдеE– суммарная кинетическая энергия поступательного движения всех молекул газа. Таким образом, давление равно двум третям энергии поступательного движения молекул, содержащихся в единице объема газа. 2. Для вывода второго следствия воспользуемся первым следствием и уравнением Менделеева-Клапейрона: 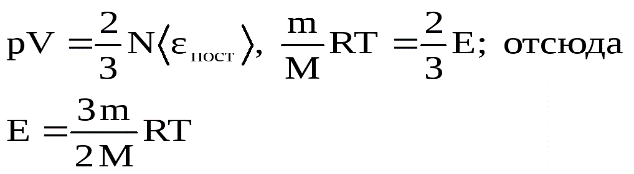 Энергия молекул Е в веществе пропорциональна количеству вещества в системе и температуре.
k=R/NAполучим: Отсюда следует, что средняя кинетическая энергия хаотического поступательного движения молекул идеального газа пропорциональна его абсолютной температуре и зависит только от нее, т.е. температура есть количественная мера энергии теплового движения молекул.При одинаковой температуре средние кинетические энергии молекул любого газа одинаковы. При Т=0К ‹εпост› = 0 и поступательное движение молекул газа прекращается, однако анализ различных процессов показывает, что Т = 0К – недостижимая температура. 4. Учитывая, что ‹εпост› = 3kT/2, р = 2n‹εпост›/3, получим отсюда: р =nkT. Мы получили уже знакомый нам вариант уравнения Менделеева-Клапейрона, выведенный в данном случае из понятий молекулярно-кинетической теории статистическим методом. Последнее уравнение означает, что при одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул. |