Контрольные вопросы к зачету Предмет физики. Связь физики с другими науками и техникой. Характеристики поступательного движения точки
 Скачать 1.81 Mb. Скачать 1.81 Mb.
|
28. 4.2 Второй закон термодинамики. Теорема КарноНаиболее часто встречающимися и, безусловно, самопроизвольными являются процессы передачи теплоты от горячего тела к холодному (теплопроводность) и перехода работы в теплоту (трение). Многовековая житейская, техническая и научная практика человечества показали повседневную реальность этих процессов, а также невозможность самопроизвольного протекания обратных процессов. Это дает основание утверждать, что единственным результатом любой совокупности процессов не может быть переход теплоты от менее нагретого тела к более нагретому (постулат Клаузиуса). Другое общее положение утверждает следующее: единственным результатом любой совокупности процессов не может быть превращение теплоты в работу или теплота наиболее холодного тела из участвующих в круговом процессе не может служить источником работы (постулат Томсона). Оба изложенных положения являются формулировками второго закона термодинамики и эквивалентны друг другу. Цикл Карно является простейшим круговым процессом, рассматривает сжатие и расширение идеального газа, дающее механическую работу. Существенным является то, что теплообмен в этом цикле совершается при двух постоянных температурах. Путем исследования цикла Карно с помощью второго закона термодинамики могут быть доказаны две важнейшие теоремы. Коэффициент полезного действия тепловой машины, работающей по циклу Карно, не зависит от природы рабочего тела машины, а лишь от температур нагревателя и холодильника. Коэффициент полезного действия тепловой машины, работающей необратимо, меньше коэффициента полезного действия машины, работающей по обратимому циклу Карно между теми же температурами. Полученные результаты являются общими для любых циклических процессов, так как любой цикл можно заменить бесконечно большим числом бесконечно малых циклов Карно, ограниченных бесконечно малыми отрезками изотерм и конечными отрезками адиабат. Таким образом, коэффициент полезного действия цикла Карно больше коэффициента полезного действия любого цикла между теми же температурами (теорема Карно). Следовательно, выражение для коэффициента полезного действия циклического процесса, записанного в виде: (где и– максимальная и минимальная температуры теплообмена рабочего тела с источником теплоты) является общим законом. ЭНТРОПИЯ Из уравнения (4.19) для коэффициента полезного действия цикла Карно следует, что Отношение Для бесконечно малого обратимого цикла Карно, очевидно: где Разность интегралов поглощенных и выделенных приведенных теплот является алгебраической суммой всех приведенных теплот по обратимому циклу: Для необратимого цикла Карно, принимая во внимание уравнение (4.25), получаем: Таким образом, сумма приведенных теплот (интеграл элементарных приведенных теплот) при переходе системы равновесным путем из состояния (1) в состояние (2) не зависит от пути процесса, а только от начального (1) и конечного (2) состояний.
дифференциал функции : Энтропия системы есть функция состояния системы: ее изменение равно сумме приведенных теплот, поглощенных системой в равновесном процессе. Энтропия является однозначной, непрерывной и конечной функцией состояния. Энтропия измеряется в тех же единицах, что и теплоемкость кал/град∙моль или кал/град∙г. Для неравновесного процесса, исходя из уравнения (4.30), получим: Полученное выражение не означает, что в результате неравновесного кругового процесса изменяется энтропия системы. Энтропия системы как функция состояния принимает первоначальное значение, и ее изменение равно нулю. Сумма же приведенных теплот, полученных системой, меньше нуля, следовательно, окружающая среда в результате цикла получает от системы некоторое количество приведенной теплоты. Из уравнения (4.31) получаем: Соответствующее неравенство может быть записано в дифференциальной форме: В том случае, если отсутствует теплообмен системы с окружающей средой Исследуя энтропию, можно предсказать направление процесса. Если в изолированной системе энтропия возрастает, то процесс возможен. Если энтропия, согласно расчету должна убывать, то процесс невозможен. При постоянстве энтропии процесс равновесен и система бесконечно близка к равновесию. В изолированной системе процессы прекратятся, когда энтропия системы достигнет максимального значения, возможного для данной системы при постоянстве некоторых ее параметров, а именно при постоянстве внутренней энергии и объема(условия изолированности системы). МЕТОДЫ РАСЧЕТА ЭНТРОПИИ Уравнение (4.31), определяющее энтропию, является единственными исходным уравнением для термодинамического расчета изменений энтропии системы, который возможен только путем подсчета приведенных теплот в равновесных процессах. Заменяя элементарную теплоту в уравнении (4.31) ее выражениями через калорические коэффициенты (4.10), получаем для равновесных процессов: Уравнения (4.34) являются полными дифференциалами энтропии как функции переменных ,или,. Коэффициенты этих уравнений – частные производные энтропии по соответствующим производным. Подставив в уравнение (4.34) значения калорических коэффициентов для моля идеального газа (уравнение состояния идеального газа) 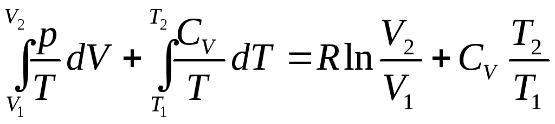 (4.35) (4.35)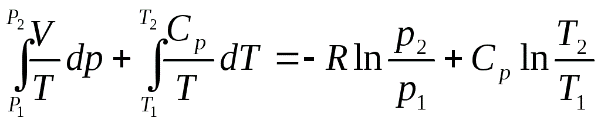 (4.36) (4.36)Фиксируя величины Обозначив символами Здесь Уравнение, используемое для идеального газа в любом интервале температур, имеет вид: где Применим полученные выше соотношения для расчетов изменения энтропии при некоторых процессах. УПРАЖНЕНИЕ 4.1 Фазовые превращения (изотермические процессы; Удельная теплота плавления бензола равна 29,92 кал/г; температура плавления = 5,50С. Следовательно изменение энтропии 1 г бензола при плавлении (энтропия плавления) равно: УПРАЖНЕНИЕ 4.2 Нагревание при постоянном давлении (изобарный процесс; Из уравнения (4.34) получаем: 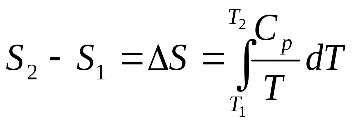 Найдем изменение энтропии 1 грамм-атома алюминия при нагревании от 25 до 6000С. Истинная атомная теплоемкость алюминия может быть выражена уравнением: По уравнению (4.39) изменение энтропии будет равно: УПРАЖНЕНИЕ 4.3 Смешение двух идеальных газов (изотермически-изобарный процесс). В смеси идеальных газов компоненты ведут себя независимо друг от друга. Поэтому энтропия равновесных смесей идеальных газов является аддитивной функцией состава. При смешении двух газов в количестве имолей при постоянной температуреи общем давлениикаждый газ изменяет свой объем от первоначального до объема смеси, равного сумме объемов газа. Изменение энтропии при смешении является суммой изменений энтропий каждого газа при его изотермическом расширении. В соответствии с уравнением (4.35) это изменение равно: Рассчитаем изменение энтропии, происходящее при смешении двух молей азота и одного моля водорода (значение температуры и суммарного давления безразличны для расчета). Так как объемы азота, водорода и смеси находятся в отношениях |

