Курс лекций по биоорганической химии. Курс лекций по биоорганической химии учебное пособие для студентов 1 курса очного обучения
 Скачать 4.37 Mb. Скачать 4.37 Mb.
|
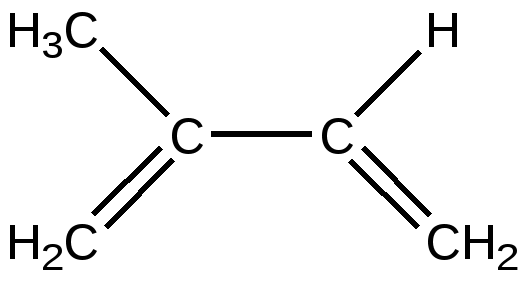
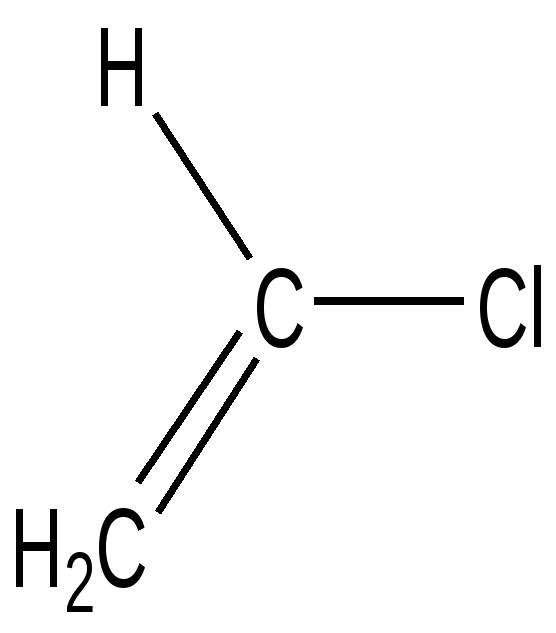
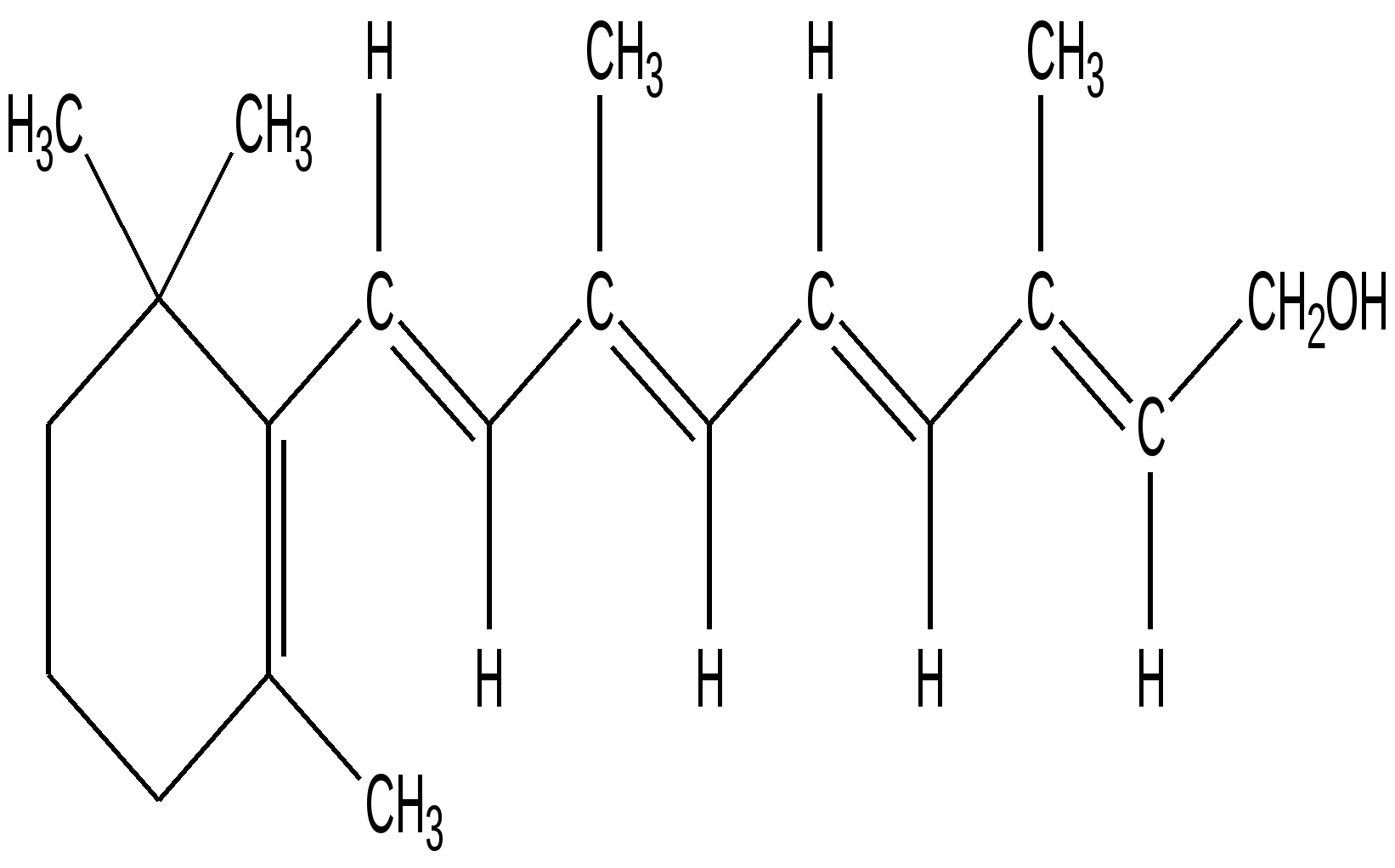
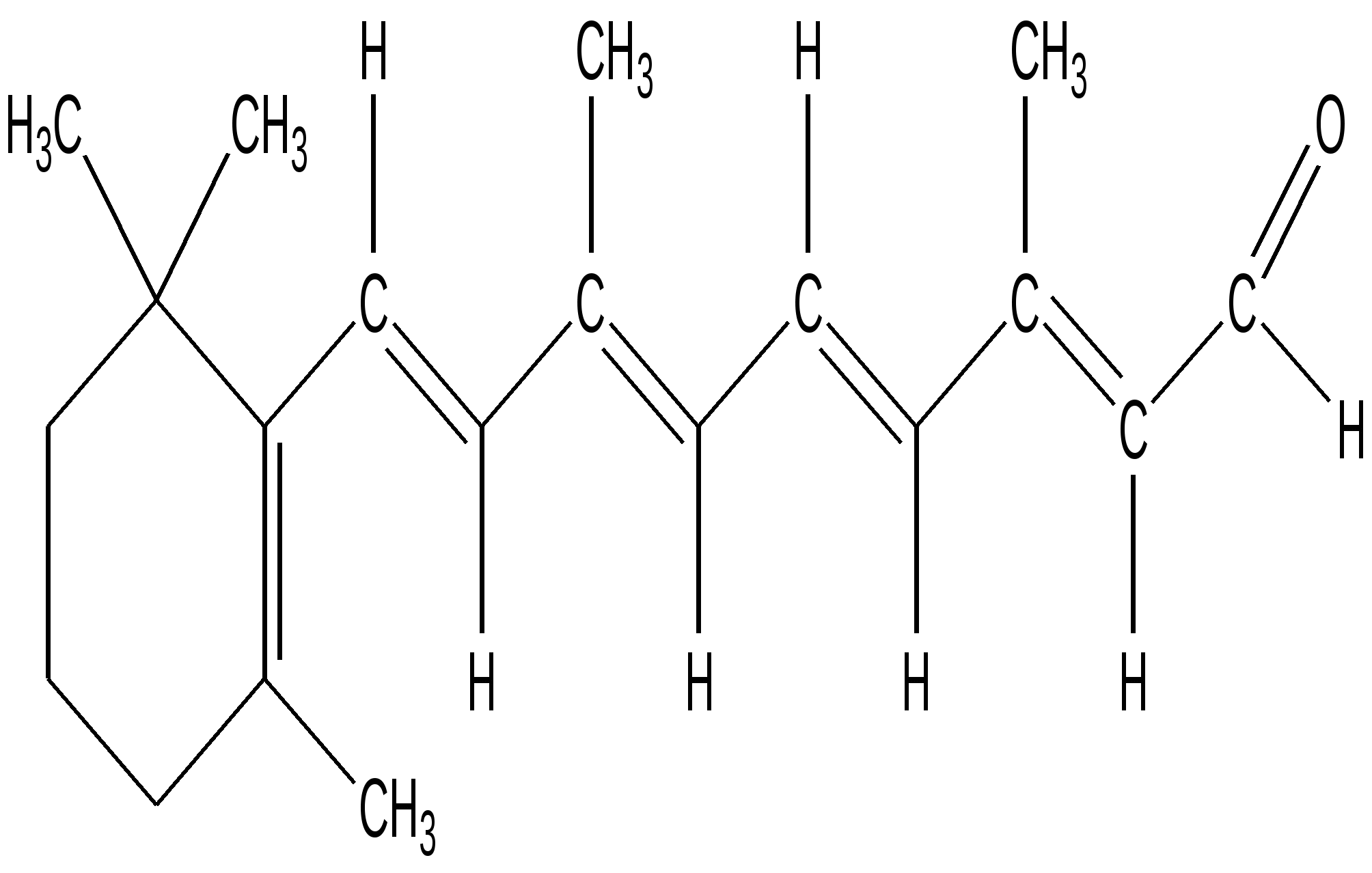
Ковалентные связи могут быть двух типов: сигма ( σ) и пи ( π ).В органических молекулах сигма (σ) связи образованы электронами, расположенными на гибридных( гибридизованных) орбиталях, электронная плотность располагается между атомами на условной линии их связывания.π -Связи ( пи -связи) возникают при перекрывании двух негибридизованных р-орбиталей. Главные оси их располагаются параллельно друг другу и перпендикулярны линии σ -связи. Сочетание σ и π --связей носит название двойная( кратная) связь, состоит из двух пар электронов. Тройная связь состоит из трех пар электронов- одна σ - и две π -связи.( в биоорганических соединениях встречается крайне редко).σ -Связи участвуют в образовании скелета молекулы, они являются главными , а π -связи можно рассматривать как дополнительные, но придающие молекулам особые химические свойства. 1.2. Гибридизация орбиталей атома углерода 6 С Электронная конфигурация невозбужденного состояния атома углерода выражается распределением электронов 1s 2 2s2 2p2 . --↑- --↑-- --- C --↑↓- 2 s 2p Однако в биоорганических соединениях, как впрочем, и в большинстве неорганических веществ, атом углерода имеет валентность равную четырем. Происходит переход одного из 2s электронов на свободную 2р орбиталь. Возникают возбужденные состояния атома углерода, создающие возможность образования трех гибридных состояний, обозначаемых как С sp3 , С sp2 , С sp . Гибридная орбиталь имеет характеристики, отличные от «чистых» s, p, d- орбиталей и является « смесью» двух или более типов негибридизованных орбиталей. Гибридные орбитали свойственны атомам только в молекулах. Понятие гибридизации введено в 1931г Л.Полингом , лауреатом Нобелевской премии,. Рассмотрим расположение в пространстве гибридных орбиталей. С s p3 -↑-- -↑- -↑- --↑- В возбужденном состоянии образуются 4 равноценные гибридные орбитали. Расположение связей соответствует направлению центральных углов правильного тетраэдра, величина угла между двумя любыми связями равна 109 0 28 ,. В алканах и их производных ( спирты, галогеналканы, амины) все атомы углерода, кислорода, азота находятся в одинаковом гибридном sp3 cостоянии. Атом углерода образует четыре, атом азота три, атом кислорода две ковалентные σ -связи. Вокруг этих связей возможно свободное вращение частей молекулы относительно друг друга. В возбужденном состоянии sp2 возникает три равноценные гибридные орбитали, расположенные на них электроны образуют три σ -связи , которые располагаются в одной плоскости, угол между связями 1200. Негибридизованные 2р - орбитали двух соседних атомов образуют π -связь. Она располагается перпендикулярно плоскости, в которой находятся σ -связи. Взаимодействие р-электронов носит в этом случае название « бокового перекрывания». Кратная связь не допускает вокруг себя свободного вращения частей молекулы. Фиксированное положение частей молекулы сопровождается образованием двух геометрических плоскостных изомерных форм, которые носят название : цис( cis ) – и транс(trans )- изомеры. ( цис-лат- по одну сторону, транс- лат- через). 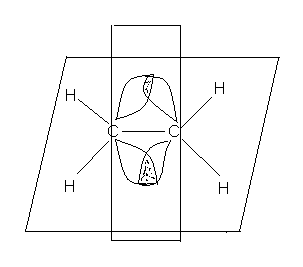 π -связь Атомы, связанные двойной связью, находятся в состоянии гибридизации sp2 и присутствуют в алкенах, ароматических соединениях, образуют карбонильную группу >С=О, азометиновую группу ( имино группу) -СН= N- -↑-- С sp2 - -↑-- -↑- -↑-- Структурная формула органического соединения изображается с помощью структур Льюиса ( каждая пара электронов между атомами заменяется черточкой) С2 Н6 СН3 - СН3 H H | | H - С - С - H | | H H 1.3. Поляризация ковалентных связей Ковалентная полярная связь характеризуется неравномерным распределением электронной плотности. Для обозначения направления смещения электронной плотности используют два условных изображения. Полярная σ – связь. Смещение электронной плотности обозначают стрелкой вдоль линии связи. Конец стрелки направлен в сторону более электроотрицательного атома. Появление частичных положительных и отрицательных зарядов указывают с помощью буквы « б» « дельта» с нужным знаком заряда. б + б- б+ б + б- б + б- СН3 — > О<— Н СН3 — > С1 СН3 — > NН2 метанол хлорметан аминометан ( метиламин) Полярная π -связь. Смещение электронной плотности обозначают полукруглой ( выгнутой) стрелкой над пи-связью также направленной в сторону более электроотрицательного атома. ( б + Н 2 С = О СН3— С ===О метаналь | СН3 пропанон -2 Для проверки усвоения раздела рекомендуем ответить на вопросы: 1.Определите тип гибридизации атомов углерода, кислорода , азота в соединениях А, Б, В . Назовите соединения , используя правила номенклатуры IUPAC . А. СН3-СН2- СН2-ОН Б. СН2 = СН – СН2- СН=О В. СН3- N Н– С2 Н5 2. Сделайте обозначения, характеризующие направление поляризации всех указанных связей в соединениях ( А – Г ) А. СН3 – Вr Б. С2 Н5– О- Н В. СН3-NН- С2 Н5 Г. С 2 Н5 – СН= О 2. СОПРЯЖЕННЫЕ СИСТЕМЫ Ключевые слова Делокализация. Неподеленная пара электронов. Сопряжение( конъюгация) Сопряженная система. Цепь сопряжения. Энергия сопряжения. 2.1. Общие понятия о строении сопряженных систем Среди природных биоорганических веществ большое место занимают соединения, которые относят к сопряженным системам. Сопряженными( конъюгированными) называют кратные связи( двойные или тройные), разделенные одинарной связью. ..-С=С-С=С-С=С-С=С-… |_______________| цепь сопряжения Чередующиеся кратные и простые связи образуют цепь сопряжения Различают два вида сопряженных систем : ациклические ( цепь сопряжения разомкнута) циклические ( цепь сопряжения замкнута). Атомы, присутствующие в цепи сопряжения, находятся в гибридном состоянии sp2 , sp или содержат неподеленные пары электронов( эти атомы тоже приобретают тип гибридизации sp2 ) Такими атомами могут быть атомы азота, кислорода, серы, галогенов. Неподеленная пара электронов- это пара валентных( находится на внешнем энергетическом уровне) электронов, не участвует в обра зовании связи между двумя атомами. К ним относятся атомы –О- , - N -, - S -, - F - Cl . Неподеленные пары электронов элементов второго периода( азот, кислород, фтор) не могут быть распарены, поскольку в атоме нет свободных орбиталей. Их условно обозначают двумя точками над символом элемента. Распределение электронов на внешнем энергетическом уровне атомов азота и кислорода в невозбужденном состоянии представлено на диаграммах: -↑- -↑-- - ↑- (одна неподеленная пара) N 1s2 2s2 2p3 -↑↓- на внешнем уровне --↑↓-- --↑-- --↑-- ( две неподеленные пары) О 1s2 2s2 2p4 -↑↓- . Распределение электронов на внешнем энергетическом уровне атома азота в возбужденном состоянии N sp2 возможно в двух вариантах. ---↑↓--- --↑-- N sp2 -↑-- --↑-- ---↑-- N sp2 --↑↓-- --↑-- --↑--- «пиррольный» атом азота «пиридиновый» атом азота В следующем разделе мы еще будем обсуждать распределение электронов на орбиталях атома азота в ароматических гетероциклических соединениях. Если в цепи сопряжения находятся только атомы в sp2- гибридном состоянии, то такой вид сопряжения называется – π - π - сопряжение. Если присутствуют дополнительно гетероатомы( азот, кислород ), то обозначают как π -р – сопряжение. CН2 =СН-СН=СН- СН=СН2 СН 2=СН-О-СН=СН2 π - π -сопряжение π -р- сопряжение К ациклическим молекулам с сопряженными связями относятся : * Бутадиен-1,3 , метилбутадиен-1,3( изопрен), который является мономером природного каучука, хлорвинил, который применяют для получения полимера полихлорвинила. В результате включения в сопряженную систему атом хлора малоподвижен, хлорвинил при попадании в организм накапливается, не подвергаясь обезвреживанию. Обнаружено, что он провоцирует развитие рака печени. * Каротиноиды- каротин( пигмент моркови и красного перца), витамин А формах ретинола и ретиналя, ликопин( пигмент помидора). Все они относятся к классу природных веществ терпеноидов. Имеют окраску от желтого до красного цветов, что связано с наличием длинной цепи сопряжения. Каротиноиды хорошо растворимы в жирах, их называют липохромами ; накапливаясь в подкожно-жировой клетчатке при избыточном поступлении в организм, придают коже оранжево- желтый оттенок. Каротиноиды относятся к биологически активным веществам- витаминам Витамин А участвует в акте фоторецепции, обладает антиоксидантным действием, используется как лекарственный препарат. * Биологически активные карбоновые кислоты, занимающие видное место в процессе обмена веществ: пировиноградная , фумаровая, кротоновая.
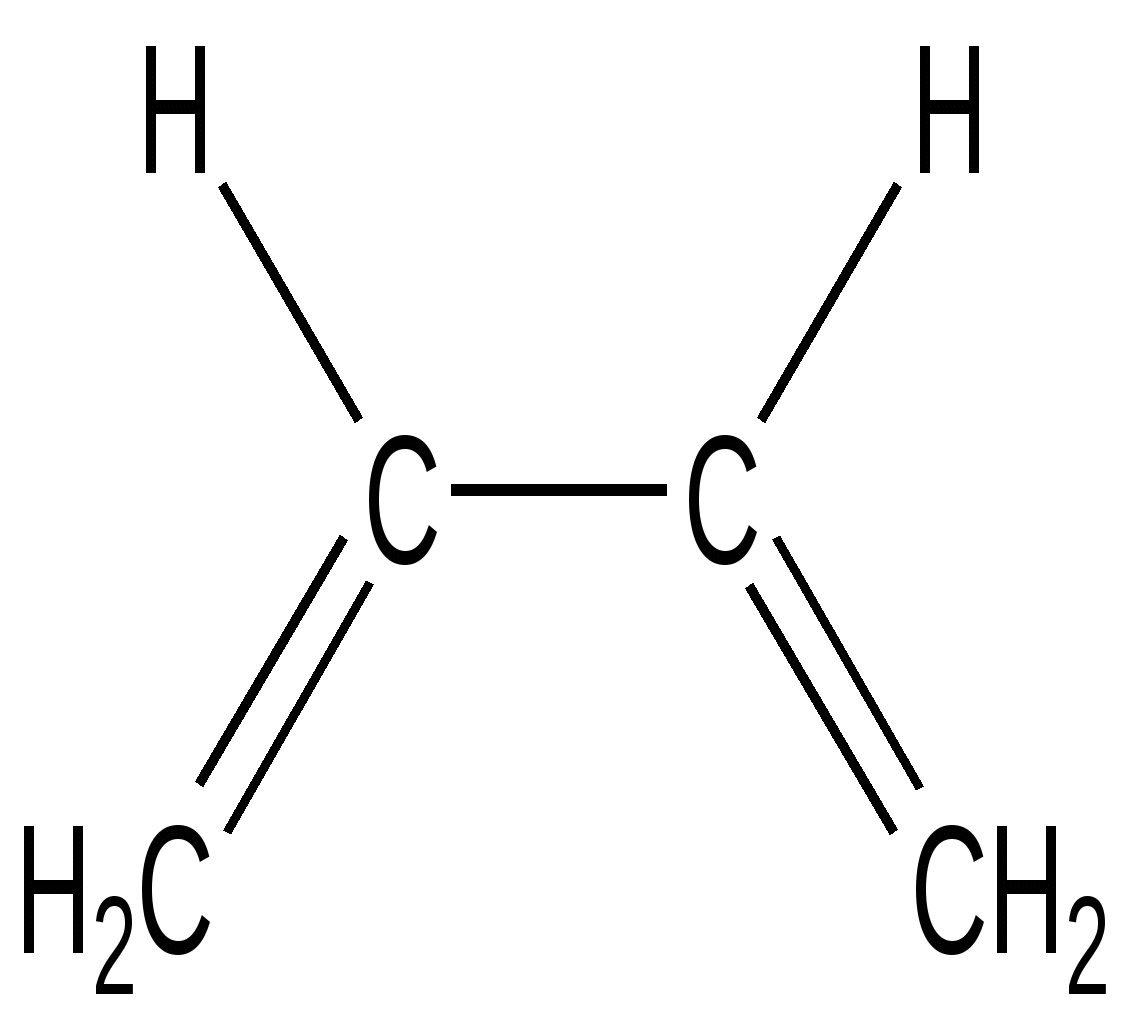
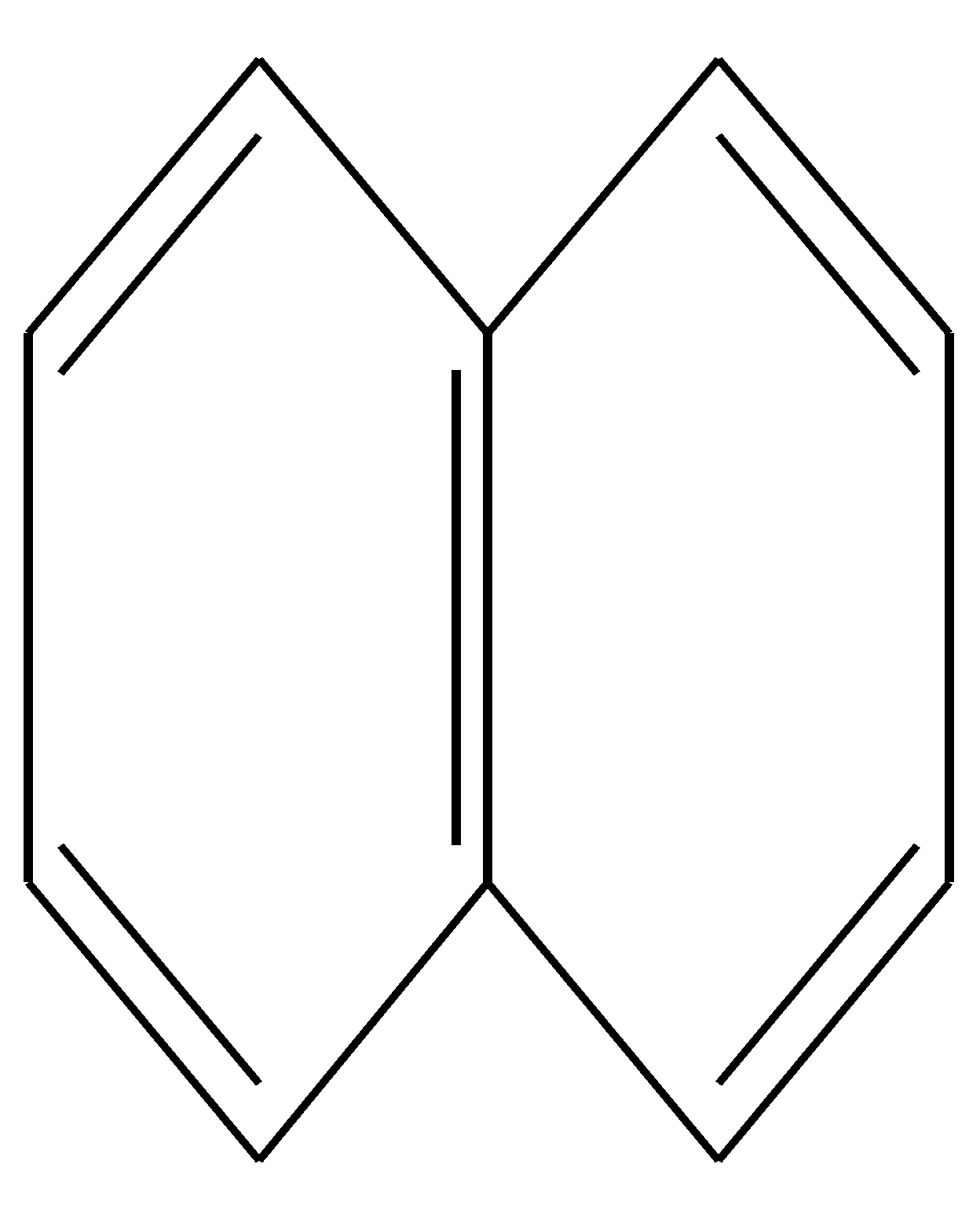
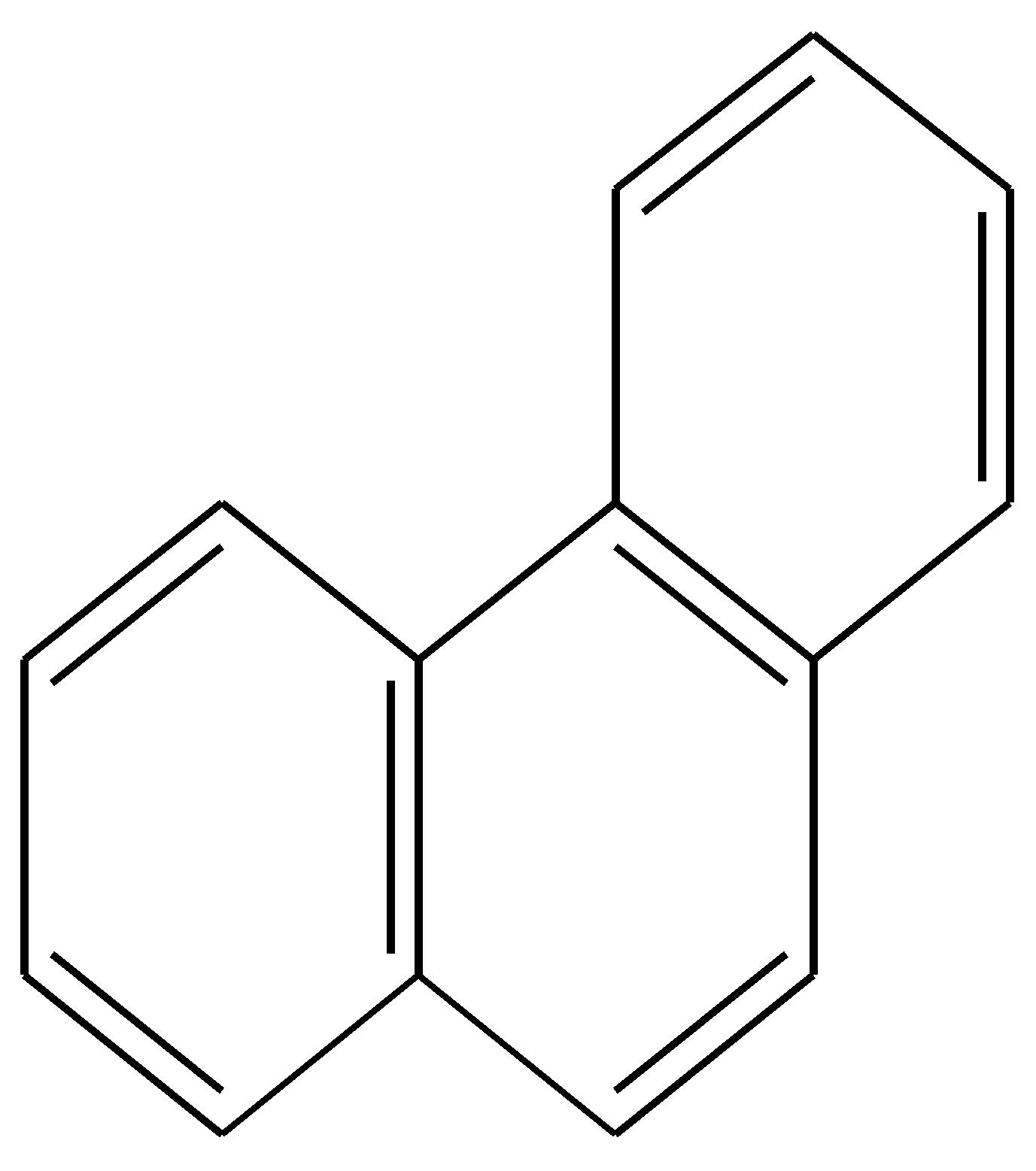
Бутадиен-1,3 представляет собой простейшую π - π -сопряженную систему. Все четыре атома углерода находятся в sp2-гибридном состоянии( формула А ) 1 2 3 4 …… ………….. СН2=СН-СН=СН2 бутадиен-1,3 СН2-СН- СН-СН2 ( А ) ( Б ) На участке сопряжения возможно взаимодействие негибридных р-электронов. Возникает делокализованная связь( условно обозначена. пунктирной линией над участком сопряжения, формула Б). Делокализованная связь-это ковалентная связь , в которой π –электронная плотность не локализована между двумя соседними р-орбиталями, а распределяется по всей π -орбитальной системе. Только сопряжение создает возможность делокализации. Какие имеются доказательства существования делокализованной системы в бутадиене? 1.Изменяется длина связей и геометрия молекулы. Связи С1-С2 и С3-С4 становятся длиннее по сравнению с двойной связью в этене, а связь С2-С3 короче по сравнению с одинарной связью этана. Делокализация всегда сопровождается стремлением к выравниванию длин связей на участке сопряжения. Атомы на участке сопряжения располагаются в одной плоскости. 2.Реальная теплота гидрирования( присоединение водорода) меньше по сравнению с расчетной. Это означает, что энергия соединения меньше теоретически расчетной. Выигрыш в энергии, получаемый в результате сопряжения, называется энергией сопряжения. 3.Изменяются химические свойства бутадиена-1,3. Возникает возможность присоединения брома в условиях ионной реакции в растворе при температуре 400 С по краям сопряженной цепи ( присоединение по правилу 1,4 к бутадиену 1,3). СН2=СН-СН=СН2 + Br 2 —> СН2 Bг-CH=CH-CH 2Br 1,4- дибромбутен-2 2 . 3 . Циклические сопряженные системы. Ароматичность Ключевые слова Ароматическое соединение. Ароматичность. Ароматический секстет. Гетероциклическое соединение. Карбоциклическое соединение. Пиримидиновый атом азота. Пиррольный атом азота. Правило Хюккеля. Циклическая сопряженная система. Циклы π –избыточные, π –недостаточные (дефицитные). Энергия делокализации( энергия резонанса). Формулы соединений : антрацен, бензол, имидазол, нафталин, пиридин, пиримидин, пиррол, пурин, тиофен, фуран. Различают два вида циклических сопряженных систем : А) карбоциклические Б) гетероциклические Карбоциклические – скелет молекулы образован только атомами углерода, возникает π - π - сопряжение. Гетероциклические - скелет молекулы образован атомами углерода и гетероатомами( азот, кислород, сера), возникают два вида взаимодействия:: π , π и π , р- сопряжение. Примером карбоциклического соединения с замкнутой сопряженной системой связей может служить циклооктатетраен-1,3,5,7 ( предлагаем самим написать структурную формулу) Особое место среди циклических сопряженных соединений занимают так называемые ароматические . В 1825 г М. Фарадей выделил из охлажденного природного газа пахучее вещество состава С 6Н 6. В 1833 г. Э. Мичерлих синтезировал бензол в результате реакции декарбоксилирования при сплавлении бензоата натрия с твердым гидроксидом натрия. В 1865г. английский химик Кекуле предложил его структурную формулу. Эту структурную формулу бензола мы используем в настоящее время: шестичленный цикл с тремя чередующимися двойными связями. При изучении химических свойств бензола были обнаружены особенности, которые не могла объяснить формула Кекуле. По мнению Кеккуле – бензол - ненасыщенная циклическая система , содержит три чередующиеся двойные связи . Особые химические свойства бензола: 1. устойчивость к действию окислителя перманганата калия в растворе. 2. устойчивость, несмотря на высокую степень ненасыщенности, к действию раствора брома ( в воде или тетрахлорметане), что означало неспособность к реакциям присоединения в условиях, типичных для алкенов и полиенов. 3. способность к реакциям замещения в растворе по ионному( катионному, электрофильному) механизму Этот набор химических свойств стали называть ароматическими свойствами, а вещества, обладающими этими свойствами- ароматическими. Название возникло благодаря запаху бензальдегида , эфиров бензойной кислоты. которые содержатся в пахучих маслах и бальзамах. ( на самом деле, запах бензола не столь приятный, «ароматичный») 2.3.1. Современные представления о строении бензола Рентгеноструктурный анализ кристаллов бензола обнаружил, что молекула бензола • имеет плоское ( планарное) строение • правильный шестичленный цикл |• углы между всеми связями равны 120 • длина всех связей С-С одинаковая , равна 1,39А и имеет среднее значение между длиной одинарной связи 1,54А и длиной двойной связи 1,34 . Эти научные данные следует объяснить образованием общей электронной системы, состоящей из 6 электронов (ароматический секстет ) . Электронная плотность равномерно распределена между атомами углерода, которые находятся в sp2-гибридном состоянии. Максимум электронной плотности негибридизованных р-орбиталей находится над и под плоскостью бензольного кольца. -скелет лежит в плоскости рZ-АО (Sp2) располагаются перпендикулярно этой плоскости и параллельно друг другу, образуя единое делокализованное электронное облако из 6 электронов, максимум электронной плотности р-электронов располагается над и под плоскость -скелета. Образование общей π-электронной системы в бензоле относится к явлению делокализации. Устойчивость бензола за счет делокализации электронов повышается на 36,6 ккал\моль( 150 кдж\моль). Эта величина носит название - энергия делокализации ( энергия резонанса) . Возникает повышенная термодинамическая устойчивость. Повышенной термодинамической устойчивостью , а следовательно, и ароматическими свойствами обладают только те циклические соединения, которые имеют : • плоское строение • сопряженную систему связей •число π -электронов в сопряженной системе N(π ) = 4n+2 , где n-целое число 1,2,3.4 и т.д., получаются значения N= 6, 10, 14, 18 и т. д. Формула N(π ) = 4n+2 носит название « правило Хюккеля». Ароматические свойства сохраняют гомологи и производные бензола, содержащие один или несколько заместителей в бензольном кольце. Правило Хюккеля применимо и для полиядерных углеводородов с конденсированными циклами. К ним следует отнести нафталин ( 10 π -электронов, 5 двойных связей) , изомеры фенантрен и антрацен ( 14 π -электронов, 7 двойных связей). В отличие от бензола в этих циклах нет равномерного распределения электронной плотности.
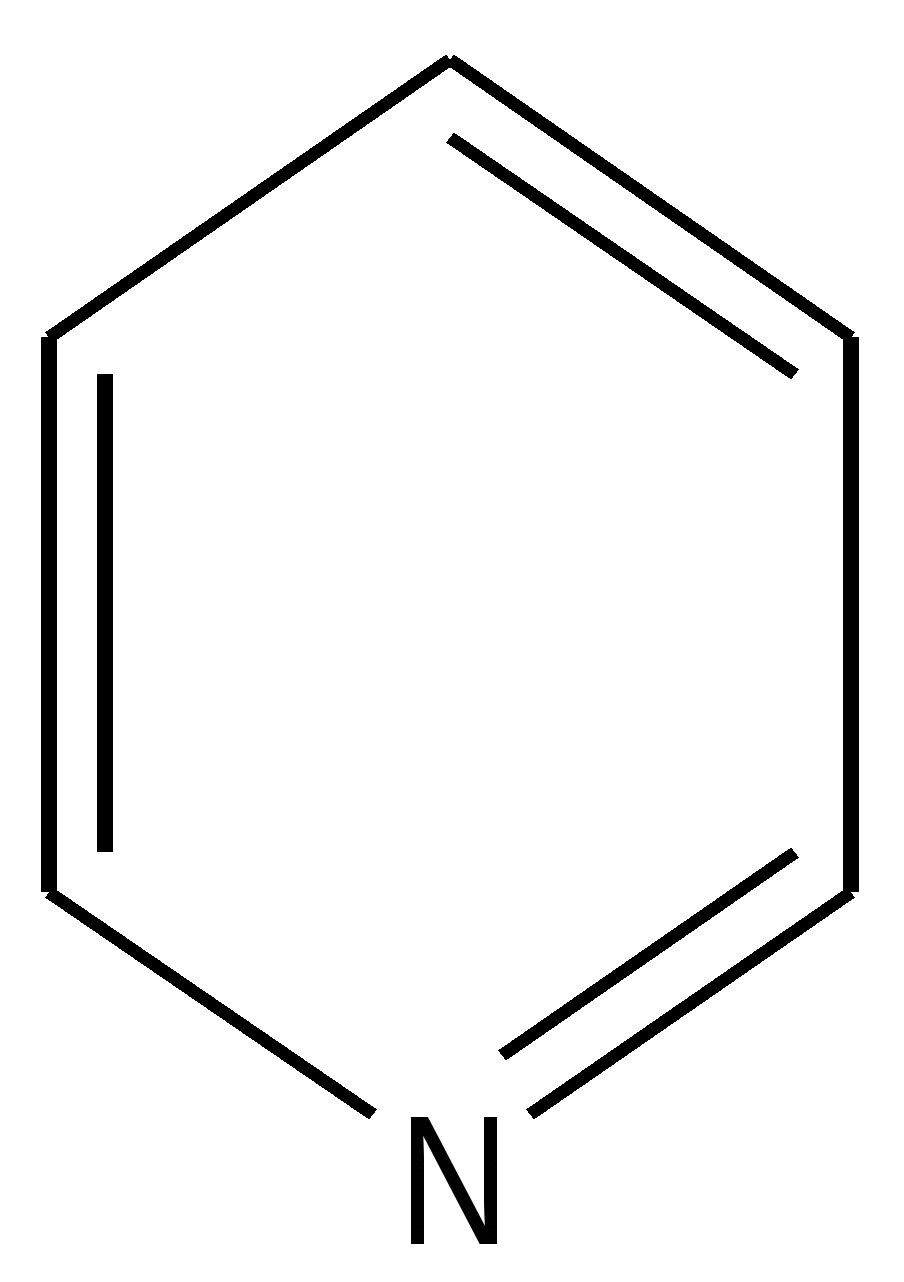
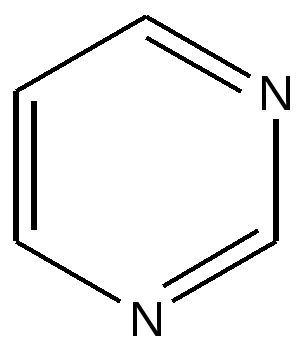
2. 3. 2. Медико-биологическое значение карбоциклических ароматических соединений Бензольные циклы присутствуют в природных биоактивных соединениях. К ним следует отнести аминокислоты фенилаланин, тирозин Производные аминокислоты тирозина- гормон адреналин, гормон и нейромедиатор норадреналин , гормон щитовидной железы тироксин, медиатор дофамин. Ароматическая бензольная система присутствует в женских половых гормонах эстрогенах, в то время как структурно им близкие мужские половые гормоны андрогены эту систему не содержат. На основе ароматических соединений получено множество лекарств. К производным бензола следует отнести сульфаниламидные препараты, обезболивающие ( новокаин, анестезин и их аналоги), аспирин и многие другие. Цикл нафталина содержится в витамине К и его синтетическом препарате викасоле. Викасол останавливает кишечные кровотечения , витамин К участвует в образовании факторов свертывающей системы крови и необходим для правильного формирования минерализованных тканей костей и зубов. Устойчивость бензольной системы к действию окислителей замедляет метаболизм бензола и его производных в организме. Отмечено накопление ароматических соединений в тканях с высоким содержанием липидов ( кроветворные органы, подкожно-жировая клетчатка, легкие), задержка в печени, где происходит основное разрушение этих веществ. Бензол избирательно накапливается в эндометрии матки и может оказывать тератогенное действие, вызывая появление уродств при развития плода. Женщинам-химикам в детородном возрасте не рекомендуется работать с бензолом. Высокая токсичность многоядерных конденсированных ароматических соединений связывают с тем, что продукты их метаболизма обладают канцерогенной активностью. Многоядерные ароматические соединения легче и быстрее метаболизируют ( изменяются) в организме, поскольку в них наблюдается неравномерное распределение электронной плотности, и они легче поддаются реакциям окисления, которые лежат в основе детоксикации чужеродных для организма соединений ( ксенобиотиков). Процессы обезвреживания происходят в печени, почках, легких, коже и других тканях и органах с участием особого фермента цитохрома р-450. Длительная работа с ароматическими углеводородами без соблюдения надлежащих правил техники безопасности сопровождается хроническим отравлением организма и развитием у химиков профессиональной болезни. 2. 3. 3. Гетероциклические ароматические соединения Наиболее важные биоорганические соединения, встречающиеся в составе нуклеиновых кислот, витаминов, аминокислот, белков , содержат пятичленные и шестичленные циклы. В составе этих циклов присутствуют атомы азота, кислорода, серы, что и обусловило их название- гетероциклы ( гетер- греч- разный, другой) Шестичленные ароматические гетероциклы Шестичленные природные гетероциклические ароматические соединения содержат один или несколько атомов азота. В пиридине присутствует один атом азота, а в пиримидине два атома в положении 1,3 относительно друг друга.
|