Курс лекций по биоорганической химии. Курс лекций по биоорганической химии учебное пособие для студентов 1 курса очного обучения
 Скачать 4.37 Mb. Скачать 4.37 Mb.
|
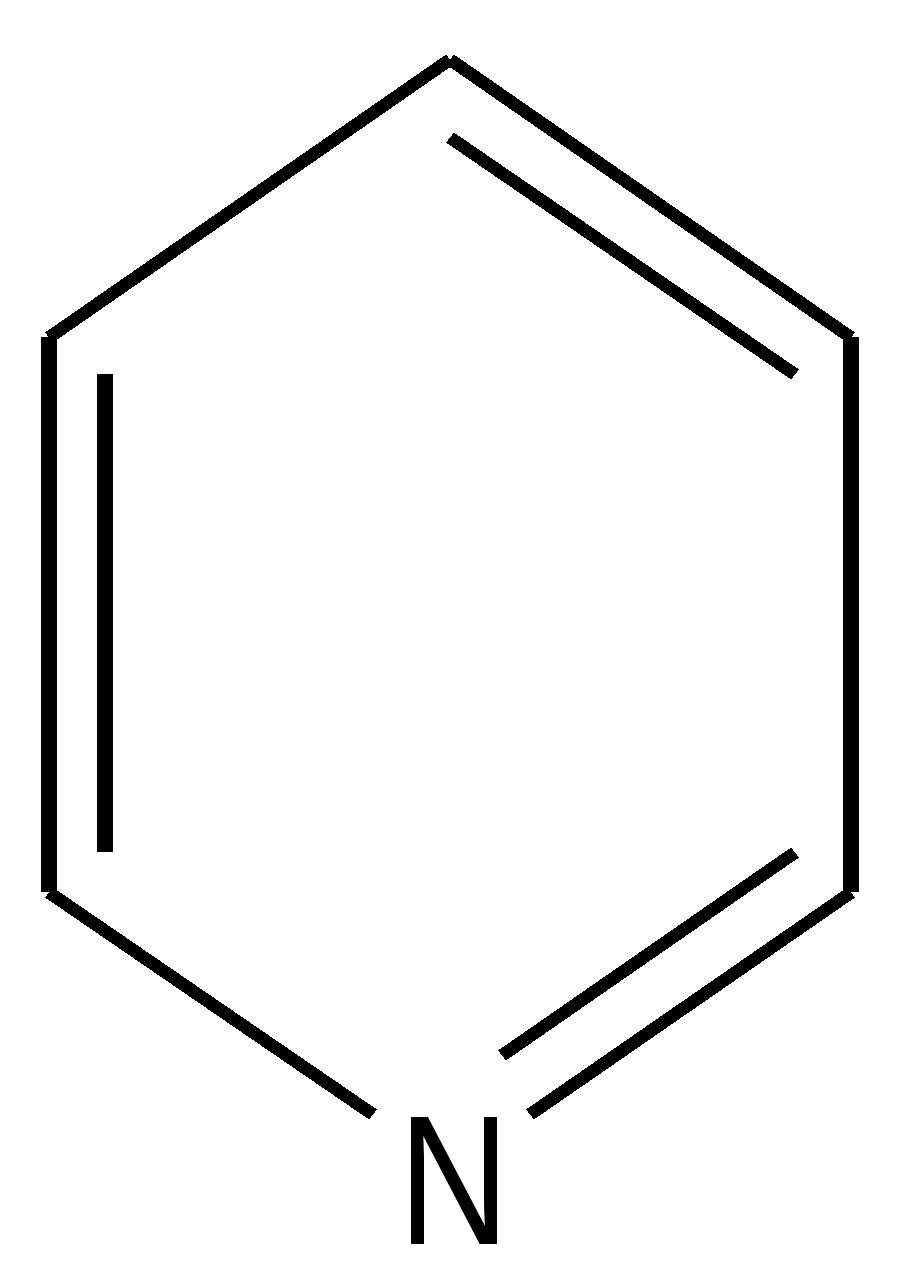
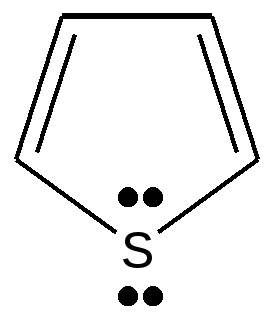
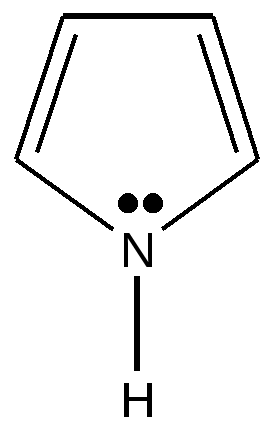
Все атомы, формирующие цикл, находятся в sp 2- гибридном состоянии. Неподеленная пара электронов гетероатома участвует в образовании ароматического секстета: каждый атом углерода отдает по одному р-электрону, а гетероатом- неподеленную пару электронов, которая находится на негибридизованной р-орбитали. Распределение электронов(электронная конфигурация) атома азота в пятичленном гетероцикле пирроле изображено на диаграмме: --↑↓--- N sp2 --↑-- --↑-- --↑---- 2 электрона поступают в общую π - систему 3 электрона σ -связей пиррольный атом азота Имеется доказательство включения пары электронов гетероатома в ароматический секстет : пиррол не проявляет основных свойств, в обычных условиях не взаимодействует с кислотами и не образует солей. Применяют два термина для обозначения атомов азота в составе ароматического гетероциклического соединения : пиридиновый атом азота и пиррольный атом азота. Пиридиновый – обладает основными свойствами, пиррольный – не обладает, т.к. вкладывает свою пару электронов в образование ароматической системы. Для примера можно привести соединение имидазол, который содержит оба вида атомов азота. пиридиновый атом азота 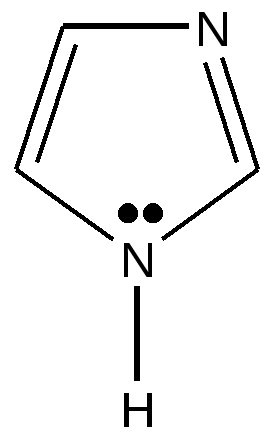 пиррольный атом азота пиррольный атом азота имидазол Ароматические свойства пятичленных гетероциклических соединений выражены достаточно в сравнении с бензолом : у тиофена реакции ионного замещения проходят легче, при более низкой температуре. Возможно такое объяснение этому явлению : ароматический секстет распределен между пятью атомами цикла, на каждом атоме электронная плотность выше по сравнению с бензолом ( 6\5 и 6\6 соответственно). Пиррол, фуран, тиофен относятся к «π -избыточным циклам». Ароматические свойства пятичленных гетероциклических соединений зависят от величины электроотрицательности гетероатома. Чем больше величина электроотрицательности, тем труднее гетероатом отдает свою неподеленную пару электронов в общую систему. Известно, что электроотрицательность изменяется в ряду О > N > S и ароматические свойства убывают в ряду : тиофен > пиррол > фуран
Изученные соединения имеют огромное значение в понимании многих биохимических процессов, на их основе синтезированы сотни лекарственных препаратов. Пиридин. Его производными являются никотиновая кислота, никотинамид ( витамин РР), который входит в состав переносчика электронов кофермента NAD+ , витамина В6, регулирующего обмен аминокислот и синтез гликогена . На основе пиридина получены противотуберкулезные препараты ( изониазид) Пиримидин. Три главных производных его- урацил, тимин и цитозин- входят в состав нуклеиновых кислот и носят название « азотистые основания» нуклеиновых кислот. Пиррол. В составе сложной четырехпиррольной ароматической порфириновой системы , включающей в себя ионы металлов, образует гем( содержит ионы железа и меди) и хлорофилл( содержит ион магния). Сопряженная система гема содержит 30 π -электронов. ( Проверьте сами на соответствие правилу Хюккеля) Пурин -конденсированное соединение, содержащее два цикла- имидазол и пиримидин, его производные аденин и гуанин входят в состав нуклеиновых кислот и АТФ- основное макроэргическое соединение организма содержит вещество аденин. 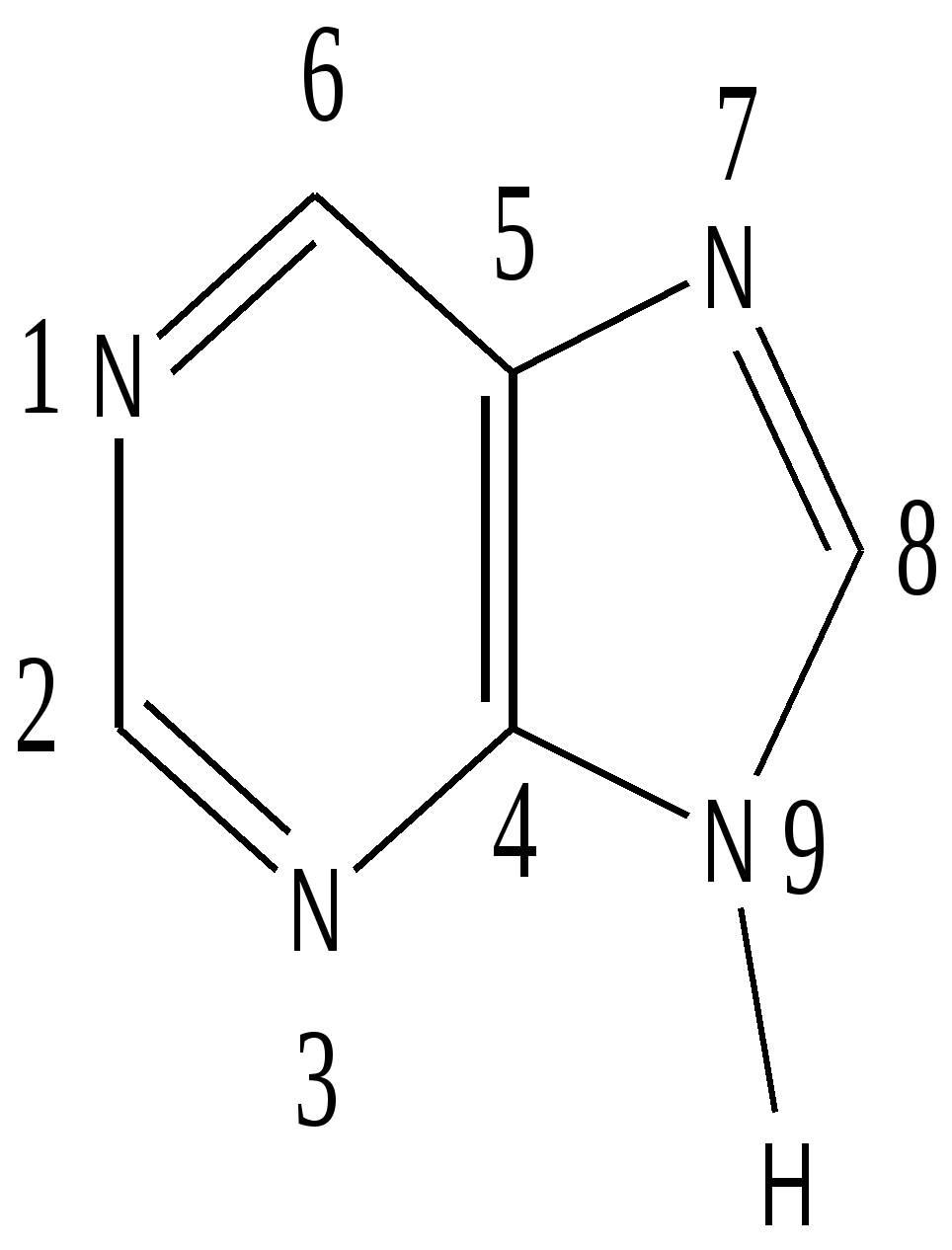 Пурин и пиримидин и их производные нашли широкое применение в производстве противоопухолевых. противовирусных, сульфаниламидных и других лекарственных препаратов( меркаптопурин, фторурацил, метилурацил, кофеин) Для проверки усвоения раздела рекомендуем ответить на вопросы: . 1.Укажите число π -электронов в сопряженной системе циклооктатетраена-1,3,5,7. Варианты ответа а. 4 б. 6. в. 7. г. 8 д. 10. е. 12. 2.Несколько циклических соединений имеют плоское строение, сопряженная система связей .Число π –электронов в этих соединениях может быть ( несколько ответов): а. 14 б 12. в 10 г. 8 д. 6 е. 4 Какие из них являются ароматическими.? 3.Три соединения- пиррол, пиридин, тиофен. Расположите их в ряд в соответствии с увеличением ароматичности. 4.Три соединения- пиридин, бензол, пиримидин. Расположите их в ряд в соответствии с уменьшением ароматичности. 5.Составьте ряд из соединений в соответствии с увеличением ароматических свойств : пиридин, тиофен, пиримидин, фуран. 6. Изучите формулу пурина. Запомните порядок нумерации атомов в обоих циклах. Определите, какой атом не проявляет основные свойства? Варианты ответа : а. N1 б. N3 в. N7 г. N9 . ЛЕКЦИЯ 2 ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛАХ БИООРГАНИЧЕСКИХ СОЕДИЕНИЙ. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ. КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА БИООРГАНИЧЕСКИХ МОЛЕКУЛ Содержание лекции.
2.1.1. Электронные эффекты заместителей. Индуктивный и мезомерный эффект. Донорные и акцепторные группы-заместители. 2.1.2. Распределение электронной плотности в биоорганических молекулах. 2.2. Кислотно-основные свойства органических соединений. 2.2.1. Теория Бренстеда-Лоури. Определения « кислоты и основания» в соответствии с теорией Бренстеда-Лоури. 2.2.2. Биоорганические соединения- кислоты. Влияние типа кислотного центра и заместителей кислотные свойства. 2.2.3. Биоорганические соединения- основания. . Влияние типа основного центра и заместителей основные свойства. свойства
Исходный уровень знаний для усвоения темы Гибридизация орбиталей и пространственная ориентация орбиталей элементов 2 периода., виды химических связей, особенности образования ковалентных σ- и π –связей, полярные и неполярные ковалентные связи, изменение электроотрицательности элементов в периоде и группе, функциональные группы, сопряженные системы, делокализация . 2.1. Взаимное влияние атомов в молекулах биоорганических соединений. Электронные эффекты заместителей Ключевые слова к разделу 2.1. Заместитель донорный, акцепторный, электроотрицательность, распределение электронной плотности в молекуле биоорганического соединения, эффект индуктивный, мезомерный Смещение электронной плотности в биоорганических соединениях связано с различной электроотрицательностью атомов. Электронная плотность смещается всегда в сторону более электроотрицательного атома. Ряд электроотрицательности: F > O > N > C1 > Br > I S > C > H Функциональные группы, смещающие электронную плотность в свою сторону, являются акцепторами, а группы, «отталкивающие» от себя электронную плотность- донорами. Для демонстрации этих явлений составляют диаграммы распределения электронной плотности, которые помогают понять направление органической реакции и объяснить , почему они именно так протекают, а не иначе. На основании распределения электронной плотности можно высказать предположение о механизме реакции и строении образующихся веществ. Смещение электронной плотности вдоль σ –связей носит название индуктивного эффекта Атомы или функциональные группы, «отталкивающие» от себя электронную плотность, проявляют положительный ( +I ) а смещающие в свою сторону – отрицательный (- I ) эффекты. Индуктивный эффект обозначают стрелкой вдоль связи, которая направлена от атома с частичным положительным зарядом (б + ) в сторону того атома, на котором возникает избыточный отрицательный заряд ( частичный заряд б- ) Индуктивный эффект распространяется на соседние 2-3 атома по отношению к группе, вызывающей этот эффект, и по мере удаления от группы убывает. Пример: Распределение электронной плотности в молекуле бутановой кислоты. б + б + б + СН3 —> СН2 —> СН2—>СН2 —>СООН <—————— заряд б + убывает по направлению стрелки Смещение электронной плотности в системе сопряженных связей носит название мезомерного эффекта ( М-эффект). Мезомерный эффект охватывает всю ациклическую сопряженную систему, частичные заряды возникают на крайних атомах в сопряженной системе, а в бензольном кольце – изменение электронной плотности происходит в положениях 2,4,6 ( по отношению к группе, проявляющей эффект). Атомы галогенов, гидрокси- и аминогруппы содержат неподеленные пары электронов, которые смещаются в сторону π -связи, образуя общую сопряженную систему. Они проявляют +М-эффект. Карбоксильная, карбонильная, нитро-группы обладают –М-эффектом, и они смещают π-электронную плотность в свою сторону. Примеры: пропеновая (акриловая) кислота б+ СН2 == СН— С ==О \ ОН Хлорвинил (хлорэтен) б+ С1 —СН ==СН2 Если в ароматической системе бензола присутствует заместитель – донор, то возникает частичный( избыточный) заряд δ- в положениях 2,4,6 Донорными группами. Проявляющими положительный мезомерный эффект, следует считать гидрокси, амино группы, атомы галогенов фтора и хлора. 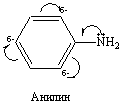  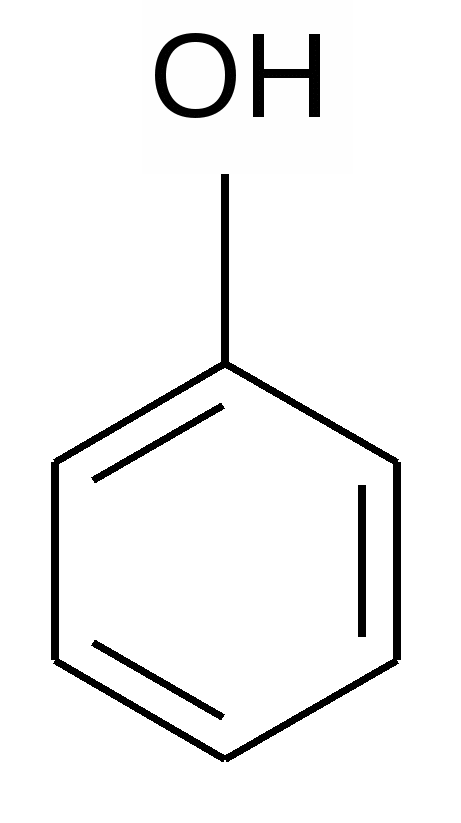
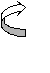 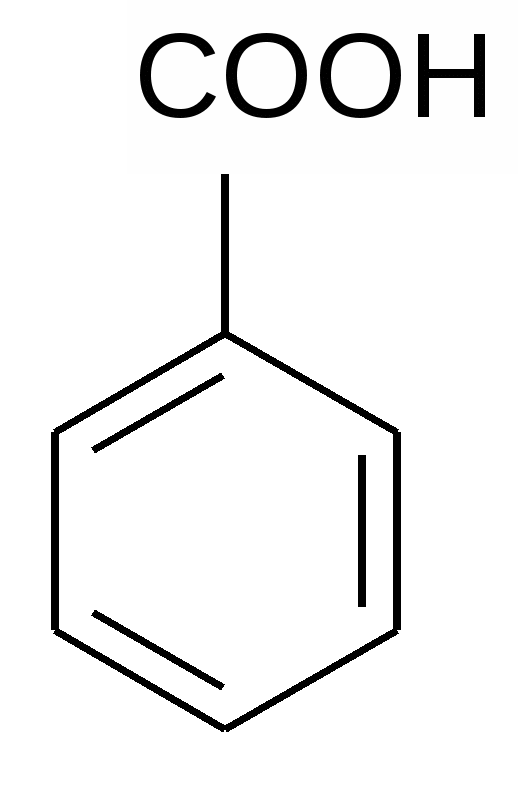 Акцепторные группы: карбоксильная, альдегидная., нитро, циано. Донор проявляет положительные + I и + М –эффекты, а акцептор - отрицательные - I и – М –эффекты. В сопряженной системе главным считается мезомерный М-эффект. Атом азота в шестичленных ароматических гетероциклических соединениях пиридине и пиримидине имеет отрицательный мезомерный эффект, поэтому снижается общая электронная плотность в ароматической системе( вспомните понятие π-недостаточные циклы) и по отношению к атому азота в положениях 2, 4, 6 цикла возникает недостаток электронной плотности и появляется частичный заряд б + . В никотиновой кислоте введение карбоксильной группы в молекулу пиридина увеличивает недостаток электронной плотности. Атом азота и карбоксильная группа действуют « согласованно» и создают недостаток электронной плотности в одних и тех же положениях 2,4,6 по отношению к ним. δ+
δ + δ + 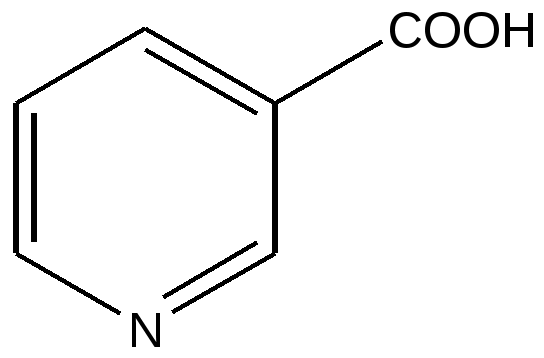 Никотиновая кислота В таблице представлены значения( направления) эффектов функциональных групп. Электронные эффекты функциональных групп Таблица 1
2.2. Кислотно-основные свойства органических соединений Ключевые слова к разделу 2.2 : теория Бренстеда-Лоури, кислота, основание, сопряженная кислота, сопряженное основание . В 1928г. ученые Бренстед и Лоури выдвинули протолитическую теорию сопряженных кислот и оснований применительно к органическим соединениям. С этой точки зрения, фактически, любое органическое соединение амфотерное, т.е. обладает кислотными и основными свойствами в зависимости от условий. Кислоты в соответствии с теорией Бренстеда-Лоури Кислотой было предложено называть соединение, способное отдавать протон( Н+), |

 + H + —>
+ H + —> 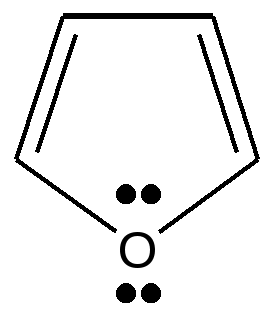
 δ+
δ+