Курс лекций по биоорганической химии. Курс лекций по биоорганической химии учебное пособие для студентов 1 курса очного обучения
 Скачать 4.37 Mb. Скачать 4.37 Mb.
|
|
Тема «Изомерия биоорганических соединений» является ключевой в изучении последующих разделов биоорганической химии ( механизмы реакций, карбоновые кислоты, оксикислоты, аминокислоты, липиды, белки, углеводы, нуклеиновые кислоты). Изучение пространственного строения природных белков- ферментов, гемоглобина, иммуноглобулинов, рецепторов, наружных клеточных и внутриклеточных мембран , нуклеиновых кислот, нуклеопротеидных комплексов в норме и при различных патологических состояниях составляет основу исследований молекулярной биохимии, биологии, медицины. открывает путь к развитию новых подходов в диагностике и лечении наследственных или приобретенных заболеваний 3.5. Приложение Немного истории. Еще в ХV11в. во времена Ньютона было известно, что свет, проходя через кристалл исландского шпата, создает два луча-«обыкновенный» и «необыкновенный», в 1808 г. Малюс показал, что такие же свойства имеет отраженный луч, и назвал его поляризованным. В 1815 г. мэтр Био открыл, что поляризованный свет взаимодействует со многими природными веществами: скипидаром, лимонным маслом, камфорой, врращая плоскость поляризации света. В 1848 г. Л Пастер изучал оптически неактивную натриевоаммониевую соль винной кислоты и обнаружил под микроскопом наличие двух зеркальных форм кристаллов Отделив их друг от друга с помощью пинцета и растворив в воде, Пастер с удивлением увидел, что оба раствора оптически активны, но один вращает вправо плоскость поляризации, а другой- влево на одинаковый угол, в то время как раствор соли не был оптически активным. О своем открытии Пастер сообщил химику Био, в то время уже глубокому старику. Он пожелал проверить опыт и сам приготовил вещество для исследования. И когда опыт подтвердился, взволнованный Био взял руку Пастера в свою и сказал: «Мой дорогой сын, я всю жизнь так любил науку, что чувствую, как сердце мое трепещет от радости…» Опыт Пастера имел необычайное значение : 1848 г. стал годом рождения новой области науки- стереохимии. Для проверки усвоения темы рекомендуем выполнить задания 1.Запишите структурные формулы изомерных кислот состава С17 Н33 СООН , содержащих двойные связи в положении 9,10 - олеиновой ( цис- форма) и элаидиновой ( транс- форма) . 2. Кротоновая кислота( 2-бутеновая) образуется в процессе синтеза и деградации высших карбоновых кислот. В процессе синтеза образуется цис-изомер, а при деградации- транс изомер. Напишите структурные формулы пространственных изомеров. 2. Запишите енольную форму оксобутандиовой кислоты ( оксоянтарной, щавелевоуксусной) в виде двух пространственных цис- и транс изомеров. Определите. какой из геометрических изомеров более устойчив? 3. Напишите формулы энантиомеров глицеринового альдегида и глицериновой кислоты. 4. В процессе обмена веществ образуются производные пентандиовой кислоты ( глутаровой): в реакциях цикла Кребса образуются две трикарбоновые кислоты: лимонная и изолимонная, а в синтезе холестерина ключевым соединением является 3-гидрокси- 3-метилпентандиовая кислота. Запишите их структурные формулы( формулы имеются в разделе « Приложение», в пособии « Биоорганическая химия» и в « Практикуме по биоорганической химии». Определите, какие вещества являются оптически активными. Запишите формулы энантиомеров и определите принадлежность к стереоряду. 5. Составьте схему превращения гуанина в ксантин, используя таутомерные лактимные формы обоих соединений. вместо приведенных на схеме лактамных форм. . 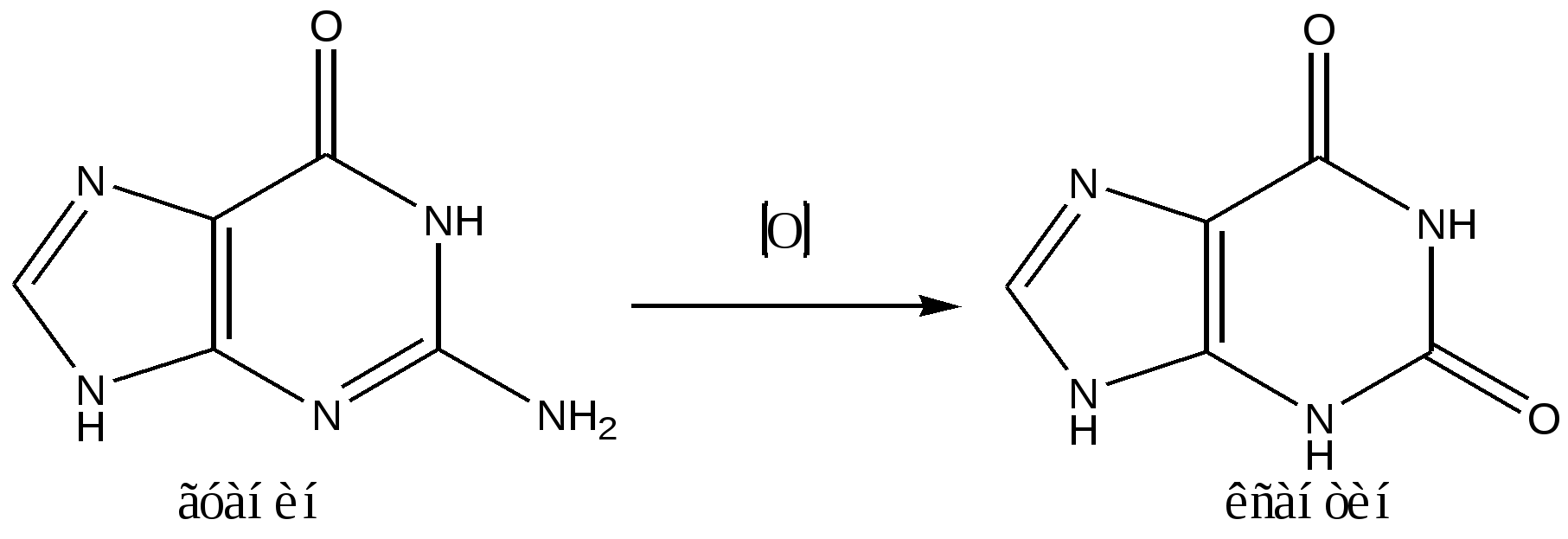 ЛЕКЦИЯ 4 МЕХАНИЗМЫ БИООРГАНИЧЕСКИХ РЕАКЦИЙ. Содержание лекции
4.1.1. Типы разрыва химических связей 4.1.2. Гомолитический тип разрыва химических связей 4.1.3. Гетеролитический тип разрыва химических связей 4.2. Механизмы биоорганических реакций 4.2.1. Реакции электрофильного присоединения в ряду алкенов(А Е) 4.2.2. Реакции нуклеофильного присоединения к карбонильной группе альдегидов и кетонов ( АN ) 4.2.3. Реакции электрофильного замещения в ряду ароматических соединений( SE+ ) 4.2.4. Реакции нуклеофильного замещения ( S N ) 4.2.5. Реакции элиминирования ( E ) 4.2.6. окислительно-восстановительные реакции Исходный уровень знаний для усвоения темы: Типы химических связей в органических соединениях, механизмы образования связи( обменный, донорно-акцепторный).Распределение электронной плотности в молекуле. Индуктивный, мезомерный эффекты. Донорные и акцепторные заместители. Кислотно-основные свойства биоорганических молекул. Типы химических реакций. Основы кинетики и катализа химических реакций: скорость, энергия активации, факторы, влияющие на скорость реакции. Ключевые слова к теме : Классификация биоорганических реакций(восстановление, замещение, окисление, присоединение, элиминирование), кофермент НАД, механизм реакции , нуклеофил, радикал , реакции invivo- и invitro, реакционная способность, типы разрыва химических связей( гетеролитический, гомолитический), фермент, электрофил. 4.1 Классификация реакций в биоорганической химии « Механизм ( греч. –mẻchanẻ – орудие, сооружение ). Совокупность промежуточных состояний и процессов. которые претерпевает какое - либо физическое, химическое явление, например, механизм химической реакции» ( Современный словарь иностранных слов ) Химическая реакция представляет собой такое взаимодействие между веществами, которое сопровождается изменением состава или строения веществ. Биологические процессы в клетке связаны с прохождением химических реакций. Принято подразделять химические процессы на два типа : invivo- те, что проходят в клетках живых организмов и invitro – вне организма. Биоорганическая химия изучает реакции invitro , но без знания законов этих процессов нельзя исследовать химические процессы invivo . В органической ( и биоорганической химии) принято выделять следующие типы реакций : - присоединения ( обозначают символом А- от англ. - toadd –соединять) - замещения ( обозначают символом S - от англ. - substitution – замещение ) - отщепления( элиминирования) ( обозначают символом Е - от англ.-toeliminate- удалять, устранять ) -изомеризации -разложения -окислительно-восстановительные В биохимии реакции, контролируемые ферментами, подразделяют на 6 типов, и, в связи с этим , существует 6 классов ферментов( каждый класс соответствует одному типу реакции). Для характеристики веществ используют понятие реакционная способность- склонность вещества вступать в различные реакции с большей или меньшей скоростью. Реакционную способность определяют сравнительно с другими подобного строения соединениями. 4.1.1 Типы разрыва химических связей Любая химическая реакция сопровождается разрывом одних связей и образованием других. Возможны два принципиально разных вида разрыва химических связей : гомолитический и гетеролитический. Реакционная способность вещества находится в прямой зависимости от типа разрыва его химических связей. 4.1.2. Гомолитический тип разрыва связей. Гомолитический( радикальный) тип разрыва характерен для неполярных или малополярных ковалентных связей при воздействии высокой температуры, электромагнитного неионизирующего излучения( ультрафиолетовое, рентгеновское) или других свободных радикалов ; приводит к образованию активных частиц радикалов . Радикал ( R• ) - частица вещества, имеющая неспаренный электрон. Радикалы могут быть нейтральными или заряженными частицами. При гомолитическом разрыве общая электронная пара связи разрывается поровну( по одному электрону на каждую новую частицу). С12 —> 2 С1 С1 -|- С1 —> C1• + C1• неспаренный электрон принято обозначать( • ) Диаграмма распределения электронов в атоме хлора на 3-ем энергетическом уровне в невозбужденном состоянии. --↑↓-- --↑↓--- --↑--- С1 --↑↓--- неспаренный электрон 3 s 3 р В процессе биохимических реакций образуются свободные радикалы при восстановлении кислорода и особом ферментативном окислении аминокислоты аргинина. Полное восстановление дикислорода О 2 обычно сопровождается образованием двух ионов оксида О -2 . О 2 + 4 е —> 2 О -2 При Восстановлении с участием одного электрона образуется супероксид ( англ - superoxide ), который представляет из себя ион-радикал с зарядом ( -1) О 2 + 1 е —> • О 2—1 Распределение электронов в молекуле дикислорода и супероксида . • • • • • О • • О • + 1 е —> • • • • ( - ) 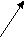 • • • • • О • • О • • супероксид • • • • • О • • О • • супероксид  дикислород • • • • дикислород • • • • в молекуле О 2 нет двойной связи неспаренный электрон « лишний» электрон ( - ) два неспаренных электрона Восстановление с участием двух атомов кислорода приводит к образованию пероксида ( в виде пероксида водорода), который может быть источником двух гидроксид-радикалов. О 2 + 2 е —> О 2—2 О 2 + 2 е + 2 Н + —> Н 2 О 2 пероксид водорода НО •|• ОН —> 2 Н О • гидроксид- радикал Радикалы гидроксида обладают высокой активностью, они могут получаться также при радиолизе воды в момент воздействия рентгеновского или радиоактивного излучения . НОН —> Н• + НО • Эти активные частицы вызывают изменения структуры белков мембран, рецепторов, ферментов, нуклеиновых кислот. Эти патохимические нарушения - важное звено в развитии лучевой болезни. Образование оксида азота( +2), относящегося также к свободным радикалам, имеет важное значение для регуляции процессов обмена веществ и осуществления адаптации ( приспособления) клетки в изменяющихся условиях существования. Оксид NO образуется в физиологических условиях invivo ферментативно из аминокислоты аргинина и при приеме нитроэфиров- лекарственных препаратов( самым известным и распространенным лекарством является тринитроглицерин) На схеме видно, что атом азота в оксиде имеет неспаренный электрон. •• •• В электронной оболочке кислорода 8 , а азота- 7электронов • N = О Неспаренный электрон создает радикальные свойства. •• Органические молекулы также образуют радикалы при отрыве атома водорода от атома углерода в sp3 –гибридном состоянии или разрыве связи между атомами С sp3. Атом углерода , имеющий неспаренный электрон, переходит в состояние sp2 , неспаренный электрон располагается на негибридной орбитали, а три связи с другими атомами располагаются в одной плоскости под углом 1200. Устойчивость радикалов зависит от нескольких факторов: а) возникновение системы сопряжения при образовании радикала ; атом, несущий неспаренный электрон, включается в цепь сопряжения, происходит увеличение устойчивости радикала. • — СН = СН—СН2—СН=СН— + R• —— > — СН = СН—СН—СН=СН— + RН несопряженная система | цепь сопряжения | Именно такое несопряженное строение имеют природные полиненасыщенные кислоты. б) влияние заместителей, связанных с атомом, на котором локализован неспаренный электрон ; донорные и акцепторные заместители увеличивают устойчивость радикалов. В ряду алканов устойчивость радикалов изменяется: С ( третичный) > С( вторичный) > С (первичный). 4.1.3. Гетеролитический тип разрыва связей Гетеролитический( ионный) тип разрыва характерен для полярных ковалентных связей . Общая электронная пара переходит на орбиталь более электроотрицательного атома, частица приобретает отрицательный заряд. Атом, потерявший свой электрон, приобретает свободную орбиталь и положительный заряд. СН3 | •• С1 ——> СН3 + + С1— В органической химии положительно заряженную частицу, катион, принято называть электрофильной ( символ Е +). Отрицательно заряженную частицу, анион, или молекулу, в которой есть атом с неподеленной парой электронов, называют нуклеофильной ( символ Nu ) Электрофил ( любящий электроны) атакует во время реакции участки другой молекулы с повышенной электронной плотностью, где сосредоточен заряд ( б+) Нуклеофил ( любящий положительно заряженное ядро) атакует во время реакции участки другой молекулы с недостатком электронной плотности, где сосредоточен заряд ( б + ). Наиболее распространенные электрофилы в реакциях с биоорганическими веществами: Н + , С1 +, Вг +, I + ( гипоиодид OI— ) СН3 + , С n Н2n+1 , NО2 +( катион нитрония). Наиболее распространенные нуклеофилы в реакциях с биоорганическими веществами: а) отрицательно заряженные Н – , НО — , RO— RCOO— , RS— , С1—– , Вг– , I– , б) содержащие атомы с неподеленными парами электронов НОН , ROН , RSН, NH3 , RNH2 . Нуклеофилы – по определению Бренстеда-Лоури- являются основаниями. Обратите внимание, что многие вещества могут быть как электрофильными, так и нуклеофильными реагентами (НОН , ROН , RSН, NH3 , RNH2 ). В биохимических реакциях вода проявляет свои амфотерные свойства и выступает в качестве нуклеофила и электрофила . С участием витаминов В 12 и фолиевой кислоты invivo осуществляются реакции с положительно заряженной метильной группой СН3 +. Электрофилы, в которых положительный заряд сосредоточен на атоме углерода, называются карбокатионами. В карбокатионе атом углерода находится в гибридном состоянии sp2 , образует с другими атомами три связи, которые располагаются в одной плоскости под углом 1200, одна орбиталь остается свободной. Образование карбокатионов в процессе реакции – весьма распространенная ситуация. Донорные заместители увеличивают устойчивость карбокатиона, а акцепторные - уменьшают. В ряду алканов устойчивость карбокатионов изменяется: С ( третичный) > С( вторичный) > С (первичный). ( простой принцип: чем меньше заряд б+, тем устойчивее карбокатион. Доноры смещают электронную плотность в сторону положительно заряженного атома и уменьшают величину этого заряда) Нуклеофилы, в которых отрицательный заряд сосредоточен на атоме углерода, называются карбоанионами. Образование карбоанионов в реакциях с биоорганическими веществами встречается значительно реже. Донорные заместители уменьшают устойчивость нуклеофилов, а акцепторные - увеличивают. Одновременно донорные заместители увеличивают отрицательный заряд и, следовательно, увеличивают нуклеофильные свойства, а акцепторные- уменьшают. Устойчивость частицы и реакционная способность – разные понятия. Реакции, в которых участвуют предпочтительно высокоактивные частицы, называются кинетически контролируемыми. Реакции, в которых участвуют наиболее устойчивые частицы, называются термодинамически контролируемыми. В результате такого различия в результате реакции могут образоваться несколько изомерных соединений. В биохимическом процессе , в которой участвует определенный фермент , одновременное протекание реакции в нескольких направлениях полностью исключается, с участием фермента реализуетсятолькоодин из нескольких возможных путей.
Под механизмом реакции подразумевается подробное описание процесса, в результате которого реагенты превращаются в продукты. Изучение механизма реакции включает в себя исследование( или умозрительное предположение) : - этапов реакции - электронного и пространственного строения промежуточных частиц, которые образуются во время реакции. Механизм реакции должен быть подтвержден экспериментально с использованием нескольких соединений гомологического ряда или веществ, отличающихся только заместителями. В процессе познания представления о механизме реакции могут изменяться или даже полностью отвергаться. Для некоторых реакций на данном этапе развития науки, может быть предложено несколько механизмов, каждый из которых имеет свои подтверждения . Если механизм реакции изучен и подтвержден , то делают дополнение к типу реакции, указывая электронную природу активных промежуточных частиц, определяющих механизм реакции: А Е - реакция электрофильного присоединения А Nu - реакция нуклеофильного присоединения. S Е - реакция электрофильного замещения S R -реакция радикального замещения Реакционная способность- тип реакции и электронная природа промежуточных активных частиц- зависит от строения биоорганического соединения, типа связей. Например, для непредельных соединений характерны реакции А Е , для ароматических соединений - SЕ , спиртов - SN . |
