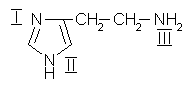Курс лекций по биоорганической химии. Курс лекций по биоорганической химии учебное пособие для студентов 1 курса очного обучения
 Скачать 4.37 Mb. Скачать 4.37 Mb.
|
основанием - соединение, способное присоединять протон. Кислота при удалении протона превращается в сопряженное основание, основание после присоединения протона - в сопряженную кислоту.    Н А + В А - + ВН+ Н А + В А - + ВН+Кислота Основание Сопряженное сопряженная Основание Кислота Кислота Н-А ( А означает сокращение от acid ) содержит поляризованную связь. Атом водорода связан с более электроотрицательными атомами: кислородом, азотом, галогенами, серой, углеродом. Чем больше электроотрицательность атома, тем сильнее поляризована связь. Органические соединения АН можно подразделить на несколько типов зависимости от природы кислотного центра: НО-кислоты, HS-кислоты, NH- кислоты, СН-кислоты Карбоновые кислоты R-СООН, фенолы Аг-ОН, спирты R-ОН , относятся к группе ОН- кислот. В ряду названных соединений кислотные свойства убывают. Силу кислоты( acid ) НХ в воде, т.е. степень ее диссоциации , можно определить, рассматривая равновесие:   Н2 О + Н- Х Н3 О+ + Х- Н2 О + Н- Х Н3 О+ + Х-Константа равновесия выражается уравнением : [ Н3 О+ ] [ Х- ] Ка =- --------------------- [ Н- Х ] Обычно пользуются величиной рКа = -lg Ка Чем больше кислотные свойства, тем меньше значение величины рКа . Кислоты, у которых рКа > 7, не изменяют цвета нейтральной индикаторной бумаги, если рКа > 10, то такие вещества не имеют кислого вкуса. Кислотные свойства зависят от нескольких факторов:
На полярность связи влияет природа гетероатома и природа заместителя в углеводородном радикале. Полярность связи уменьшается в ряду( при условии одинакового радикала): R –О - Н > R – N- Н > R -S -Н > R – С -Н Присутствующие в радикале акцепторные заместители всегда увеличивают, а донорные всегда уменьшают кислотные свойства. Поэтому в гомологическом ряду кислотные свойства всегда убывают. СН 3О Н > С 2Н5 ОН > С3 Н7 ОН НСООН > СН 3СООН > С 2Н5 СООН НООС-СН2-СН2-СООН < НООС-СН2-СООН < НООС-СООН СН 3СООН < НООС-СН2-СООН CН3- CН2-СООН < СН3- СН-СООН < СН-С-СООН | || OH O Устойчивость сопряженного основания Донорные заместители увеличивают величину отрицательного заряда аниона, и этим увеличивают способность присоединять протон – степень диссоциации. уменьшается, кислотные свойства убывают  Д Х - Д Х - группа донор кислотный центр локализация отрицательного заряда Акцепторные заместители уменьшают величину отрицательного заряда аниона и этим уменьшают способность присоединять протон – степень диссоциации увеличивается, кислотные свойства увеличиваются.  - Х А - Х А Кислотный центр группа акцептор Локализация отрицательного заряда Способность делокализовать (распределять отрицательный заряд в анионе ) носит название поляризуемость атома-), связана с увеличением радиусом атома и наличием свободных электронных орбиталей. Поляризуемость атома серы больше, чем атома кислорода. Поэтому тиолы всегда обладают более сильными кислотными свойствами, чем спирты, так же как сероводород обладает более сильными кислотными свойствами по сравнению с водой. Сравнительный ряд изменения кислотных свойств соединений, содержащих различные кислотные центры и одинаковые радикалы: С2 Н5 S Н > С2 Н5 О Н > С2 Н5 NH2 Обратите внимание, что ряд изменения кислотности тиолов, спиртов и аминов не совпадает с рядом изменения полярности связи Х-Н в этих соединениях. Основания( в соответствии с теорией Бренстеда-Лоури) Основание( В- сокращение от base ) присоединяет протон, потому что в молекуле имеется атом с неподеленной парой электронов ( азот, кислород, сера ), двойная связь или вся частица несет отрицательный заряд ( ОН - , R О - , RS - ). Протон присоединяется к атому с неподеленной парой электронов за счет донорно-акцепторной связи, молекула приобретает положительный заряд. Чем выше основные свойства, тем легче протекает протонирование. ( В слове осн'овные ударение следует сделать на букве «о» во втором слоге ) | | -N- + H+ —> — N + — H ( аммониевое основание ) | - О - + H + —> — О+ — Н ( оксониевое основание ) | -S - + H + —> —S+ — H ( сульфониевое основание ) | С = С + H + —> > С =|=С< ( π -основание ) H + Силу основания В ( base ) в воде можно оценить, рассматривая равенство:   В + НОН ВН + + ОН – В + НОН ВН + + ОН –Константа равновесия выражается уравнением [ ВН + ] [ ОН –] КВ =- -------------------- рК В = -lg К В [ В ] Величину рК В в воде можно перевести в рКа . рК В + рКа = 14 ( при 250 С ) Чем больше основные свойства , тем меньше значение величины рКВ . Основные свойства зависят от нескольких факторов:
Чем больше электроотрицательность, тем выше основные свойства. Так как электроотрицательность О > S , то основные свойства С2 Н5 О Н > С2 Н5 S Н 2. Устойчивости сопряженной кислоты, возникающей после присоединения протона к основанию. RNH2 + H + —> RN H3 + ROH + H + —> R O+ –H | H Ион аммония более устойчив, чем ион оксония , поскольку присоединение про- тона Н + к электронной паре энергетического уровня 2s2 атома азота энергетически более выгодно, чем к паре электронов энергетического уровня 2 р2 атома кислорода ( хотя атом кислорода обладает большей электроотрицательностью).
Заместители- доноры увеличивают электронную плотность в основном центре и этим увеличивают основные свойства. СН3 NH 2 < C 2H 5 NH2 < ( C 2H 5 ) 2 NH Заместители акцепторы уменьшают электронную плотность в основном центре и уменьшают основные свойства. НО-СН 2 - СН 2 - NH2 < СН 3 - СН 2 - NH2 акцептор донор 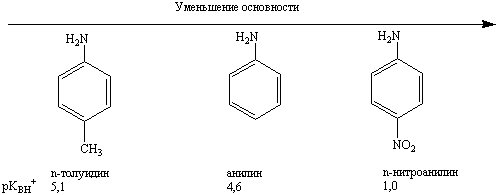 Основные свойства ароматических аминов ниже, чем алифатических, поскольку неподеленная пара электронов атома азота взаимодействует с электронной системой бензольного цикла, и электронная плотность на атоме азота снижается. С6 Н 5 - NH2 < СН3 NH 2 анилин метиламин Таким образом, спирты , амины обладают кислотными и основными свойствами. У спиртов преобладают кислотные над основными, а у аминов- основные над кислотными. Следует помнить : кислотные и основные свойства одного вещества изменяются всегда в противоположных направлениях. Можно составить ряды закономерных изменений : А. кислотные свойства : R-СООН > R-SH > R-OH > R-NH2 Б. основные свойства : R-NH2 > R-OH > R-SH В амидах R-СОNH2 аминогруппа практически теряет основные свойства. Важное биологически активное вещество мочевина NH2 - CO - NH2 - однокислотное основание. По современным данным протон присоединяется к атому кислорода и положительный. заряд равномерно распределяется( делокализуется) между четырьмя атомами. Мочевина – конечный продукт обмена пищевых белков, белков организма и аминокислот. Содержится во всех биологических жидкостях организма, стабилизирует структуры белков, нуклеиновых кислот, участвует в поддержании постоянства значения рН внутренней среды организма. Выделяется в составе мочи в количестве до 30 г/ сутки R- С=О NH2 -C - NH2 + НNO3 —> NH2 -C - NH2 | || || . NO3 - NH2 O + ОН амид мочевина ( карбамид) соль нитрат мочевины хорошо растворима плохо растворима в воде 2.3. Медико- биологическое значение изучения темы « Кислотно-основные свойства биоорганических соединений» Теория Бренстеда-Лоури позволяет рассматривать большинство биоорганических соединений с позиций кислотно-основных свойств. В первую очередь, это касается полимеров белков, аминокислот, азотистых оснований, входящих в состав нуклеиновых кислот, биоактивных карбоновых кислот и их гетерофункциональных производных гидрокси – и оксокислот. Все вышеуказанные соединения изменяют внутреннюю среду организма, поэтому кровь, лимфа, слюна, моча и другие внеклеточные и внутриклеточные жидкости обладают буферной емкостью как в отношении кислот, так и оснований. В норме рН крови может изменяться в пределах 7,4 ± 0, 05. Накопление в составе крови 2-гидроксипропановой кислоты( молочной кислоты, лактата) сопровождается снижением значения рН – развивается ацидоз( его называют в медицине как « лактацидоз»). При заболеваниях печени возможно нарушение синтеза мочевины из аммиака, в крови накапливается аммиак, рН крови смещается в щелочную сторону, возникает алкалоз( алкали – араб- щелочь). Для обозначения увеличения содержания аммиака в крови в клинике используют термин « аммониемия, или «гипераммониемия». Для проверки усвоения темы рекомендуем выполнить задания:
двух природных соединений: 2-аминоэтанола-1( коламина ) и 2-аминоэтантиола-1 (меркамина). Коламин входит в состав сложных липидов- фосфолипидов, в частности, кефалина. Меркамин использовался как лекарство -противолучевое средство-радиопротектор. Оба вещества образуются в клетках человека. Какое из этих соединений образует соль при взаимодействии с гидроксидом калия ? НО - СН 2– СН2 - NН 2 НS- СН2 –СН2- N Н2 коламин меркамин 3. Составьте диаграммы распределения электронной плотности и сравните кислотность двух природных соединений: коламина и холина. Холин в нейронах превращается в ацетилхолин и является медиатором парасимпатической нервной системы и встречается в некоторых отделах симпатической нервной системы. Какое из этих двух соединений образует соль при взаимодействии с кислотой ? Объясните наличие положительного заряда на атоме азота в холине. + НО - СН 2– СН2 - NН 2 НО - СН 2– СН2 – N( СН 3) 3 коламин холин 4. Сравните основные свойства метиламина и аммиака ; пиридина и анилина. Напишите реакции образования хлороводородных солей аммиака, метиламина. анилина и пиридина. 5. Сравните кислотные свойства этанола и фенола. Объясните причину отличия кислотных свойств. 6. 2, 4, 6- тринитрофенол ( пикриновая кислота) образует соли с аминами и аминокислотами. Используется в анализе аминокислот.. Значение рКа равно 1, 02 . Можно ли сделать вывод, что нитрогруппы обладают сильным акцепторным действием ? 7. Посмотрите в таблице значение рКа бензойной кислоты. Кислотные свойства 4- замещенных бензойной кислоты зависят от природы заместителя. Значение рКа 4-гидроксибензойной кислоты равно 4, 58 , а 4-метилбензойной кислоты 4,34. Каким эффектом обладают эти две группы : донорным или акцепторным? Какая из двух групп оказывает большее влияние? Информация В таблице приведены значения величин рКа и рКв, которые помогут подтвердить основные положения о влиянии заместителей на кислотно-основные свойства. Эта таблица нужна также при изучении последующих тем. КИСЛОТНО – ОСНОВНЫЕ СВОЙСТВА БИООРГАНИЧЕСКИХ СОЕДИНЕНИЙ Таблица
ЛЕКЦИЯ 3 ИЗОМЕРИЯ БИООРГАНИЧЕСКИХ СОЕДИНЕНИЙ Содержание лекции
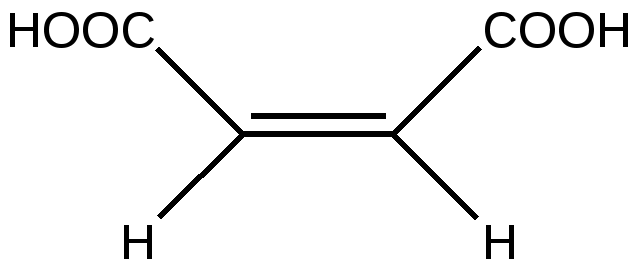
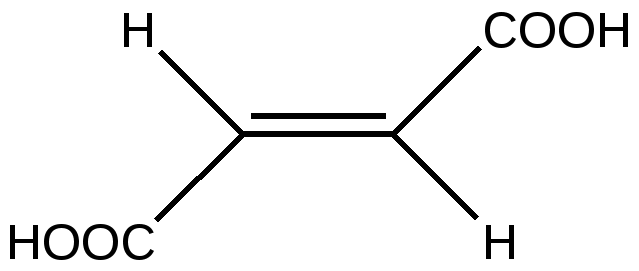
3.2.1. Изомерия скелета 3.2.2. Изомерия положения 3.3. Динамическая изомерия 3.3.1. Кето-енольная таутомерия 3.3.2 Лактим-лактамная таутомерия 3.4. Пространственная изомерия 3.4.1. Геометрическая изомерия 3.4.2. Оптическая( зеркальная) изомерия 3.4.3. Пространственное строении шестичленных циклов 3.4.4. медико-биологическое значение стереоизомерии 3.5. Приложение. Немного истории Исходный уровень знаний для усвоения темы Положение теории Бутлерова о взаимосвязи порядка соединения атомов и свойств органического соединения, понятие « изомерия», « изомеры», виды изомерии, тетрагональный ( тетраэдрический ) и тригональный атомы углерода, пространственная ориентация орбиталей атома углерода в состоянии гибридизации С sp3 и С sp2 , плоско-поляризованный луч света. Ключевые слова к теме ахиральный центр .диастереомер, енол , изомер изомерия , конфигурация , конформация, конформер , лактам , лактим, мезо-форма , поляриметр , проекция Фишера, равновесие прототропное , рацемат , стереоизомер(геометрический, оптический), стереоряд, центр хиральный, энантиомер 3.1. Виды изомерии Изомерия- явление, заключающееся в существовании нескольких соединений одинакового состава С х Н y Оz N p , но отличающихся по своим физическим и химическим свойствам ( isos – греч- равный , одинаковый, подобный ). Такие вещества называются изомерами. Изомерия является одной из причин существования множества органических соединений. Известны 2 основных вида изомерии: структурная и пространственная. Оба вида принципиально важны для проявления биологической активности у органических соединений. 3.2. Структурная изомерия. Можно выделить 2 вида структурной изомерии : статическую и динамическую Различают несколько видов структурной изомерии статического характера ( термин статическая означает, что превращение в другую изомерную форму возможно только в процессе химической реакции изомеризации ) 3.2.1. Изомерия скелета 1. Вещества разных классов образуются за счет изменения порядка соединения атомов С2 Н 5 N О2 СН3 – СН2 – NО2 нитроэтан NH2 – CH2 – COОН аминоуксусная кислота С2 Н6 О СН3 О СН3 диметиловый эфир С2 Н5 О Н этанол 2. Возможна изомерия скелета веществ одного класса ( алканы, алкены- линейные, разветвленные, циклоалканы- изомеры отличаются размером цикла) Изомерия цепи алканов начинается с бутана , а алкенов – с бутена. Алкан состава С 13 Н28 имеет 802 изомера. . В химических процессах invitroпревращение линейных алканов в нелинейные под действием высокой температуре и специфических катализаторов используется в производстве высококачественного бензина. Изомеризация углеродного скелета и превращение нелинейного соединения в линейное возможно в весьма ограниченном круге биохимических реакций, в которых обязательно участвует витамин В 12. Важным биохимическим превращением является реакция изомеризации активной формы ( тиоэфира ) метилмалоновой кислоты в активную форму сукцинилКоА (тиоэфир янтарной кислоты ) . - макроэргическое соединение) СН 3 — СН –СООН | —> НООС-СН2 –СН2 -СО SKoA СО SKoA МетилмалонилКоэнзим А сукцинилКоэнзим А 3.2.2. Изомерия положения: - функциональных групп, - двойной связи. Этот вид изомерии важен для понимания свойств биоорганических соединений, создания лекарственных препаратов, которые могут выполнять роль синергистов или антагонистов по отношению к природным соединениям. Синергисты- действуют в одном направлении( например, возмещают недостаток природного биологически активного соединения ), активируют биологические процессы. Антагонисты( или антиметаболиты) – действуют в противоположном направлении, тормозят биологические процессы. Например, в составе белка находятся только те природные аминокислот, у которых аминогруппа находится в положении -2 ( так называемое α -положение). а - положение СН3 - СН - COOH СН 2 - СН 2- COOH | | NH2 NH2 2-аминопропановая кислота 3-аминопропановая кислота входит в состав белка не входит в состав белка ( аланин ) ( ß -аланин) Природная ненасыщенная олеиновая кислота С 17 Н 35 СООН содержит двойную связь между атомами 9,10. Ее изомеры, отличающиеся расположением двойной связи, не образуются в природных условиях, invivo . 3.3. Динамическая изомерия. Ах, все равно»- быстро сказала Алиса- «Только, знаете, так неприятно все время меняться» Л. Кэрролл. «Алиса в стране чудес» Примером динамической изомерии является таутомерия. Таутомерия-явление обратимой изомерии, при которой два или более изомеров легко переходят друг в друга. Вещество содержит одновременно несколько изомерных структур, находящихся в равновесии в определенном соотношении. Термин « таутомерия» ( от греч- «тауто» – тот же самый и « мерос»- часть) был предложен в 1885г. К. Лааром. Выделенные изолированные формы называются десмотропами, а явление в целом- десмотропией. Наиболее распространенным видом таутомерии явлется прототропная таутомерия, при которой превращение осуществляется в результате перехода атома водорода ( в виде протона ) внутри молекулы . Для понимания направления биохимических реакций, строения биологически активных веществ( например, нуклеиновых кислот, моносахаров) необходимо изучить кето-енольную, лактим-лактамную, кольчато-цепную( цикло-оксо) таутомерию. 3. 3.1. Кето-енольная таутомерия. Понятие кето-енольная таутомерия подразумевает, что химическое соединение может существовать в нескольких формах: кетоновой и енольных, находящихся в динамическом равновесии. кето-форма енольная форма | б+ | — С <— С — — С = С — | | | | б- О Н б+ OH СН-кислотный возникает тип сопряжения π , р центр Образование енольной формы связано с перемещением атома водорода из соседнего СН-кислотного центра к более электроотрицательному атому кислорода. ( термин «енол» означает, что гидроксильная группа находится у атома углерода в sp2 –гибридном состоянии. Вспомните название – фенол ) Соединение в енольной форме относится к НО- кислотам в соответствии с теорией Бренстеда-Лоури. В енольной форме всегда возникает сопряженная система по типу π , р. Чем длиннее сформируется цепь сопряжения, тем устойчивее и термодинамически выгоднее енольная форма ( по сравнению с возможными другими). Первым фактом обнаружения существования кето-енольной таутомерии можно считать реакцию Кучерова - гидратацию ацетилена. В результате реакции образуется этаналь( но первым продутом присоединения воды к тройной связи является неустойчивый виниловый спирт- енол- термодинамически невыгодная изомерная форма). соли ртути, серная кислота С2 Н 2 + НОН ————> ( СН2 = СН ) —> СН3 —С -Н | | | ацетилен НО O виниловый спирт этаналь Наиболее важное значение в биологических процессах имеет кето-енольная таутомерия оксокислот: пировиноградной, щавелевоуксусной, 3-оксобутановой ( последняя может образовать две таутомерные формы) 3 2 1  СН3 —С —СООН СН2 = С — С=О СН3 —С —СООН СН2 = С — С=О | | | | | | | |О НО ОН пируват (кето-форма) пируват( енольная форма)-цепь сопряжения охватывает всю молекулу, включая атом кислорода карбоксильной группы до атома С3 3-оксобутановой ( ацетоуксусная) кислота может образовать две формы ( цепи сопряжения в енольных формах выделены выделены красным цветом) СН3 —С — СН2 —С ООН ацетоуксусная кислота   | | | | О СН2 = С — СН2 —С ООН СН2 — С = СН —СООН | | ОН ОН менее устойчивая форма более устойчивая форма короче цепь сопряжения длиннее цепь сопряжения Медико- биологическое значение кето-енольной таутомерии 1. Енольная форма пировиноградной кислоты в растительных и животных клетках образует фосфорный эфир- фосфоенолпируват, который является высокоэнергетическим( макроэргическим) соединением. Энергия макроэргической связи в нем выше по сравнению с АТФ. Это соединение служит для образования АТФ, реакция относится к необратимым. СООН | + АДФ —> АТФ + СН 3— С — СООН C ОРО3Н2 || || О пировиноградная кислота СН2 фосфоенолпируват ( обозначение макроэргической связи) название значка «тильда» 2. Енольные формы кетокислот дают качественную реакцию аналогичную фенолу с хлоридом железа( +3). На этом основано экспресс- определение в моче новорожденных фенилпировиноградной кислоты (2-оксо - 3-фенилпропановой) при наследственном заболевании фенилкетонурии. 3. Определение ацетона и качественная реакция, позволяющая отличить этанол от метанола, основаны на способности альдегидов и кетонов к таутомерным превращениям. К раствору этанола или ацетона добавляют раствор йода в щелочной среде, щелочная среда способствует устойчивости енольной формы. Происходит последовательное присоединение галогена к двойной связи , акцепторное действие галогена стабилизирует енольную форму. Далее после гидролиза в щелочной среде получается осадок йодоформа , появляется характерный запах. + 3 I2   СН3 -С(О) -СН3 СН2 = С(ОН)- СН3 —> С I3 - С(О) -СН3 + 3 НI СН3 -С(О) -СН3 СН2 = С(ОН)- СН3 —> С I3 - С(О) -СН3 + 3 НI 1,1.1-трийодацетон С I3 - С(О) -СН3 + 3 NaOH —> СНI 3 + CH3 COONa Йодоформ Этанол окисляется йодом, образуется этаналь. Этаналь переходит в енольную форму в растворе в момент присоединения йода, получается 1,1,1-трийодэтаналь, который также легко гидролизуется с образованием йодоформа. «Йодоформная» проба чрезвычайно проста в исполнении и используется для обнаружения патологических компонентов мочи(ацетона,ацетоуксусной кислоты), которые могут появляться при инсулинзависимом диабете или голодании. Любые химические соединения, в которых есть фрагменты СН3 —С — и СН3 —С — , дают «йодоформную» реакцию . | | | ОН O 3.3.2. Лактим-лактамная таутомерия Соединение( обычно понятие применяется к циклическим системам) может существовать в двух формах: лактимной и лактамной. — С — NH — — С = N — | | | О ОН   лактамная форма лактимная форма лактамная форма лактимная форма( атом Н связан с азотом, ( им- обозначает азот с двойной связью ) как в аммиаке) Образование лактимной формы связано с перемещением атома водорода из соседнего NН-кислотного центра к более электроотрицательному атому кислорода( этот раздел будет подробно изучен в теме «Нуклеиновые кислоты) Медико- биологическое значение лактим-лактамной таутомерии Для образования комплементарных пар азотистых оснований: тимин, гуанин – цитозин соединения ( Г, Ц, Т ) должны иметь лактамное строение. На рисунках приведены структурные формулы азотистых оснований в лактамной форме. 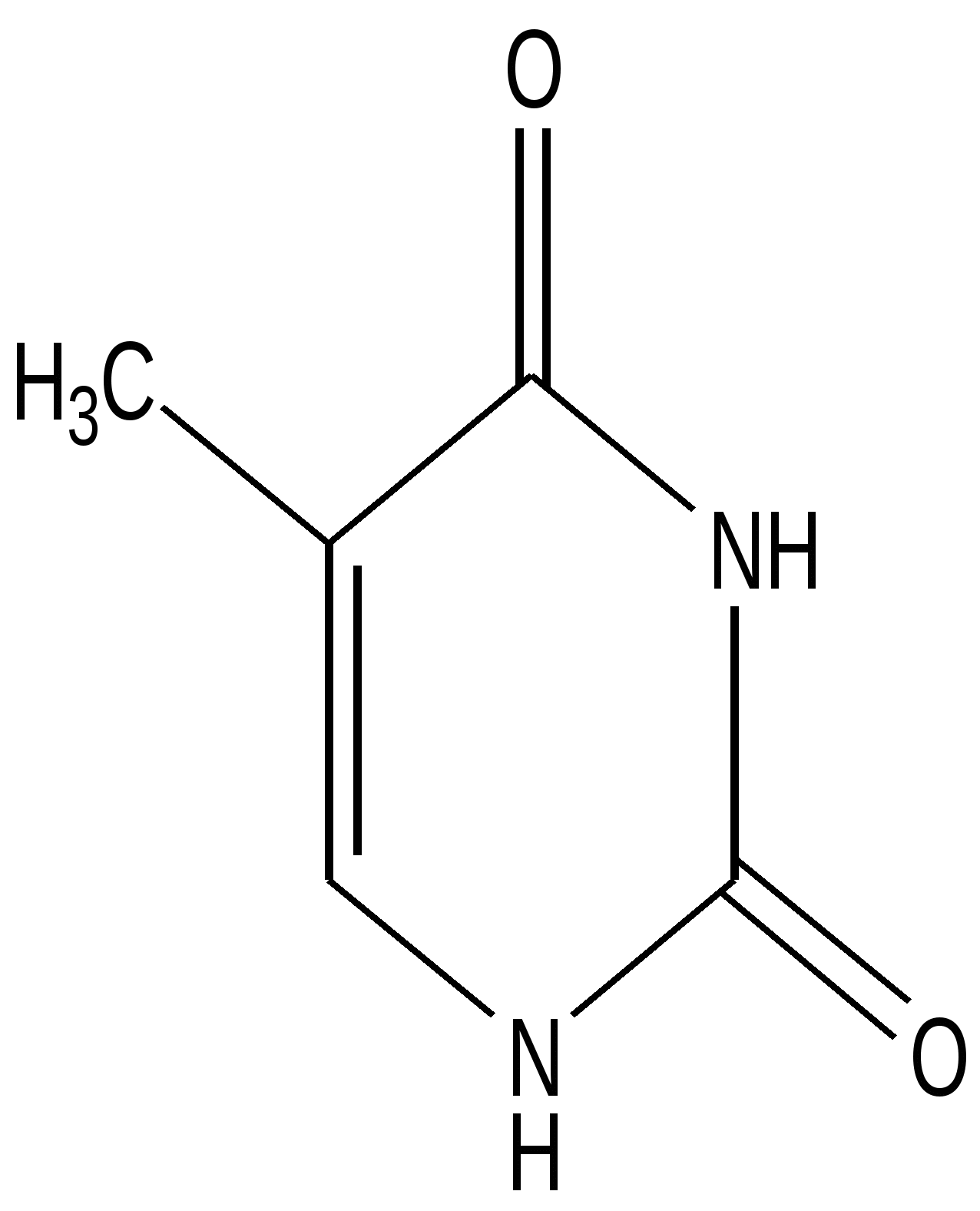 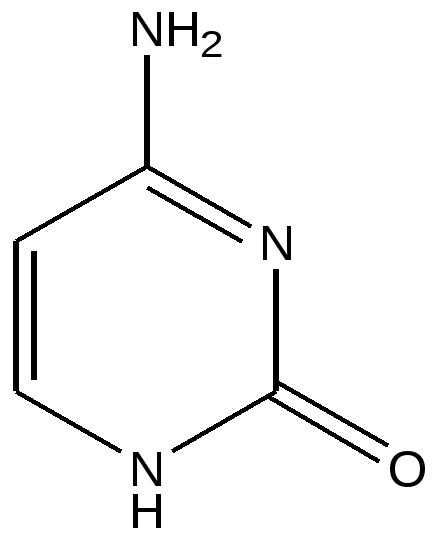 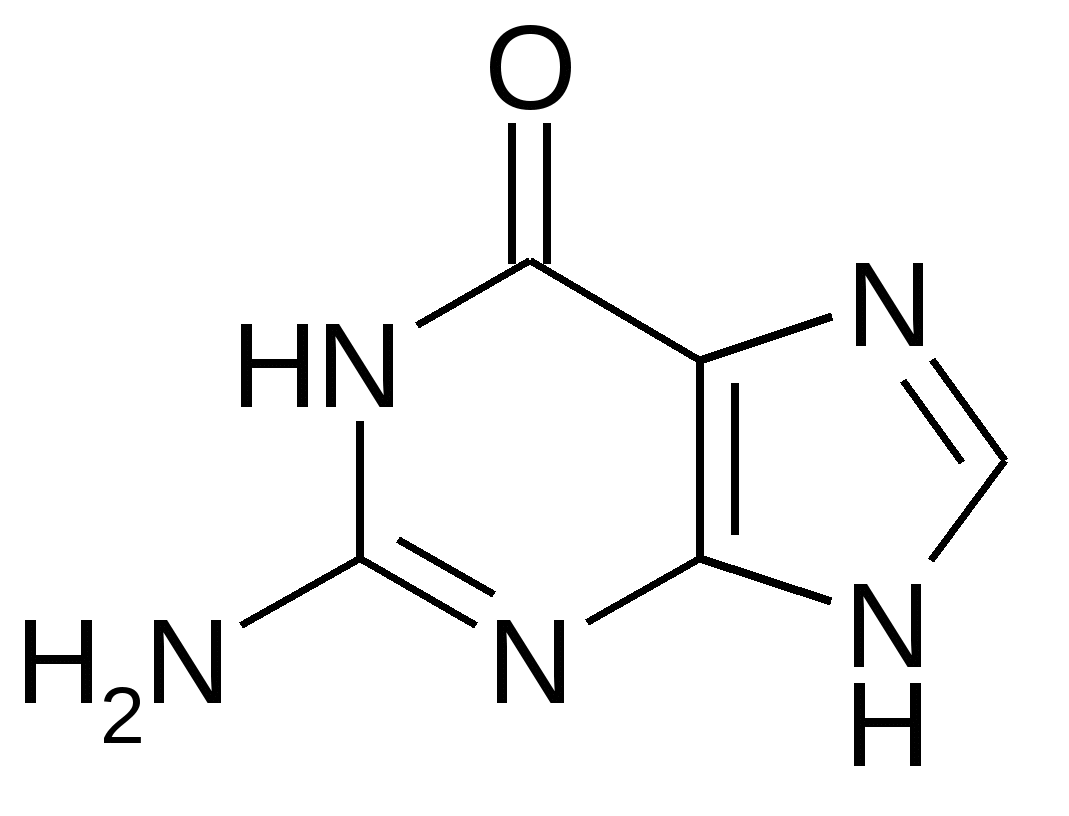 Тимин Цитозин Гуанин Задание для проверки усвоения раздела темы: запишите формулы гуанина, цитозина, тимина в виде лактамов. Изменилось ли число двойных связей при переходе в другое изомерное состояние? 3.4 Пространственная изомерия Ключевые слова к разделу 3 4: асимметричная молекула, геометрическая изомерия, диастереомер, конфигурация, конформация, конфигурационный ключ Розанова, оптическая изомерия, оптически активный атом , проекция Фишера, стереоряд, хиральный атом, энантиомер. Необычайно важным обстоятельством для проявления биологической активности органических соединений является существование пространственной( стерео)изомерии. Все биологически активные классы природных соединений- аминокислоты, белки, углеводы, гидроксикислоты, липиды- имеют определенную пространственную организацию. От нее зависит способность этих веществ связываться с рецепторами, превращаться в биохимических реакциях с участием белков-ферментов, транспортироваться через мембраны. Для характеристики пространственных изомеров используют два понятия : конфигурация и конформация. Конфигурация- определенное расположение атомов в пространстве. Конфигурация создается благодаря направленному расположению орбиталей валентных электронов атомов. Гибридизация sp3 , угол между связями 1090 28’ , тетраэдрическое направление связей. Гибридизация sp2 , угол между связями 1200 , тригональное плоскостное направление связей. Конформация - -изменение расположения атомов вследствие поворота вокруг связи при сохранении конфигурации. Молекула может иметь несколько конформаций , которые непрерывно переходят друг в друга вследствие непрерывного вращения атомов относительно одинарных связей. Конформационные изменения можно назвать «поворотной» изомерией. Конформации отличаются по энергетическому состоянию. В наиболее устойчивой, энергетически выгодной, молекула находится более длительное время, но в результате столкновений с другими молекулами ее конформация изменяется, а затем вновь возвращается в более устойчивое состояние. Движение- это форма существования материи. 3.4.1 Геометрическая( цис, транс) изомерия Для алкенов характерна плоскостная геометрическая цис, транс- изомерия, если каждый из sp2 - гибридизованных атомов углерода связан с двумя разными заместителями. Образование изомеров возникает из-за невозможности свободного вращения фрагментов молекулы вокруг двойной связи. В гомологическом ряду алкенов первым представителем , который существует в двух геометрических изомерных формах, является бутен-2. Н СН3 СН3 СН3 > С=С < > С=С < СН3 Н Н Н trans- бутен-2 cis- бутен-2 Биологическая активность природных соединений и лекарственных препаратов зависит от их пространственной конфигурации. Полиненасыщенные кислоты –олеиновая, линолевая, линоленовая, арахидоновая присутствуют в составе липидов в цис-форме, которая является энергетически менее устойчивой, соединения обладают дополнительным запасом энергии по сравнению с транс –изомерной формой . Под влиянием УФ-излучения, свободных радикалов( кислорода, оксида NO ) изменяется пространственное строение , цис-форма превращается в более устойчивую транс-форму, коренным образом изменяется биологическая активность.органической молекулы. Из двух возможных изомеров бутендиовой кислоты в клетках растений и животных образуется только транс-бутендиовая кислота( фумаровая) , а цис-изомер( малеиновая кислота) является для человека и животных токсическим соединением.
В витамине А двойные связи, располагающиеся в боковой цепи, имеют транс-конфигурацию. Для осуществления акта фоторецепции необходимо обратимое превращение : цис-ретиналь—> транс-ретиналь – > транс-ретинол — > цис-ретинол —>цис-ретиналь
«Ну, конечно, воскликнула она, это же Зазеркальная книга. Если я поднесу ее к Зеркалу, Я смогу ее прочесть» Л. Кэрролл «Алиса в Зазеркалье» Пространственное строение многих органических молекул связано с существованием оптических изомеров. Условием образования оптических изомеров является наличие в молекуле атомов углерода в sp3 -гибридном состоянии, каждый из которых связан с 4 различными заместителями. В этом случае молекула не обладает плоскостью симметрии и она не совместима со своим зеркальным отражением. Пространственные оптические изомеры ( показана их несовместимость) 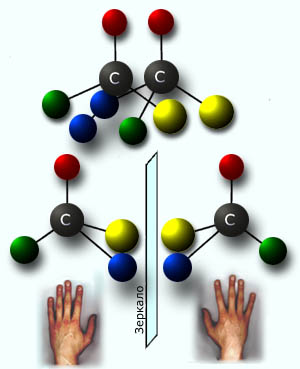 Такое вещество обладает оптической активностью, изомеры называются оптическими. Атом углерода, связанный с 4 различными заместителями( обозначают С*), принято называть асимметричным, оптически активным , хиральным ( от греч –cheir-рука , кисти руки являются зеркально отраженными друг другу).  А А оптические изомеры(энантиомеры) А А оптические изомеры(энантиомеры) | | в плоскостном изображении В— С*— D D — C*— В ( плоскостные проекции | | Фишера) E E зеркальная плоскость Два вещества, полные зеркальные изомеры, носят название энантиомеры. Если в молекуле один хиральный атом, то два стереоизомера изомера всегда являются энантиомерами. Общее количество изомеров у молекулы, содержащей несколько асимметрических атомов углерода, зависит от числа хиральных атомов( хиральных центров): N = 2 n ( N - общее количество изомеров, n – число хиральных атомов в молекуле) Изомеры, содержащие несколько хиральных центов и не являющиеся полными зеркальными отражениями друг друга носят название – диастереомеры. Для изображения на плоскости оптических изомеров природных биоактивных молекул( аминокислот, гидроксикислот, моносахаров) используют проекции Фишера : - на плоскость проецируют тетраэдрическую конфигурацию - относительно асимметрического атома углерода записывают 4 заместителя, вверху- старшую из всех групп, внизу - радикал , справа и слева – атомы водорода и функциональные группы( амино, гидрокси, меркапто. галоген ) . Структурные формулы отражают существование молекулы в виде двух изомеров, принадлежащих к стереорядам D и L( D –правый, L – левый) Запишем формулу 2-гидроксипропановой( молочной ) кислоты в виде двух стереоизомеров.  СН3 — СН — СООН COOH COOH СН3 — СН — СООН COOH COOH| | | OH H — C* — OH HO —C* — H | | СН3 СН3 D - лактат L – лактат Вещество относится к D -ряду, если переход от атома водорода к гидроксигруппе( или любой функциональной ) через старшую группу совпадает с движением стрелки на часах. Вещество относится к L -ряду, если переход от атома водорода к гидроксигруппе( или любой функциональной ) через старшую группу осуществляется против движения стрелки на часах. Как правило, температуры плавления, кипения и другие физико-химические свойства энантиомеров не отличаются Отличить их друг от друга можно только с помощью поляризованного луча света, энантиомеры вращают угол плоскости поляризованного луча на одну величину, но в противоположные стороны. Отклонение плоскости поляризованного луча можно измерить с помощью прибора поляриметра. Если для полного скрещения призм ручку анализатора требуется повернуть вправо, то изомерную форму вещества называют правовращающей ( + d ), а если влево- левовращающей ( -l ) . Знак вращения – свойство вещества. Отнесение к D, L - стереорядам- условный прием, знак вращения и стереоряд не связаны между собой. Определить истинную конфигурацию вещества, т.е.сделать соотнесение « знак вращения- стереоряд» можно, используя конфигурационный стандарт М.А.Розанова. В качестве стандарта используют D и L –глицериновый альдегид. Оказалось, что (+d )-глицериновый альдегид соответствует D -стереоряду, а ( - l )- соответствует -L -стереоряду.  CНO CНO CНO CНO | | | |H — C* — OH HO —C* — H | | СН2 ОН СН2 ОН ( + ) D –глицеиновый альдегид ( - ) L –глицериновый альдегид Биологически активное соединение( знак вращения его определяется с помощью поляриметра) путем химических реакций превращают в глицериновый альдегид ( + d или - l ). Самая значительная трудность состоит в том, чтобы асимметрический атом углерода не изменил конфигурацию на противоположную в процессе химических реакций. Равная по массе или по количеству вещества смесь двух энантиомеров является оптически неактивной. Такую смесь называют рацемической. Особый случай составляют вещества, в которых несколько хиральных атомов углерода, но и есть ось симметрии. В этом случае число энантиомеров изменяется и возникает внутренний рацемат – мезоформа. Примером является винная кислота- 2,3-дигидроксибутандиовая. НООС — СН — СН — СООН | | ОН ОН 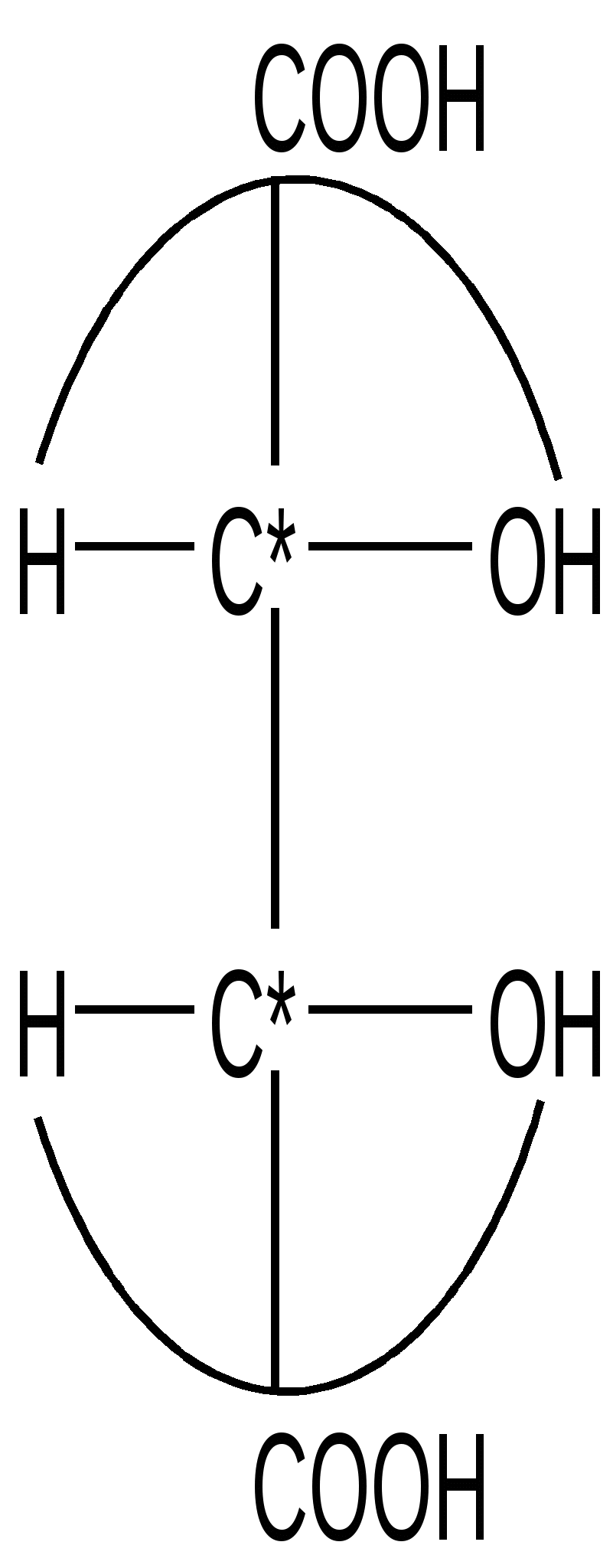 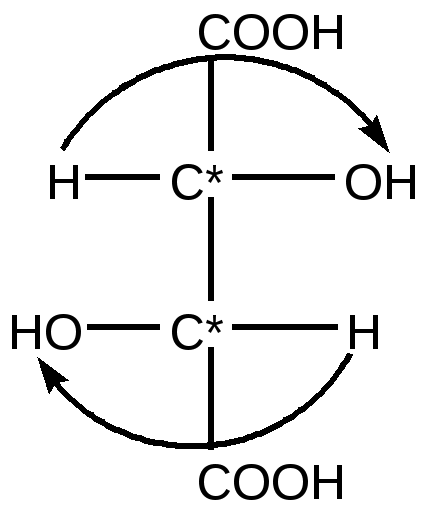 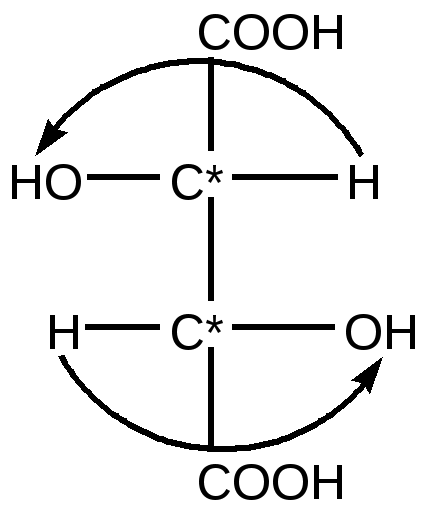 L-винная кислота (l, l ) мезо-винная кислота(d , l) D- винная кислота(d, d ) L-винная кислота (l, l) и D- винная кислота(d, d )- энантиомеры мезо-винная кислота(d , l) и L-винная кислота (l, l) > диастереомеры мезо-винная кислота(d , l) и D- винная кислота(d, d )
Циклогексан не может иметь плоскостное строение. так как атомы углерода имеют тетраэдрическую конфигурацию и угол между связями равен 1090 28’ . 1 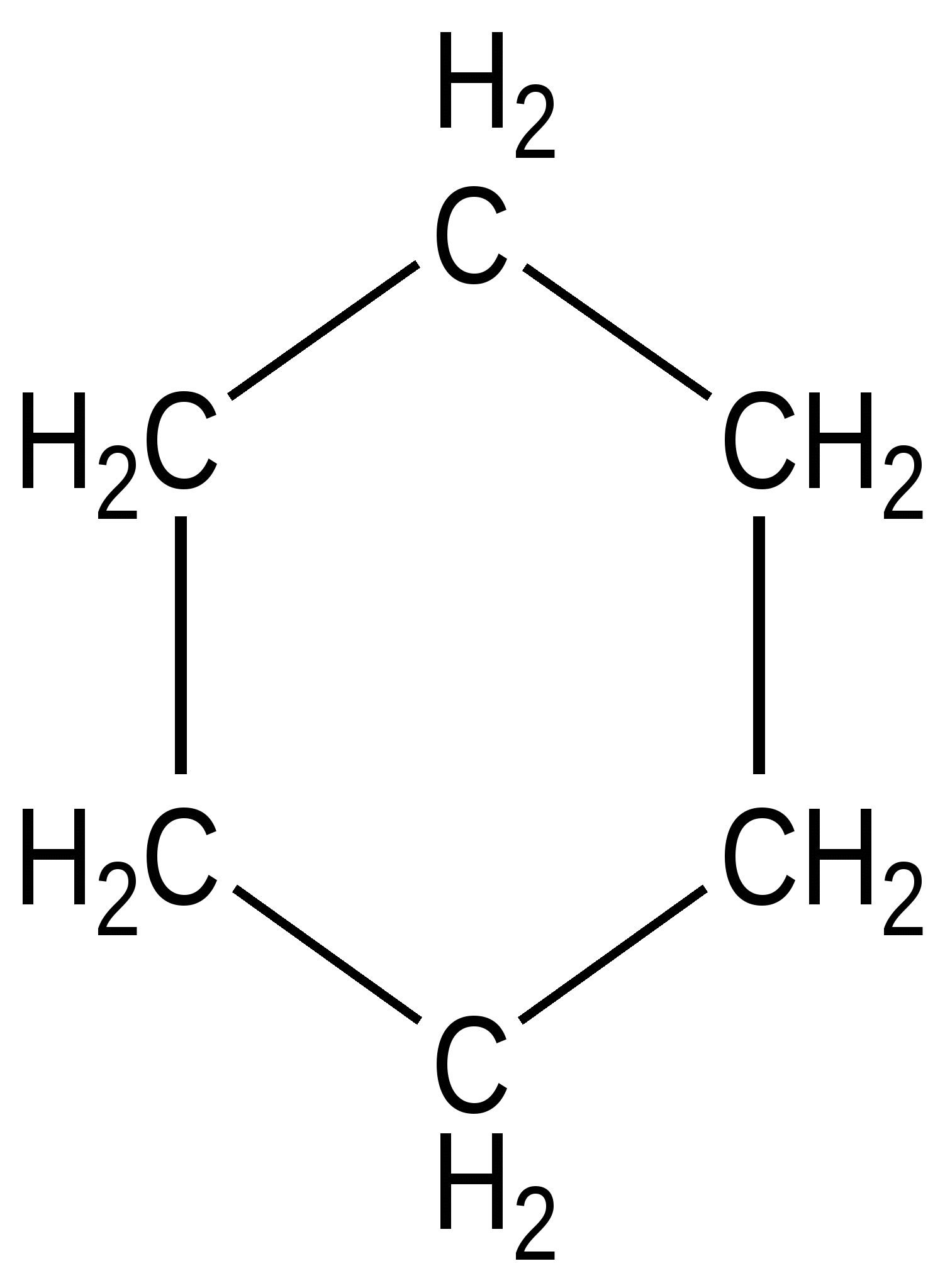 6 2 5 3 4 Различают 3 пространственных конформации : I- кресло ( chair), II- твист, III- ванна ( bath), Наиболее устойчивой пространственной формой является кресло, фактически это транс- форма 1 и 4 атомов углерода относительно 2,3, 5, 6 атомов, которые лежат в одной плоскости. Конформация твист является промежуточной между двумя остальными. Все природные вещества, имеющие в своем составе шестичленные циклы : углеводы ( крахмал, гликоген, глюкоза), холестерин , мужские и женские половые гормоны, имеют конформацию формы кресла, это обеспечивает их взаимодействие с рецепторами мембран и ферментами: .  3.4.4. Медико-биологическое значение стереоизомерии Биоорганические соединения – в большинстве своем- являются оптически активными веществами. Например, в составе белков обнаружены аминокислоты только L-ряда. Более того, случайно попадающие в организм человека аминокислоты D-ряда сразу разрушаются специальным ферментом, одним из самых «быстрых» - оксидазой D –аминокислот. Фосфолипиды, образующие липидные слои мембран клеток , относятся к L-стереоряду. Гормон адреналин, принадлежащий к L – ряду, более активен , чем D –изомер . |