Курс лекций по биоорганической химии. Курс лекций по биоорганической химии учебное пособие для студентов 1 курса очного обучения
 Скачать 4.37 Mb. Скачать 4.37 Mb.
|
|
4.2.1. Реакции электрофильного присоединения в ряду алкенов(А Е) Характерны для алкенов, содержащих изолированные и сопряженные двойные связи. В реакциях могут участвовать галогены , галогеноводороды, спирты, карбоновые кислоты, вода. Присоединение воды-гидратация- наиболее важный вид реакций invivo. Вспомним реакции , которые изучают в школьной программе органической химии: А) Присоединение галогенов- дигалогенирование. Обычно используют раствор галогена в СС14 . Обесцвечивание раствора бромной воды- качественная реакция на двойную связь. > CH=CH< + Вг2 —> > CH Вг — СHВг< дибромалкан Б) Присоединение галогеноводорода- гидрогалогенирование > CH=CH< +НВг —> > CH2 — СHВг< бромалкан В) Присоединение воды. В отличие от предыдущих реакций происходит в условиях кислотного катализа, чаще используют серную кислоту Н2 S О4 > CH=CH< +НОН ——> > CH2 — СH< | ОН алканол(спирт) Если двойная связь несимметричная, то для оценки направления реакции используют эмпирическое ( опытное) правило Марковникова (empeiria- греч- опыт ) : атом водорода присоединяется к более ”гидрированному“ атому углерода, если рядом с двойной связью расположен заместитель-донор. СН2 = СН— СН3 + НС1 ——> СН3 — СН — СН2Н пропен| 2-хлорпропан С1 Реакция идет против правила Марковникова, если рядом с двойной связью располагается заместитель- акцептор. СН2 = СН— СООН + НС1 ——> СН2 — СН — СООН пропеновая кислота | | 3-хлорпропановая кислота С1 Н Для объяснения правила Марковникова можно использовать два объяснения, используя знание о распределении электронной плотности в молекуле :
В молекулах пропена и пропеновой ( акриловой) кислоты различное распределение электронной плотности , в соответствии с этим распределением происходит присоединение заряженных частиц ( Н+ и С1– ) б – б+ СН2 = СН <— СН3 СН2 = СН —> СООН донор ( +I ) акцептор ( -I ) Механизм реакции А Е Реакционный процесс можно представить в виде нескольких стадий: 1. атака электрофилом двойной связи 2. образование π -комплекса 3. превращение π -комплекса в σ- комплекс( карбокатион). Из двух возможных карбокатионов образуется более устойчивый 4. присоединение нуклеофила, образование конечного продукта реакции Положительно заряженная частица электрофил( чаще всего Н+) ориентируется около электронов двойной связи, которые располагаются перпендикулярно σ- скелету. В поле притяжения электрофила находится отрицательно заряженный нуклеофил( в нашем конкретном случае Вг – ). Затем протон образует химическую σ- связь с одним из двух атомов углерода. Для образования связи нужна пара электронов. Поэтому соседний атом теряет свой электрон и приобретает заряд (+), получается карбокатион. Всегда возможно образование двух карбокатионов. Далее в реакции присоединения нуклеофильной частицы участвует тот карбокатион, который более устойчив. Нуклеофильная частица присоединяется с противоположной стороны по отношению к протону. На схеме представлены два возможных пути присоединения протона Н+ после образования π –комплекса ( карбокатионы I и II ). Более устойчивым является карбокатион I, поскольку заряд (+ ) который соответствует свободной электронной орбитали - компенсируется донорным действием двух соседних радикалов( метильных групп), а в карбокатионе II – только со стороны одного радикала ( этильной группы). При исследовании реакции присоединения бромоводорода к пропену установлено , что полностью образуется 2-бромпропан, и не обнаружено образование другого изомера. Схема механизма реакции А Е π –комплекс σ- комплекс-карбокатион 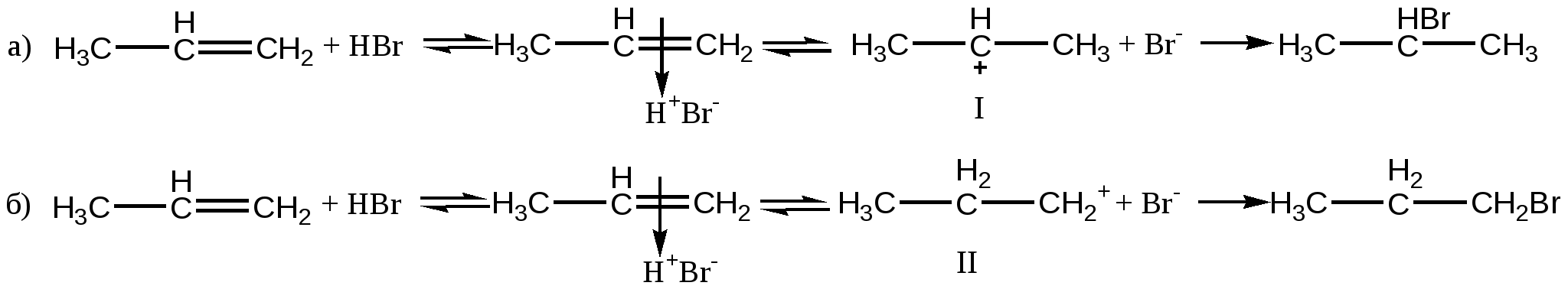 π –комплекс σ- комплек-карбокатионс π –комплекс σ- комплек-карбокатионсДонорные заместители увеличивают скорости реакций присоединения., а акцепторные – снижают, так как уменьшают электронную плотность в области двойной связи и затрудняют притяжение электрофильной частицы при образовании π –комплекса. Сравним относительные скорости реакций присоединения брома к двойной связи: Этен 1, 0 ( стандарт) Пропен 3, 0 Метилпропен( изобутен) 5, 5 2-метилбутен-2 10,4 Бромэтен 0,04 ( + М < - I ) В организме с участием ферментов непрерывно протекают реакции присоединения воды к двойной связи. Эти процессы связаны с энергетическим обменом ( реакции цикла Кребса), синтезом и окислением высших карбоновых кислот. Реакции стереоспецифичны, что означает - образуется только один стереоизомер. Фумаровая кислота + Н2О ——> D- яблочная кислота СООН Н СООН | > С=С < Н –С – ОН НООС Н | СН2 | СООН Гидратация активных форм 2,3-непредельных кислот всегда приводит к получению 3-гидроксипроизводных ( ß -гидроксикарбоновых кислот). СН 3 – СН = СН – СООН + Н2О ——> СН 3 – СН – СН2 – СООН 2-бутеновая кислота | 3-гидроксибутановая ( кротоновая) ОН ( ß –гидроксимасляная ) Задание для самостоятельной работы: запишите строение двух возможных σ –комплексов( карбокатионов), которые образуются при гидратации пропеновой (акриловой) кислоты, обсудите, какой из них более устойчив и сравните ваши выводы с направлением реакции, которая сопровождается образованием 3-гидроксипропановой кислоты. 4.2.2. Реакции нуклеофильного присоединения к карбонильной группе альдегидов и кетонов ( АN ) В карбонильной группе присутствуют две связи π и σ распределение электронной плотности, неравномерноевследствие различной электроотрицательности атомов углерода и кислорода , которые находятся в sp2 – гибридном состоянии. Создаются два центра, которые отзываются на активные частицы с противоположными зарядами ( + ) и ( - ) 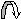 б+ б–   > С = О > С = Оэлектрофильный центр нуклеофильный центр атакует частица ( -) или с атакует частица (+ ), повышенной электронной электрофил Е+. плотностью, нуклеофил Nu Донорные заместители подают электронную плотность в сторону атома углерода и снижают величину заряда б+ . Акцепторные заместители смещают электронную плотность от атома углерода и увеличивают заряд б+, усиливая поляризацию связи ( условно изображены разные величины частичных зарядов). б+ б+ R —> СН = О R<— СН = О донор акцептор Акцепторные заместители должны увеличивать скорости реакций, а донорные заместители- уменьшать. Химические свойства карбонильных соединений: 1. реакции нуклеофильного присоединения к карбонильной группе 2. электрофильные реакции замещения у атома углерода в соседнем, α – положении к карбонильной группе. Реакции нуклеофильного присоединения Карбонильные соединения реагируют с достаточно большим количеством нуклеофилов : НОН, RОН , НСN , RSН , Н2S , RNН2 , НС1, НВг, NаНSО3( натрия гидросульфит), RNHNH2 ( гидразин). Механизм реакции становится ясным, если представить схему процесса и образование двух возможных промежуточных соединений: А) Первым атакует ( Е+) электрофил. Образуется карбокатион, на атоме углерода появляется заряд (+). Атом углерода имеет гибридизацию sp2 и тригональное строение .  б + б - ( +) б + б - ( +)> С = О + Е+ Nu– ——> > С — О — Е Б) Первым атакует (Nu–) нуклеофил. Образуется анион, отрицательный заряд локализован на атоме кислорода, атом углерода тетраэдрический, гибридизация sp3 , образует 4 ковалентные связи.  б+ б- б+ б-> С = О + Е+ Nu– ——> > С — О ( - ) | Nu Понятно, что анион( вариант Б) является более устойчивым,, чем карбокатион ( вариант А ). Известно множество примеров существования устойчивых анионов : гидроксид НО – , анионы неорганических и органических кислот RCOO– . Поэтому реакции с участием карбонильной группы проходят по механизму нуклеофильного присоединения. Для большинства реакций требуется кислая среда, которая способствует образованию карбокатиона, к которому легко присоединяется нуклеофильная частица. б+ б- + Nu > С = О + Н+ ——> > С – О —Н + ——> > С — О– + Н+ | Nu 1. Присоединение воды. Обратимая гидратация карбонильной группы происходит при растворении альдегида в воде, образуются гем-диолы, которые существуют только в растворе. Формальдегид гидратирован на 100% , ацетальдегид- на 58%, ацетон – менее 1%. Эти данные доказывают снижение реакционной способности карбонильной группы под влиянием заместителей с (+) индуктивным эффектом. Водный раствор формальдегида- формалин, w=40%, используется для изготовления анатомических и гистологических препаратов. R—СН = О + НОН <=> R—СН – ОН | ОН гидрат альдегида Трихлорэтаналь( жидкость, Т кип. 970 ) присоединяет воду и существует в виде устойчивого кристаллического соединения- хлоралгидрата СС13 СНО • Н2О, который использовали как успокаивающее и снотворное средство, и сейчас применяют в ветеринарии. Пример этого соединения подтверждает, что заместители с (–) индуктивным эффектом увеличивают реакционную способность карбонильной группы и устойчивость продуктов присоединения. ОН | С13С- СНО + НОН —> С13 С– С – ОН трихлорэтаналь | хлоралгидрат ОН
Альдегиды в кислой среде образуют полуацетали при взаимодействии со спиртами. Полуацеталь сохраняет свойства альдегида и качественные реакции, характерные для альдегидной группы( «серебряного зеркала» и др.). При действии избытка спирта полуацеталь превращается в ацеталь, который не сохраняет свойства альдегидной группы. Гидролиз полуацеталя и ацеталя возможен только в кислой среде и не возможен в щелочной. б+ б- б+ б - ROH R—СН = О + Н —ОR <=> R—СН – ОН ——> R—СН – ОR АN | SN | ОR ОR полуацеталь ацеталь Циклические полуацетали – результат внутримолекулярной реакции АN, которая возможна у гидроксиальдегидов, если гидроксигруппа находится в положении 4 или 5 в углеродной цепи. б- С  Н2– СН2– СН2 –СН2– СНО СН2 –СН2– СН–ОН Н2– СН2– СН2 –СН2– СНО СН2 –СН2– СН–ОН | <=> | | О - Н СН2 –СН2–О циклический полуацеталь 5-гидроксипентаналь шестичленный цикл носит название пирановый пространственное строение «кресло» Среди природных соединений распространены циклические полуацетали моносахаридов ( подробно в лекции по теме « Углеводы»). Полуацетали образуются в качестве промежуточных соединений при обмене пировиноградной и α – кетоглутаровой кислот при участии витамина В1 – тиаминпирофосфата. 3.Образование циангидринов- присоединение циановодорода НСN к карбонильной группе альдегидов и кетонов Реакция катализируется основаниями. т.к. НСN – слабая кислота. Циангидрины распространены в природе, в растениях они связывают синильную кислоту. В горьком миндале содержится до 2-4% циановодорода, много в вишневых и незрелых косточках абрикоса, поэтому они представляют опасность при употреблении в пищу или изготовлении варенья, компотов с косточками. Бензоциангидрин синтезируется некоторыми насекомыми и используется в качестве защиты, парализуя дыхательный центр врагов-насекомых. С6 Н5 — СН = О + НСN ——> С6 Н5 — СН — ОН | бензальдегид СN бензоциангидрин 4.Образование тиополуацеталей - присоединение тиолов( синонимы - тиоспиртов, меркаптанов) Реакция исключительно важна для понимания процессов с участием ферментов, которые в своем активном центре содержат тиольные группы аминокислоты цистеина. R—СН = О + Н —SR <=> R—СН – ОН АN | SR тиополуацеталь Образование тиополуацеталей invivo необходимо в процессе реакций биологического окисления.( см. раздел «реакции окисления биоорганических соединений).
Используют для очистки альдегидов от посторонних примесей. Продукт присоединения выпадает в осадок в спиртовом или эфирном растворе. Его отделяют, проводят гидролиз, выделяется чистый альдегид. R—СН = О + NаНSО3 <=> R—СН — О Н | SО3 – Nа+ 6. Взаимодействие с аминами и гидразинами- образование азометинов( синоним- основания Шиффа) и гидразонов В процессе взаимодействия карбонильных соединений с аминами и гидразинами реакция АN затем сопровождается элиминированием воды . Процесс можно обозначить ( АN –Е ) . R1—СН = О + NH2 – R2 <=> R1 —СН – ОН ——> Н2О + R1—СН = N – R 2 | азометин NH – R 2 Азометины- твердые кристаллические вещества, имеющие четкие температуры плавления, что позволяет проводить идентификацию альдегидов в виде оснований Шиффа. В клетках invivo образование азометинов происходит с участием витамина В 6 в процессе метаболизма природных аминокислот: декарбоксилирования и транс(пере)аминирования. Витамин В 6 существует в трех активных формах: альдегидной ( пиридоксаль ) и амино( пиридоксамин ), что позволяет ему образовывать азометины в виде альдегида и в виде амина. 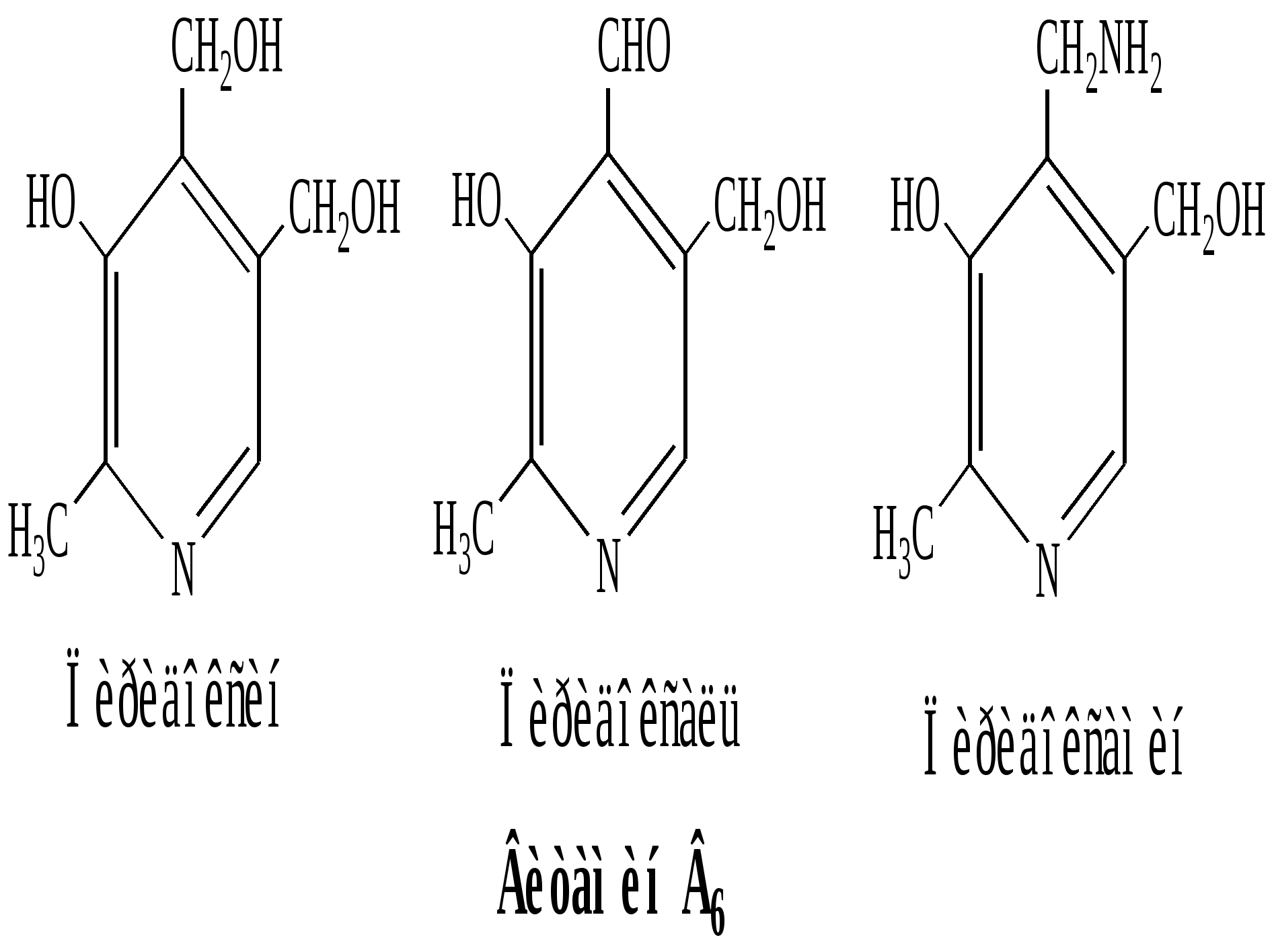 Подробно участие витамина В 6 в обмене аминокислот invivo рассматривается в лекции «Природные аминокислоты». 7. Реакции у α- углеродного атома в карбонильных соединениях α- Углеродный атом ( соседний с карбонильной или карбоксильной группой) представляет собой СН- кислотный центр. Частично эта проблема рассматривалась в лекциях «Кислотно-основные свойства биоорганических соединений», « Изомерия. Раздел : таутомерия» . Обсудим еще раз смещение электронной плотности в карбонильных соединениях.  Н б+ Смещение электронной плотности в группе Н б+ Смещение электронной плотности в группе б+ | б+ б- >С=О вызывает поляризацию всех связей СН в Н—>С —>СН = О α – положении. Возникает центр с подвижными . | атомами водорода. Н б+ СН- кислотный центр В биологических процессах с участием АТФ , ферментов и витамина биотина возможна реакция карбоксилирования карбонильных соединений и карбоновых кислот в α – положение. Таким путем в составе вещества образуется новая карбоксильная группа. Процесс связан с энергетическим, пластическим обменами, биосинтезом карбоновых кислот, азотистых оснований нуклеиновых кислот. Пировиноградная кислота + оксид углерода ( 1V) —> щавелевоуксусная кислота ( оксалоацетат) АТФ –> АДФ + фосфат СН3—С — СООН + О=С=О ————> НООС – СН2– С – СООН || | | О О 8. Альдольная конденсация Сущность реакции: реагируют два карбонильных соединения. Одно вещество- нуклеофил, другое- объект нуклеофильной атаки. Реакцию проводят в щелочной среде, которая способствует образованию отрицательно заряженной частицы- нуклеофила. ОН– СН3–СНО + СН3 –СН О < => СН3 – СН – СН2– СНО | ОН 3-гидроксибутаналь Механизм реакции: а) образование нуклеофильной частицы - карбоаниона Н б+ б+ | б+ б- Н—>С —>СН = О + ОН– — > СН2 —СН=О + НОН | (– ) Н б+ нуклеофил (карбоанион) сопряженная система б) нуклеофильная атака карбоаниона на атом углерода карбонильной группы б+ + НОН СН3–СН=О + СН2 —СН=О < => СН3 – СН – О– < => ( – ) | СН2– СН =О СН3 – СН – СН2– СНО + ОН– | ОН 3-гидроксибутаналь Реакции альдольной конденсации распространены в биологических процессах. С ними связан энергетический обмен - синтез кетоновых тел, синтез стеринового цикла холестерина, стероидных гормонов, превращения углеводов –моносахаридов( распад фруктозо-1,6-дифосфата на фосфотриозы, трансальдолазные и транскетолазные реакции в пентозофосфатном цикле, который обеспечивает клетку рибозой для синтеза рибо-нуклеиновых кислот). Большинство перечисленных реакций будут позднее изучены в курсе биоорганической химии и биохимии. 4.2.3. Реакции электрофильного замещения в ряду ароматических соединений( SE+ ) Ароматические соединения отличаются самой высокой степенью делокализации π -электронной плотности и высокой термодинамической устойчивостью. В растворе они вступают в реакции электрофильного замещения – нитрования , сульфирования, галогенирования, алкилирования, в которых сохраняется ароматическая электронная система. Чем выше степень ароматичности, тем легче идет реакция. Донорные заместители увеличивают электронную плотность в ароматической системе и облегчают реакции SE. Акцепторные заместители уменьшают электронную плотность в ароматической системе и затрудняют реакции SE . Следует вспомнить, что заместители изменяют равномерное распределение электронной плотности : доноры увеличивают частичные заряды б - в положениях 2,4,6 , а акцепторы уменьшают в этих же положениях 2,4,6 электронную плотность и создают частичный заряд б+. ( Лекция 2. Взаимное влияние атомов в молекулах биоорганических соединений. Эффекты заместителей). 1. Реакция нитрования Бензол нитруют концентрированной азотной кислотой в присутствии серной. Образуется нитробензол. Н 2S О4 С6 Н6 + НNО3 ————> С6 Н5— NО2 + Н2 О нитробензол Роль серной кислоты заключается в образовании активной электрофильной частицы- катиона нитрония. + + Н–О – NО 2 + Н + ——> Н–О – NО 2 ——> НОН + NО2 | нитроний- катион Н Многие нитропроизводные ароматических соединений обладают высокой противобактериальной и противогрибковой активностью - их используют в качестве лекарственных препаратов. Большие количества нитробензола необходимы для получения анилина( по реакции Зинина- восстановление нитрогруппы). Анилин используется в промышленности для получения разнообразных красителей и разнообразных лекарственных препаратов ( сульфаниламидов, обезболивающих – новокаина, противоопухолевых ). 2. Реация сульфирования Проводят серной кислотой, которая выполняет роль реагента и катализатора. С6 Н6 + Н 2S О4 ——> С6 Н5—S О3 Н + Н2 О сульфобензол ( синоним- бензолсульфокислота) Образование активной электрофильной частицы- катиона сульфония. + Н –О– SO3 H + Н + ——> Н–О – SO3 H ——> НОН + + SO3H | катион сульфония. Н В качестве сульфирующего средства используют также оксид серы (1V ). Сульфирование бензола и его производных играет важную роль в синтезе лекарственных средств -сульфаниламидных препаратов, в получении поверхностно активных средств. Сульфобензол является сильной кислотой, образует соли . В биохимических процессах нет аналогов реакциям нитрования и сульфирования. 3. Реакция галогенирования Проходит в присутствии катализаторов - кислот Льюиса, которые позволяют из неполярной молекулы галогена( хлора, брома) получить электрофильную частицу путем гетеролитического разрыва связи. FeCl3 С6 Н6 + С12 ——> С6 Н5 С1 + НС1 Хлорбензол Образование электрофильной частицы С1+ б+ б- С1 — С1 + FeCl3 <=> С1 –>С1 … FeCl3 <=> С1+ [ FeCl4]– Комплексное соединение. содержащее электрофил С1+ Введение йода в ароматический цикл invivo проводят с участием электрофильного йода I+ в составе йодноватистой кислоты НОI в виде протонированной частицы IОН2+. Для получения йодбензола можно применять смешанный галоген ICl- монохлорид йода. б + б- С6 Н6 + I –> Cl ———> С6 Н5 I + НС1 полярная связь йодбензол Образование именно йодбензола, а не хлорбензола, доказывает электрофильный механизм реакции замещения. В организме протекает реакция йодирования ароматической аминокислоты тирозина в процессе биосинтеза гормонов щитовидной железы – йодтиронинов. В клетках щитовидной железы происходит в окислительно- восстановительной реакции образование иона гипойодида, который осуществляет электрофильное замещение в положениях 2,4 фенольного цикла тирозина. фермент I– + Н2 О2 –———> IО– + Н2 О 4. Реакция алкилирования Самый простой метод – алкилирование по Фриделю- Крафтсу алкилгалогенидом в присутствии хлорида алюминия. R—>C1 + A1C13 <=> R—>C1… A1C13 <=> R+ [ A1C14 ] – С6 Н6 + R+ [ A1C14 ] – –———> С6 Н5 – R + НС1 + A1C13 Алкилбензол В реакциях invivo переносчиком активной метильной группы ( карбокатиона СН3+) являются витамины В12 и фолиевая кислота , а источником активного одноуглеродного карбокатиона СН 3 служат аминокислоты метионин или серин. Реакция чрезвычайно важна в синтезе тимина из урацила. 5. Реакция карбоксилирования Возможна для ароматических соединений, активированных заместителями с сильным + М эффектом, например, в синтезе салициловой кислоты, взаимодействие расплава фенолята натрия с СО 2 ( см лекцию «Лекарственные препараты»). Механизм реакции электрофильного замещения Этапы реакции:
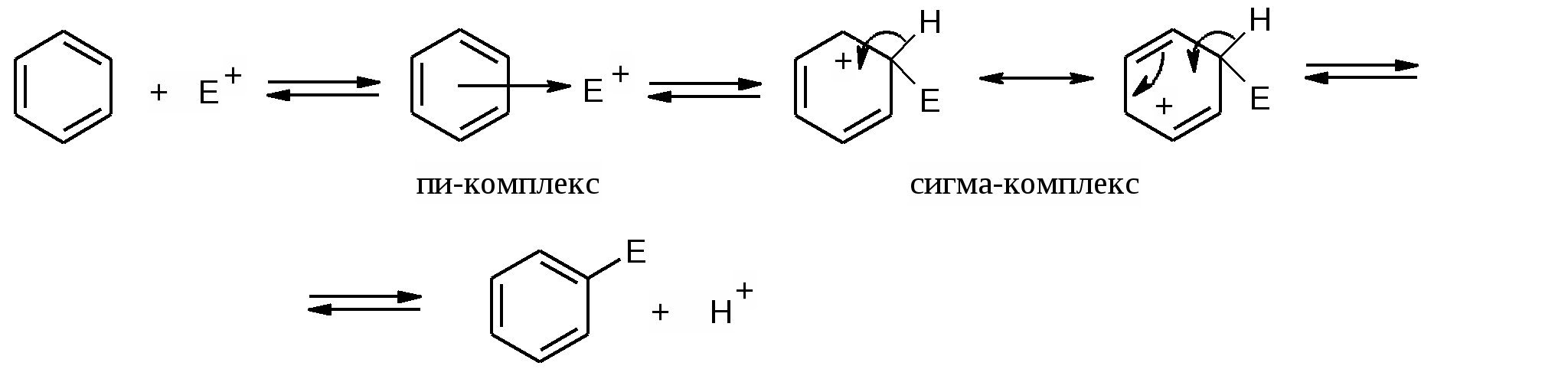 4. Чтобы вновь вернуть единую пи-электронную систему, надо в нее вернуть два электрона. Происходит « выброс» протона и два электрона возвращаются в общий ароматический секстет. 4. Чтобы вновь вернуть единую пи-электронную систему, надо в нее вернуть два электрона. Происходит « выброс» протона и два электрона возвращаются в общий ароматический секстет.4.2.4. Реакции нуклеофильного замещения ( S N ) Реакции нуклеофильного замещения заключаются в вытеснении нуклеофильной частицы, связанной с атомом углерода, другой нуклеофильной частицей. В общем виде можно представить: У – + R –> X <==> R –> У + X–  | б+ б- б- | б+ | б+ б- б- | б+У – + – C –> Х <==> У <– C – + Х – нуклеофил(1) | | нуклеофил(2) приходящая уходящая группа группа Нуклеофил должен иметь доступную электронную пару ( это может быть анион или молекула, в которой есть атом с неподеленной парой электронов) и атаковать другую молекулу по электрофильному центру, замещая имеющуюся нуклеофильную группу. Наиболее распространенными invitro являются превращения : А. Обратимая реакция: спирт – галогенопроизводное / галогенопроизводное –спирт R-OH + Н Hal <==> R- Hal + Н2 О Б. Галогенопроизводное - цианопроизводное R- Hal + Н- CN ——> R- CN + ННа1 В. Галогенопроизводное - амин R- Hal + N H3 ——> R- N H2 + НС1 Г. Этерификация ( карбоновая кислота- сложный эфир ) R COOH + R1 ОН <==> R COOR1 + Н2 О Д. Переэтерификация ( сложный эфир - другой сложный эфир ) R COOR1 + R2 ОН <==> R COOR2 + R1 ОН Е. Амидирование ( сложный эфир - амид ) R COOR1 + N H3 <==> R CO N H2 + R1 ОН Ж. Гидролиз ( сложный эфир – кислота, амид - кислота) R COOR1 + Н2 О <==> R COOH + R1 ОН R CO N H2 + Н2 О <==> R COOH + N H3 З . Образование ангидрида R COOH + R COOH <==> R C- O- С R + Н2 О | | | | О О В биохимических процессах invivo встречаются реакции ( Д – З ). Выделяют реакции SN 1 и SN 2, которые различаются между собой образованием переходных состояний , и , вследствие этого, могут сопровождаться изомерными отличиями в пространственном строении продуктов реакции. Реакция SN 2.- бимолекулярная В образовании переходного состояния участвуют оба нуклеофила : « приходящий и уходящий». Процесс присоединения одного и удаления другого – синхронный: один нуклеофил с противоположной стороны подходит, а другой уходит. Если атом углерода в электрофильном центре , у которого происходит замещение, был оптически активным, то обязательно изменяется пространственное строение – смена одного стереоряда на другой.   | б+ б- + | У – + –- C –> Х <==> У – … >С– … Х– <==> У – С – + Х – | атом углерода | атом углерода тригональный плоское атом углерода тетраэдрический строение тетраэдрический карбокатион – изменение стереоряда переходное состояние Изменение стереоряда носит название «Вальденовское обращение» по имени ученого, впервые обратившего внимание на этот процесс. Скорость реакции SN 2 зависит от концентрации обоих реагирующих веществ. V = k [ Y– ] [ RX ] Заместители- акцепторы оттягивают электронную плотность , увеличивают заряд б + на атоме углерода в электрофильном центре и увеличивают скорость реакции нуклеофильного замещения. Если уходящая группа способна к сольватации растворителем, то это обстоятельство также способствует увеличению скорости реакции. В связи с этим в реакциях invitro аминогруппа NH2, связанная с атомом углерода в sp3 - крайне редко обменивается нуклеофильно. Реакция SN 1.- мономолекулярная Для реакций invivo характерен механизм нуклеофильного замещения S N 1- мономолекулярный, что связано с участием в реакции катализатора- фермента. Этот же механизм возможен invitro в случае образования устойчивого промежуточного карбокатиона. Критерии SN1: - концентрация приходящего нуклеофила Y– не влияет на скорость реакции. - добавление в среду уходящего нуклеофила X– снижает скорость реакции. Скорость реакции S N 1 зависит от концентрации только RX и стабильности образующегося промежуточного устойчивого карбокатиона. V = k [ RX ] Устойчивость карбокатиона увеличивается под влиянием донорных заместителей, снижающих дефицит электронной плотности в реакционном центре . Увеличение устойчивости карбокатионов : СН3 + < СН3 СН2 + < ( СН3 )2 СН + < ( СН3 )3 С + Рассмотрим образование устойчивого промежуточного карбокатиона  | | | | – Сб+ —>Х б- <==> —С б+ … Хб- <==> — С + . . . Х – <==> ( – С+ ) ( Х –) | | | | переходное ионная пара ( карбокатион) ( анион) состояние сольватированные ионы Карбокатион имеет плоское строение, атом углерода в sp3 – гибридном состоянии, нуклеофильная частица может атаковать карбокатион с любой стороны плоскости. Если в реакции участвует определенный стереоизомер, то в случае механизма S N 1 возникает рацемизация- образуются два разных стереоизомера ( D и L ) в соотношении 1:1, содержащие новую нуклеофильную частицу. Ферментативные реакции invivo проходят по механизму S N 1 , образуется всегда только один стереоизомер, который необходим для осуществления биохимических процессов. Равновероятная атака нуклеофилом плоского карбокатиона с двух противоположных сторон в химической реакции in vitro У–  | |   У – С*– У – С*–+ | > С —  |  – С* –У – С* –У| У– Пример: D –бутанол-2 + НС1 ———> Н2 О + 2-хлорбутан ( рацемическая смесь) L- бутанол-2 + НС1 ———> Н2 О + 2-хлорбутан ( рацемическая смесь) рацемическая смесь CН3 СН3 | | С1 – С – Н Н – С – С1 2-хлорбутан | | С2 Н5 С 2 Н 5 энантиомеры , образуют рацемическую смесь в отношении 1:1 К биологически важным процессам нуклеофильного замещения относятся : А) образование и гидролиз сложных эфиров карбоновых кислот, синтез триглицеридов-жиров Б) образование с участием АТФ фосфорных эфиров соединений, содержащих гидроксильные группы R–ОН + АТФ —> R–О –РО3 Н2 + АДФ В) образование гликозидных связей между молекулами углеводов или углеводов с веществами других классов( спиртами, аминами, тиолами). Г) образование полимеров аминокислот- полипептидов и белков. Д) образование вторичных, третичных, четвертичных аминов, что особенно важно в синтезе адреналина, холина, кофермента НАД+.   б- б + б - б- б + б - R —NH2 + CН3 —Х ———> R —NH—CН3 + H — Х первичный амин полярная связь вторичный амин Аминогруппа , содержащая неподеленную пару электронов, несет отрицательный заряд б- , и нуклеофильно замещает ион галогенида, который является уходящей группой. Модельной реакцией синтеза динуклеотида НАД+ может служить образование катиона метилпиридиния . В процессе метилирования пиридина йодометаном образуется соль метилпиридиний йодид 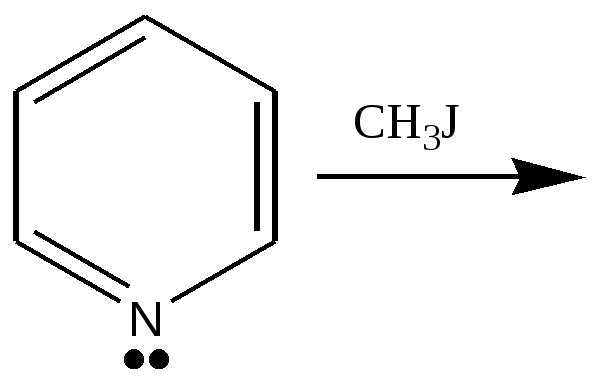  | + СН3 4.2.5. Реакции элиминирования ( E ) Реакции элиминирования invitro имеют самостоятельное значение, но и часто конкурируют с реакциями нуклеофильного замещения( происходят одновременно). Представляют собой распространенный способ образования двойной связи. Элиминирование воды из спиртов проходит при нагревании спирта с конц. серной кислотой при температуре выше 1400. В случае вторичных или третичных спиртов реакция идет по правилу Попова( упрощенно - двойная связь располагается внутри цепи) Механизм реакции элиминирования связан с образованием промежуточного карбокатиона с более устойчивой сопряженной системой. Н2S О4 концt >140 СН3 – СН2 –ОН ———————> СН2 =СН2 + НОН этанол этен Н2S О4 концt >140 CН3 – СН2 – СН – СН3 ———————> CН3 – СН = СН – СН3 + НОН | ОН бутанол-2 бутен-2 Элиминирование галогеноводорода происходит под влиянием спиртового раствора щелочи( КОН или NаОН ) спирт. р-р СН3 – СН2 –С1 + КОН ———————> СН2 =СН2 + КС1 + НОН этанол этен 4 3 2 1 КОН спирт. р-р СН3 – СН – СН2 –СООН ———————> СН 3 – СН =СН – СООН (А) | С1 2- бутеновая( кротоновая) кислота 3-хлорбутановая кислота сопряженная система СН 2 = СН– СН – СООН (В) 3- бутеновая кислота нет сопряженной системы В реакции элиминирования 3-хлорбутановой кислоты возможно образование двух изомеров ( А) и ( В) . В молекуле 3-хлорбутановой кислоты атом углерода С-2 представляет собой более сильный СН- кислотный центр по сравнению с атомом С-4, удаление протона происходит от атома С-2, возникает сопряженная система. В молекуле 3-бутеновой кислоты отсутствует сопряженная система. Ферментативные реакции элиминирования invivo имеют огромное значение в обеспечении множества метаболических процессов( реакции цикла Кребса, синтез и окисление высших жирных кислот). Эти процессы осуществляет особый класс ферментов - лиазы в условиях кислотного катализа при строгом контроле стереоизомерии ( образуется только цис- или только транс- форма ) Наиболее важные биохимические реакции гидроксилиаза СН3 – СН – СН2 –СООН < ———————> СН 3 – СН =СН – СООН + НОН | кротоновая кислота ( транс ) ОН 3-гидроксибутановая кислота (ß– гидроксимасляная) гидроксилаза НООС – СН – СН2 –СООН <———————> СН 3 – СН =СН – СООН НОН | ОН фумаровая( транс-бутендиовая) яблочная кислотая (малат) Механизм реакции элиминирования invitro . Н2S О4 концt >140 + СН3 – СН2 – О – Н + Н + ———––—— —––——> СН3 – СН2 – О – Н ——–> НОН +  (1) | (2) (1) | (2)Н Нб+ катион гидроксония | + Нб+–С –> СН2 —————————> СН2 = СН2 + Н + | карбокатион ( 3 ) алкен Нб+ СН-кислотный центр Этапы реакции: 1. Среда кислая. В растворе присутствует катион водорода. Происходит протонирование спиртовой гидроксигруппы. Образуется катион гидроксония( используется неподеленная пара электронов атома кислорода) 2. Отщепление молекулы воды. Возникает карбокатион, т.к. пара электронов возвращается для восстановления электронной оболочки атома кислорода( неподеленной пары электронов )в молекуле воды. В соседнем α - положении возникает СН- кислотный центр, атомы водорода приобретают заряды б+ . 3. Карбокатион « выбрасывает» протон Н+ из α - положения , оставшаяся пара электронов связи ( выделена красным цветом) участвует в образовании двойной связи. Катион водорода возвращается в раствор. Аналогично действует каталитический центр фермента гидролиазы, который участвует в элиминировании воды.
В органической химии приняты несложные определения реакций окисления и восстановления. Реакция окисления - изменяется состав вещества – добавляются атомы кислорода или удаляются атомы водорода. Реакции восстановления – изменяется состав вещества – удаляются атомы водорода или добавляются атомы водорода.. К процессам окисления относятся превращения, сопровождающиеся внутримолекулярным дегидрированием ( обратный процесс гидрирование – восстановление) А . С (sp3 ) ———> С (sp2 ) ———> С ( sp) алкан алкен алкин последовательность процессов окисления Б. R– СН3 ———> R– СН2 – ОН ———> R– СН О спирт альдегид В. Окисление тиолов происходит как межмолекулярная реакция дегидрирования, сопровождается , в первую очередь, образованием дисульфидов. 2 R – SH + [ O ] ———> R – S – S – R + НОН тиол дисульфид Реакция имеет большое значение в регуляции количества свободных SH групп и дисульфидных связей в белках. Окислители уменьшают содержание свободных тиольных групп, а восстановители - уменьшают число дисульфидных связей. Тиольные группы в белках играют важную роль в выполнении белками ферментативных и других функций, например, активная форма гормона инсулина содержит две дисульфидные связи. Прикрепление внеклеточных белков к мембране клетки также может осуществляться с участием дисульфидных групп ( белок фибронектин). В биохимических реакциях окисления и восстановления принимают участие ферменты – оксидоредуктазы. Белковые молекулы не могут осуществлять перенос электронов, поэтому в составе ферментов обязательно присутствуют органические молекулы или катионы металлов, способные передавать электроны , то есть существовать в окисленной и восстановленной форм е ( витамин С , липоевая кислота, кофермент НАД+ / НАДН , ФАД / ФАДН2 , гем, содержащий ионы железа (+2) / ( +3), ионы меди ( +1) / ( +2 ) и др .) Реакции окисления- дегидрирования- типичны для насыщенных атомов углерода, гидрокси, тиольной и аминогрупп. Наиболее распространенным переносчиком атомов водорода является кофермент НАД+ в реакциях окисления и кофермент НАДН в реакциях восстановления( большинство реакций обратимы) . Примеры. Окисление этанола и других алкоголей алкогольдегидрогеназой – первый этап метаболизма экзогенных спиртов, попадающих в организм в составе лекарственных препаратов, алкогольных напитков. Фермент алкогольдегидрогеназа СН3 – СН2 – О – Н + НАД+ <————————> СН3 – СН= О + НАДН + Н + этанол этаналь Превращения молочной и пировиноградной кислот друг в друга происходит во всех тканях организма. В анаэробных ( бескислородных) условиях образование лактата – конечный этап метаболизма глюкозы. Присутствие кислорода снижает образование молочной кислоты и стимулирует ее окисление в пировиноградную, процесс весьма важен для сердечной мышцы, печени. фермент лактатдегидрогеназа СН3 –СН – СООН + НАД+ <————————> СН3 – С – СООН + НАДН + Н + | | | ОН О 2-гидроксипропановая кислота 2- оксопропановая кислота молочная кислота ( лактат ) пировиноградная кислота( пируват) Механизм реакции окисления с участием кофермента НАД + Окисляемое вещество отдает два атома водорода, один – в виде иона гидрида, другой- в виде протона Атом углерода отдает два электрона химический связи атому водорода, который превращается в отрицательно заряженный анион – гидрид Н –. . Протон уходит из гидроксильной группы и оставляет два электрона связи. Эти да электрона образуют двойную связь.  Н Н –  гидрид- ион присоединяется к молекуле НАД + в положение 4 гидрид- ион присоединяется к молекуле НАД + в положение 4СН3 – С- СООН + НАД +——> СН3 – С- СООН + НАДН + Н+ | | | О •• Н О  Н+ Н+Протон переходит в раствор Оставшаяся пара электронов образует двойную связь. Кофермент НАД + принимает только один отрицательно заряженный ион гидрида, превращается в НАДН , а протон остается в растворе  удаляется 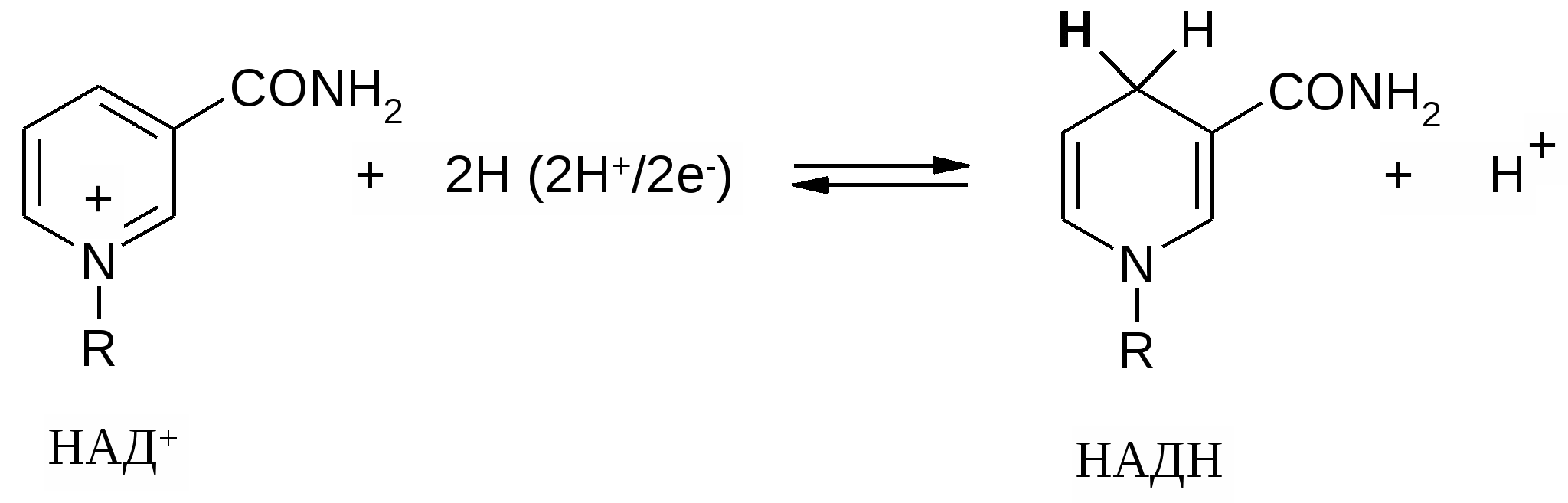 Восстановленная форма НАДН является неустойчивой, поскольку в пиридиновом цикле исчезает ароматический секстет и единая пи-электронная система. Атом углерода в положении-4 имеет тетраэдрическое строение. Именно вновь присоединенный( в виде гидрида Н–) атом водорода( он выделен жирным шрифтом) затем удаляется при окислении восстановленной формы НАДН и передается следующему окислителю( это называется « молекулярная память» ) и до образования конечных продуктов обмена ( молочная кислота в анаэробных условиях или вода в аэробных условиях) НАДН + Н+ + Х ——> НАД + + Х-Н ПРИЛОЖЕНИЕ 1 Среди веществ, производящих раздражающее действие на организм человека, имеется большая группа соединений- лакриматоров( lacrima – лат. – слеза). Их используют в качестве защитных или боевых средств. Одним из самых простых соединений является хлористый бензил( фенилхлорметан). СН2 –С1 СН2 – ОН + НС1 | + НОН ————> |   хлористый бензил бензиловый спирт При попадании в глаз, на слизистые оболочки носа, рта быстро проходит гидролиз , выделяющийся хлороводород вызывает сильное слезотечение. Промежуточный карбокатион, образующийся в реакции, устойчив, стабилизирован сопряжением с ароматической электронной системой, реакция протекает по механизму S N 1 . В одинаковых условиях скорость реакции в 99 раз больше по сравнению с хлорэтаном. Обратите внимание, что замещение галогена в хлорбензоле ( хлорбензол + NаОН ) проходит в очень жестких условиях благодаря +М эффекту , который проявляет атомом хлора, в результате чего образуется единая сопряженная система. ПРИЛОЖЕНИЕ 2 . Липоевая кислота , содержащая две тиольные группы, необходима для нормального прохождения реакций цикла Кребса во всех аэробных тканях организма, высокое соднржание отмечено в печени, миокарде, почках. Используют как лекарственный препарат в профилактических целях и при заболеваниях: атеросклерозе, гепатитах, диабете, ожирении. 8 7 6 1 СН2 – СН2 –СН – (СН2 )4– СООН 8 7 6 1 | | + ФАД <————> СН2 – СН2 –СН – (СН2 )4– СООН SH SH | | S ——— S + ФАДН2 Дигидролипоевая кислота Дегидролипоевая кислота восстановленная форма - окисленная форма - 6,8- димеркаптооктановая кислота циклический Для проверки усвоения темы рекомендуем выполнить задания:
образоваться при гидратации кротоновой кислоты ( 2 - бутеновой кислоты ). Назовите механизм реакции. Соответствует ли строение получаемой 3-гидроксибутановой кислоты представлению о механизме реакции ?
( 2-амино-3-меркаптопропановой кислоты) и образование аминокислоты цистина, которая хуже, чем цистеин, растворима в воде и может кристаллизоваться при болезни цистинурии в мочевом пузыре. Запишите уравнение реакции окисления цистеина. 3. Пара соединений: восстановленная форма гидрохинон ( 1,4- дигидроксибензол) и его окисленная форма хинон, участвуют в переносе электронов во внутренней мембране митохондрий при синтезе АТФ в аэробных условиях. Напишите формулы названных веществ. 4. Назовите механизм реакции образования медиатора ацетилхолина: АцетилКоА + холин ————> ацетилхолин + КоА Напишите формулы трех выделенных соединений.
ацетилхолина.
взаимодействии с циановодородом. Запишите уравнения и назовите механизм реакции 7. Строение азометина С6Н5 – СН = N – C6 H5 Напишите реакцию образования этого соединения. Назовите механизм реакции. Какой витамин образует основания Шиффа в процессе ферментативного катализа?. |
