Курс лекций по нормальной физиологии. Ю. И. Савченков. Красноярск Издво , 2012, 470 с
 Скачать 8.6 Mb. Скачать 8.6 Mb.
|
18.2. Интракардиальная регуляция деятельности сердца: миогенная регуляция, внутрисердечная нервная система.Сердце человека, непрерывно работая, даже при спокойном образе жизни нагнетает в артериальную систему около 10 т крови в сутки, 4000 т в год и около 300 000 т за всю жизнь. При этом сердце всегда точно реагирует на потребности организма, поддерживая постоянно необходимый уровень кровотока. Приспособление деятельности сердца к изменяющимся потребностям организма происходит при помощи ряда регуляторных механизмов. Часть из них расположена в самом сердце — это внутрисердечные регуляторные механизмы. К ним относятся внутриклеточные механизмы регуляции, регуляция межклеточных взаимодействий и нервные механизмы — внутрисердечные рефлексы. В ткани сердца кроме интрамуральных парасимпатических нейронов обнаружены и нервные клетки, относящиеся к симпатической НС, поскольку возбуждение через них передается адренэргическим путем. Интрамуральные нейроны образуют в сердце не только обычные вегетативные рефлекторные дуги, но и местные рефлекторные дуги, подобно тем, какие известны для стенки кишечника. По этим дугам возбуждение со стенок предсердий передается на мышцы желудочков и они подготавливаются к приему большего количества крови (меняется упругость, эластичность, сила сокращения миокарда). Это - проявление саморегуляции на органном уровне. Она работает даже в трансплантированном сердце. Внутриклеточные механизмы регуляции. Электронная микроскопия позволила установить, что миокард не является синцитием, а состоит из отдельных клеток — миоцитов, соединяющихся между собой вставочными дисками. В каждой клетке действуют механизмы регуляции синтеза белков, обеспечивающих сохранение ее структуры и функций. Скорость синтеза каждого из белков регулируется собственным ауторегуляторным механизмом, поддерживающим уровень воспроизводства данного белка в соответствии с интенсивностью его расходования. При увеличении нагрузки на сердце (например, при регулярной мышечной деятельности) синтез сократительных белков миокарда и структур, обеспечивающих их деятельность, усиливается. Появляется так называемая рабочая (физиологическая) гипертрофия миокарда, наблюдающаяся у спортсменов. Внутриклеточные механизмы регуляции обеспечивают и изменение интенсивности деятельности миокарда в соответствии с количеством притекающей к сердцу крови. Этот механизм получил название «закон сердца» (закон Франка—Старлинга): сила сокращения сердца (миокарда) пропорциональна степени его кровенаполнения в диастолу (степени растяжения), т. е. исходной длине его мышечных волокон. Более сильное растяжение миокарда в момент диастолы соответствует усиленному притоку крови к сердцу. При этом внутри каждой миофибриллы актиновые нити в большей степени выдвигаются из промежутков между миозиновыми нитями, а значит, растет количество резервных мостиков, т. е. тех актиновых точек, которые соединяют актиновые и миозиновые нити в момент сокращения. Следовательно, чем больше растянута каждая клетка миокарда во время диастолы, тем больше она сможет укоротиться во время систолы. По этой причине сердце перекачивает в артериальную систему то количество крови, которое притекает к нему из вен. Такой тип миогенной регуляции сократимости миокарда получил название гетерометрической(т. е. зависимой от переменной величины — исходной длины волокон миокарда) регуляции. Под гомеометрической регуляцией принято понимать изменения силы сокращений при неменяющейся исходной длине волокон миокарда. Это, прежде всего, ритмозависимые изменения силы сокращений. Если стимулировать полоску миокарда при равном растяжении с все увеличивающейся частотой, то можно наблюдать увеличение силы каждого последующего сокращения («лестница» Боудича). В качестве теста на гомеометрическую регуляцию используют также пробу Анрепа — резкое увеличение сопротивления выбросу крови из левого желудочка в аорту. Это приводит к увеличению в определенных границах силы сокращений миокарда. При проведении пробы выделяют две фазы. Вначале при увеличении сопротивления выбросу крови растет конечный диастолический объем и увеличение силы сокращений реализуется по гетерометрическому механизму. На втором этапе конечный диастолический объем стабилизируется, и возрастание силы сокращений определяется гомеометрическим механизмом. Регуляция межклеточных взаимодействий. Установлено, что вставочные диски, соединяющие клетки миокарда, имеют различную структуру. Одни участки вставочных дисков выполняют чисто механическую функцию, другие обеспечивают транспорт через мембрану кардиомиоцита необходимых ему веществ, третьи — нексусы, или тесные контакты, проводят возбуждение с клетки на клетку. Нарушение межклеточных взаимодействий приводит к асинхронному возбуждению клеток миокарда и появлению сердечных аритмий. 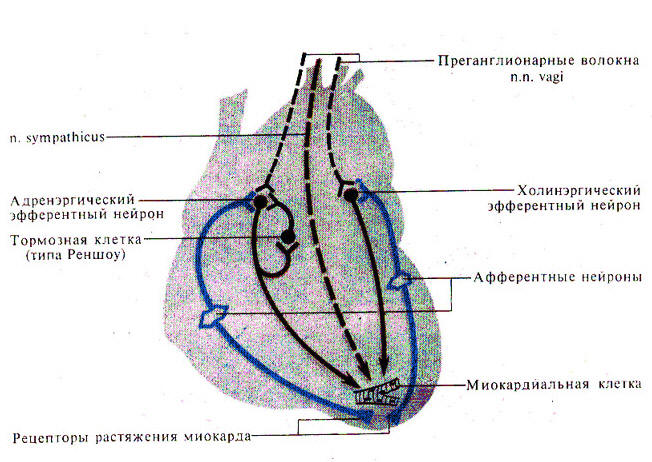 Рис. 29. Схема внутрисердечной рефлекторной дуги К межклеточным взаимодействиям следует отнести и взаимоотношения кардиомиоцитов с соединительнотканными клетками миокарда. Последние представляют собой не просто механическую опорную структуру. Они поставляют для сократительных клеток миокарда ряд сложных высокомолекулярных продуктов, необходимых для поддержания структуры и функции сократительных клеток. Подобный тип межклеточных взаимодействий получил название креаторных связей (Г. И. Косицкий). Внутрисердечные периферические рефлексы. Более высокий уровень внутриорганной регуляции деятельности сердца представлен внутрисердечными нервными механизмами. Обнаружено, что в сердце возникают так называемые периферические рефлексы, дуга которых замыкается не в ЦНС, а в интрамуральных ганглиях миокарда. После гомотрансплантации сердца теплокровных животных и дегенерации всех нервных элементов экстракардиального происхождения в сердце сохраняется и функционирует внутриорганная нервная система, организованная по рефлекторному принципу. Эта система включает афферентные нейроны, дендриты которых образуют рецепторы растяжения на волокнах миокарда и венечных (коронарных) сосудах, вставочные и эфферентные нейроны. Аксоны последних иннервируют миокард и гладкие мышцы коронарных сосудов. Указанные нейроны соединяются между собой синаптическими связями, образуя внутрисердечные рефлекторные дуги.  Рис. 30. Изменение силы сокращения левого желудочка сердечно-легочного препарата кошки при растяжении стенки правого предсердия резиновым баллончиком Внутрисердечные нейроны почти все холинергические (парасимпатические). На них, а также на МИФ клетках (малых интенсивно флюоресцирующих клетках — разновидности нейронов, находящихся практически во всех вегетативных ганглиях), заканчиваются терминали холинергических аксонов блуждающего нерва. В экспериментах показано, что увеличение растяжения миокарда правого предсердия (в естественных условиях оно возникает при увеличении притока крови к сердцу) приводит к усилению сокращений миокарда левого желудочка. Таким образом, усиливаются сокращения не только того отдела сердца, миокард которого непосредственно растягивается притекающей кровью, но и других отделов, чтобы «освободить место» притекающей крови и ускорить выброс ее в артериальную систему. Доказано, что эти реакции осуществляются с помощью внутрисердечных периферических рефлексов (Г. И. Косицкий). Подобные реакции наблюдаются лишь на фоне низкого исходного кровенаполнения сердца и незначительной величины давления крови в устье аорты и коронарных сосудах. Если камеры сердца переполнены кровью и давление в устье аорты и коронарных сосудах высокое, то растяжение венозных приемников в сердце угнетает сократительную активность миокарда, в аорту выбрасывается меньшее количество крови, а приток крови из вен затрудняется. Подобные реакции играют важную роль в регуляции кровообращения, обеспечивая стабильность кровенаполнения артериальной системы. Гетерометрический и гомеометрический механизмы регуляции силы сокращения миокарда могут привести лишь к резкому увеличению энергии сердечного сокращения в случае внезапного повышения притока крови из вен или повышения артериального давления. Казалось бы, что при этом артериальная система не защищена от губительных для нее внезапных мощных ударов крови. В действительности же таких ударов не возникает благодаря защитной роли, осуществляемой рефлексами внутрисердечной нервной системы. Переполнение камер сердца притекающей кровью (равно как и значительное повышение давления крови в устье аорты, коронарных сосудов) вызывает снижение силы сокращений миокарда посредством внутрисердечных периферических рефлексов. Сердце при этом выбрасывает в артерии в момент систолы меньшее, чем в норме, количество содержащейся в желудочках крови. Задержка даже небольшого дополнительного объема крови в камерах сердца повышает диастолическое давление в его полостях, что вызывает снижение притока венозной крови к сердцу. Излишний объем крови, который при внезапном выбросе его в артерии мог бы вызвать пагубные последствия, задерживается в венозной системе. Опасность для организма представляло бы и уменьшение сердечного выброса, что могло бы вызвать критическое падение артериального давления. Такую опасность также предупреждают регуляторные реакции внутрисердечной системы. Недостаточное наполнение кровью камер сердца и коронарного русла вызывает усиление сокращений миокарда посредством внутрисердечных рефлексов. При этом желудочки в момент систолы выбрасывают в аорту большее, чем в норме, количество содержащейся в них крови. Это и предотвращает опасность недостаточного наполнения кровью артериальной системы. К моменту расслабления желудочки содержат меньшее, чем в норме, количество крови, что способствует усилению притока венозной крови к сердцу. Взаимодействие внутрисердечных и внесердечных нервных регуляторных механизмов. В естественных условиях внутрисердечная нервная система не является автономной. Она — лишь низшее звено сложной иерархии нервных механизмов, регулирующих деятельность сердца. Следующим, более высоким звеном этой иерархии являются сигналы, поступающие по блуждающим и симпатическим нервам, осуществляющие процессы экстракардиальной нервной регуляции сердца. Центры блуждающих и симпатических нервов являются второй ступенью иерархии нервных центров, регулирующих работу сердца. Интегрируя рефлекторные и нисходящие из высших отделов головного мозга влияния, они формируют сигналы, управляющие деятельностью сердца, в том числе определяющие ритм его сокращений. Более высокая ступень этой иерархии — центры гипоталамической области. При электрическом раздражении различных зон гипоталамуса наблюдаются реакции сердечно-сосудистой системы, по силе и выраженности намного превосходящие реакции, возникающие в естественных условиях. При локальном точечном раздражении некоторых пунктов гипоталамуса удавалось наблюдать изолированные реакции: изменение ритма сердца, или силы сокращений левого желудочка, или степени расслабления левого желудочка и т. д. Таким образом, удалось выявить, что в гипоталамусе имеются структуры, способные регулировать отдельные функции сердца. В естественных условиях эти структуры не работают изолированно. Гипоталамус представляет собой интегративный центр, который может изменять любые параметры сердечной деятельности и состояние любых отделов сердечно-сосудистой системы с тем, чтобы обеспечить потребности организма при поведенческих реакциях, возникающих в ответ на изменение условий окружающей (и внутренней) среды. Гипоталамус является лишь одним из уровней иерархии центров, регулирующих деятельность сердца. Он — исполнительный орган, обеспечивающий интегративную перестройку функций сердечно-сосудистой системы (и других систем) организма по сигналам, поступающим из расположенных выше отделов мозга — лимбической системы или новой коры. Раздражение определенных структур лимбической системы или новой коры наряду с двигательными реакциями изменяет функции сердечно-сосудистой системы: артериальное давление, частоту сердечных сокращений и т. д Анатомическая близость в коре большого мозга центров, ответственных за возникновение двигательных и сердечно-сосудистых реакций, способствует оптимальному вегетативному обеспечению поведенческих реакций организма. |
