Курс лекций Теплотехника Раздел I. Техническая термодинамика Тема Введение. Основные понятия и определения Введение Термодинамическая система
 Скачать 1.05 Mb. Скачать 1.05 Mb.
|
Тема 3. Второй закон термодинамики.1. Основные положения второго закона термодинамикиПервый закон термодинамики утверждает, что теплота может превращаться в работу, а работа в теплоту и не устанавливает условий, при которых возможны эти превращения. Превращение работы в теплоту происходит всегда полностью и безусловно. Обратный процесс превращения теплоты в работу при непрерывном её переходе возможен только при определенных условиях и не полностью. Теплота сам собой может переходит от более нагретых тел к холодным. Переход теплоты от холодных тел к нагретым сам собой не происходит. Для этого нужно затратить дополнительную энергию. Таким образом для полного анализа явления и процессов необходимо иметь кроме первого закона термодинамики еще дополнительную закономерность. Этим законом является второй закон термодинамики. Он устанавливает, возможен или невозможен тот или иной процесс, в каком направлении протекает процесс, когда достигается термодинамическое равновесие и при каких условиях можно получить максимальную работу. Формулировки второго закона термодинамики. Для существования теплового двигателя необходимы 2 источника – горячий источник и холодный источник (окружающая среда). Если тепловой двигатель работает только от одного источника то он называется вечным двигателем 2-го рода. 1 формулировка (Оствальда): "Вечный двигатель 2-го рода невозможен". Вечный двигатель 1-го рода это тепловой двигатель, у которого L>Q1, где Q1 - подведенная теплота. Первый закон термодинамики "позволяет" возможность создать тепловой двигатель полностью превращающий подведенную теплоту Q1в работу L, т.е. L = Q1. Второй закон накладывает более жесткие ограничения и утверждает, что работа должна быть меньше подведенной теплоты (L Вечный двигатель 2-го рода можно осуществить, если теплоту Q2 передать от холодного источника к горячему. Но для этого теплота самопроизвольно должна перейти от холодного тела к горячему, что невозможно. Отсюда следует 2-я формулировка (Клаузиуса): "Теплота не может самопроизвольно переходит от более холодного тела к более нагретому". Для работы теплового двигателя необходимы 2 источника – горячий и холодный. 3-я формулировка (Карно): "Там где есть разница температур, возможно совершение работы". Все эти формулировки взаимосвязаны, из одной формулировки можно получить другую. 3.2. ЭнтропияОдним из функций состояния термодинамической системы является энтропия. Энтропией называется величина определяемая выражением:dS = dQ / T. [Дж/К] (3.1)или для удельной энтропии:ds = dq / T. [Дж/(кг·К)] (3.2) Энтропия есть однозначная функция состояния тела, принимающая для каждого состояния вполне определенное значение. Она является экстенсивным (зависит от массы вещества) параметром состояния и в любом термодинамическом процессе полностью определяется начальным и конечным состоянием тела и не зависит от пути протекания процесса. Энтропию можно определить как функцию основных параметров состояния:S = f1(P,V) ; S = f2(P,T) ; S = f3(V,T) ; (3.3)или для удельной энтропии:s = f1(P,υ) ; s = f2(P,T) ; S = f3(υ,T) ; (3.4) Так как энтропия не зависит от вида процесса и определяется начальными и конечными состояниями рабочего тела, то находят только его изменение в данном процессе, которые можно найти по следующим уравнениям: s = cv·ln(T2/T1) + R·ln(υ 2/υ 1) ; (3.5) s = cp·ln(T2/T1) - R·ln(P2/P1) ; (3.6) s = cv·ln(Р2/Р1) + cр·ln(υ 2/υ 1) . (3.7) Если энтропия системы возрастает (s > 0), то системе подводится тепло. Если энтропия системы уменьшается (s < 0), то системе отводится тепло. Если энтропия системы не изменяется (s = 0, s = Const), то системе не подводится и не отводится тепло (адиабатный процесс). 3.3. Цикл и теоремы КарноЦиклом Карно называется круговой цикл, состоящий из 2-х изотермических и из 2-х адиабатных процессов. Обратимый цикл Карно в p,υ- и T,s- диаграммах показан на рис.3.1. 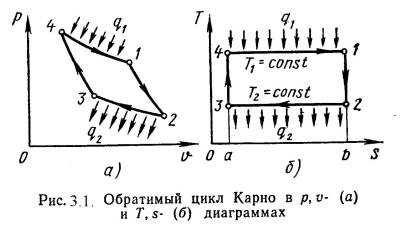 1-2 – обратимое адиабатное расширение при s1=Const. Температура уменьшается от Т1 до Т2. 2-3 – изотермическое сжатие, отвод теплоты q2 к холодному источнику от рабочего тела. 3-4 – обратимое адиабатное сжатие при s2=Const. Температура повышается от Т3 до Т4. 4-1 – изотермическое расширение, подвод теплоты q1 к горячего источника к рабочему телу. Основной характеристикой любого цикла является термический коэффициент полезного действия (т.к.п.д.). t = Lц / Qц , (3.8) или t = (Q1 – Q2) / Q1 . Для обратимого цикла Карно т.к.п.д. определяется по формуле: tк = (Т1 – Т2) / Т1 . (3.9) Отсюда следует 1-я теорема Карно: "Термический к.п.д. обратимого цикла Карно не зависит от свойств рабочего тела и определяется только температурами источников". Bиз сравнения произвольного обратимого цикла и цикла Карно вытекает 2-я теорема Карно: "Обратимый цикл Карно является наивогоднейшим циклом в || заданном интервале температур" Т.е. т.к.п.д. цикла Карно всегда больше т.к.п.д. произвольного цикла: tк > t . (3.10) Тема 4. Термодинамические процессы4.1. Метод исследования т/д процессовКак сказано выше первый закон т/д устанавливает взаимосвязь между количеством теплоты, внутренней энергией и работой. При этом, количество теплоты подводимое к телу или отводимое от тела зависит от характера процесса. К основным т/д процессам относятся: изохорный, изотермический, изобарный и адиабатный. Для всех этих процессов устанавливается общий метод исследования, который заключается в следующем:
u = сvм|0t2·t2 - сvм|0t1·t1. (4.1) или при постоянной теплоемкости U = m·сv·(t2 - t1); (4.2) вычисляется работа: L = P·(V2 – V1); (4.3) определяется количество теплоты, участвующее в процессе: q = cx·(t2- t1); (4.4) определяется изменение энтальпии по формуле, справедливой для всех процессов идеального газа: i = (i2 – i1) = сpм|0t2·t2 – сpм|0t1·t1, (4.5) или при постоянной теплоемкости: i = сp·(t2 – t1); (4.6) определяется изменение энтропии: s = cv·ln(T2/T1) + R·ln(υ 2/υ 1) ; (4.7) s = cp·ln(T2/T1) - R·ln(P2/P1) ; (4.8) s = cv·ln(T2/T1) + cp·ln(υ 2/υ 1) . (4.9) Все процессы рассматриваются как обратимые. 4.2. Изопроцессы идеального газа1). Изохорный процесс (Рис.4.1). = Const , 2 = 1. (4.10) Уравнение состояния процесса: P2 / P1 = T2 / T1. (4.11) Так как υ 2 = υ 1, то l = 0 и уравнение 1-го закона т/д имеет вид: q = u = = сv·(t2 - t1); (4.12)  2). Изобарный процесс (Рис.4.2). P = Const , P2 = P1 Уравнение состояния процесса: 2 / 1 = T2 / T1 , (4.13) Работа этого процесса: l = P·( 2 - 1). (4.14) Уравнение 1-го закона т/д имеет вид: q = u + l = ср·(t2 - t1); (4.15) 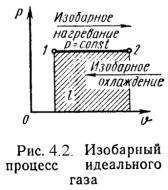 3). Изотермический процесс (Рис.4.3). Т = Const , Т2 = Т1 Уравнение состояния: P1 / P2 = 2 / 1 , (4.16) Так как Т2 = Т1, то u = 0 и уравнение 1-го закона т/д будет иметь вид: q = l = R·T·ln( 2/ 1), (4.17) или q = l = R·T·ln(P1/P2), (4.18) где R = R/ – газовая постоянная [Дж/(кг·К)]. 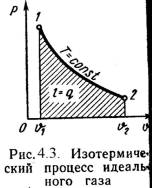 4). Адиабатный процесс (Рис.4.4). В данном процессе не подводится и не отводится тепло, т.е. q =0. Уравнение состояния: P· = Const, (4.19) где = cp / cv – показатель адиабаты. Уравнение 1-го закона т/д будет иметь вид: l = -u = = -сv·(t2 – t1) = сv·(t1 – t2), (4.20) или l = R·(T1 – T2) / ( -1); (4.21) l = R·T1·[1 – ( 1/ 2) -1] /( – 1); (4.22) l = R·T2·[1 – (P2/P1) ( -1)/ ] /( – 1). (4.23)  4.3. Политропный процессПолитропным процессом называется процесс, все состояния которого удовлетворяются условию: P· n = Const, (4.24) где n – показатель политропы, постоянная для данного процесса. Изобарный, изохорный, изотермический и адиабатный процессы являются частными случаями политропного процесса (Рис.4.5): при n = ± = Const, (изохорный), n = 0 P = Const, (изобарный), n = 1 T = Const, (изотермический), n = P· = Const, (адиабатный). Работа политропного процесса определяется аналогично как при адиабатном процессе: l = R·(T1 – T2) / (n – 1); (4.25) l = R·T1·[1 – ( 1/ 2) n-1] /(n – 1); (4.26) l = R·T2·[1 – (P2/P1) (n-1)/ n] /(n – 1). (4.27) Теплота процесса: q = cn ·(T2 – T1), (4.28) где cn = cv ·(n - )/(n – 1) – массовая теплоемкость (4.29) политропного процесса. 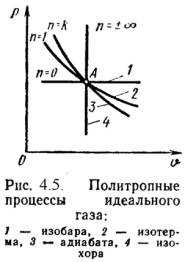 Тема 5. Термодинамика потока5.1. Первый закон термодинамики для потокаНа практике при рассмотрении рабочих процессов машин, аппаратов и устройств, встречаются задачи изучении закономерностей движения рабочих тел (газов, пара и жидкостей). Уравнение 1-го закона термодинамики для потока газа при следующих допущениях:
имеет вид: q = u + e + lпрот. + lтехн. , (5.1) где e = (w22 – w21)/2 + g·(z2 –z1) – изменение энергии системы, состоящий из изменения кинетической и потенциальной энергий; w1 ,w2 – скорости потока в начале и в конце канала; z1 , z2 – высота положения начала и конца канала.
q = (u2 – u1) + (w22 – w21)/2 + g·(z2 –z1) + P2· 2 – P1· 1 + lтехн. (5.2) Введем понятия энтальпии, который обозначим через величину: h = u + Pх , (5.3) h2 = u2 + P2· 2 ; h1 = u1 + P1· 1 . (5.4) Тогда уравнение 1-го закона термодинамики для потока газа будет иметь вид: q = h2 – h1 + (w22 – w21)/2 + g·(z2 –z1) + lтехн. (5.5) 5.2. Критическое давление и скорость. Сопло ЛаваляЕсли перемещение газа по каналу происходит его расширение с уменьшением давления и увеличением скорости, то такой канал называется соплом. Если в канале происходит сжатие рабочего тела с увеличением его давления и уменьшением скорости, то такой канал называют диффузором. В каналах при небольшой разности давлений газа и внешней среды скорость течения рабочего тела достаточно большая. В большинстве случаев длина канала небольшая и процесс теплообмена между стенкой и газом незначителен, поэтому процесс истечения газа можно считать адиабатным. Скорость истечения (на выходе канала) определяется из уравнения:w = w2 = v 2(h1 – h2) . (5.6) или w = v 2/( - 1)·P1·х 1 [1 – (P2/P1)(-1)/]. (5.7) Массовый секундный расход газа, [кг/с]: m = f·w/х 2 , (5.8) где: f – площадь сечения канала на выходе. Так как процесс истечения адиабатный, то: m = f· 2/( - 1)·P1/х 1·[(P2/P1)2/ – (P2/P1)(+1)/]. (5.9) Массовый секундный расход идеального газа зависит от площади выходного канала, начального состояния газа и степени его расширения. Критическим давлениемназывается такое давление на выходном сечении канала, при котором достигается максимальный расход газа и определяется следующим выражением: PК = P2 = К·P1 , (5.10) где: PК = (2/( + 1))г/(г-1) . для одноатомных газов: =1,66 К = 0,49 ; для двухатомных газов: =1,4 К = 0,528 ; для трехатомных газов: =1,3 К = 0,546 . Критической скоростью называется скорость газа в выходном сечении канала, при давлении равном или меньшем критического - PК. wК = 2(/( + 1))·P1·х 1 . (5.11) Критическая скорость зависит при истечении идеального газа только от начальных параметров, его природы и равна скорости звука газа (а) при критических параметрах. wК = а = ·PК·хК . (5.12) Комбинированное сопло Лаваля предназначено для использования больших перепадов давления и для порлучения скоростей истечения, превышающих критическую или скорость звука. Сопло Лаваля состоит из короткого суживающегося участка и расширяющейсяя конической насадки (Рис.5.1). Опыты показывают, что угол конусности расширяющейся части должен быть равен = 8-12о. При больших углах наблюдается отрыв струи от стенок канала. 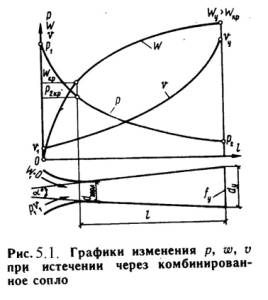 Скорость истечения и секундный расход идеального газа определяются по формулам (5.7) и (5.9). Длину расширяющейся части сопла можно определить по уравнению: l = (D – d) / 2·tg(/2) , (5.13) где: - угол конусности сопла; D - диаметр выходного отверстия; d - диаметр сопла в минимальном сечении. 5.3. ДросселированиеДросселированием называется явление, при котором пар или газ переходит с высого давления на низкое без совершения внешней работы и без подвода или отвода теплоты. Такое явление происходит в трубопроводе, где имеется место сужения проходного канала (Рис.5.2). При таком сужении, вследствие сопротивлений, давление за местом сужения - Р2, всегда меньше давления перед ним – Р1. 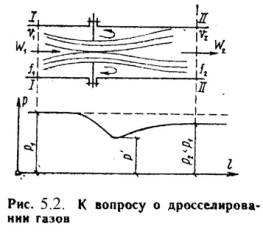 Любой кран, вентиль, задвижка, клапан и прочие местные сопротивления, уменьшающие проходное сечение трубопровода, вызывают дросселирования газа или пара, следовательно падения давления. В большинстве случаев это явление приносит безусловный вред. Но иногда оно является необходим и создается искусственно (регулирование паровых двигателей, в холодильных установках, в приборах для измерения расхода газа и т.д.). При прохождении газа через отверстие, кинетическая энергия газа и его скорость в узком сечении возрастают, что сопровождается падением температуры и давления. Газ, протекая через отверстие, приходит в вихревое движение. Часть его кинетической энергии затрачивается на образование этих вихрей и превращается в теплоту. Кроме того, в теплоту превращается и работа, затраченная на преодоление сопротивлений (трение). Вся эта теплота воспринимается газом, в результате чего температура его изменяется (уменьшается или увеличивается). В отверстие скорость газа увеличивается. За отверстием газ опять течет по полному сечению и скорость его вновь понижается. А давление увеличивается, но до начального значения оно не поднимается; некоторое изменение скорости произойдет в связи с увеличением удельного объема газа от уменьшения давления. Дросселирование является необратимым процессом, при которм происходит увеличение энтропии и уменьшение работоспособности рабочего тела. Уравнением процесса дросселирования является следующее уравнение:i1 = i2 . (5.14) Это равенство показывает, что энтальпия в результате дросселирования не изменяется и справедливо только для сечений, достаточно удаленных от сужения. Для идеальных газов энтальпия газа является однозначной функцией температуры. Отсюда следует, что при дросселировании идеального газа его температура не изменяется (Т1 = Т2). При дросселировании реальных газов энтальпия газа остается постоянной, энтропия и объем увеличиваются, давление падает, а температура изменяется (увеличивается, уменьшается или остется неизменной). Изменение температуры жидкостей и реальных газов при дросселировании называется эффектом Джоуля-Томсона. Для идеального газа эффект Джоуля-Томсона равен нулю. Различают дифференциальный температурный эффект, когда давление и температура изменяются на бесконечно малую величину, и интегральный температурный эффект, при котором давление и температура изменяются на конечную величину. Дифференциальный температурный эффект обозначается - б: = (T/P)i . (5.15) Интегральный температурный эффект определяется из следующего уравнения: T = T2 – T1 = [T·(/T)p – ] / cp dP . (5.16) Для реальных газов T0 и может иметь положительный или отрицательный знак. Состояние газа, при котором температурный эффект меняет свой знак, называется точкой инверсии, а температура, соответствующая этой точке, называется температуройинверсии- Тинв. Тинв = ·(Т/ )p . (5.17) Тема 6. Реальные газы. Водяной пар. Влажный воздух6.1. Свойства реальных газовРеальные газы отличаются от идеальных газов тем, что молекулы этих газов имеют объемы и связаны между собой силами взаимодействия, которые уменьшаются с увеличением расстояния между молекулами. При практических расчетах различных свойств реальных газов наряду с уравнением состояния применяется отношение P·/(R·T)=c, которая называется коэффициентом сжимаемости. Так как для идеальных газов при любых условиях P· = R·T, то для этих газов с = 1. Тогда величина коэффициента сжимаемости выражает отклонение свойств реального газа от свойств идеального. Величина с для реальных газов в зависимости от давления и температуры может принимать значения больше или меньше единицы и только при малых давлениях и высоких температурах она практически равна единице. Тогда реальные газы можно рассматривать как идеальные. В связи с отличием свойств реального газа от свойств идеального газа нужно иметь новые уравнения состояния, которые связывали бы значения P, х, T и давали бы возможность рассчитывать некоторые свойства газов для разных условий. Были предложены многочисленное число различных уравнений состояния реальных газов, но ни одно из них не решает проблему для общего случая. Развитие кинетической теории газов, позволило установит точное уравнение состояния реальных газов в виде: P· = R·[1 - /( + 1)·B / ]. (6.1) B – вириальные коэффициенты, выражаются через потенциальные энергию взаимодействия молекул данного газа и температуру Т. Однако это уравнение в общем виде не может быть использовано для непосредственных расчетов реальных газов. Для отдельных частных случаях получены расчетные уравнения того или иного реального газа. Из-за сложности вычисления вириальных коэффициентов обычно ограничиваются расчетом первых двух коэффициентов. Тогда расчетное уравнение имеет вид: P· = R·(1 – А/ - B/ 2), (6.2) где А и В - первый и второй вириальные коэффициенты, являющиеся функцией только температуры. При расчете свойств многих реальных газов уравнения такого типа получили большое распространение. 6.2. Уравнения состояния реального газаНаиболее простым и качественно верно отображающим поведение реального газа, является уравнение Ван-дер-Ваальса: (P + a/2)·( – b) = R·T . (6.3) а, b – постоянные величины, первая учитывает силы взаимодействия, вторая учитывает размер молекул. a/2 – характеризует добавочное давление, под которым находится реальный газ вследствие сил сцепления между молекулами и называется внутренним давлением. Для жидких тел это давление имеет большие значения (например, для воды при 200С составляет 1050 Мпа), а для газов из-за малых сил сцепления молекул оно очень мало. Поэтому внешнее давление, под которым находится жидкость, оказывает ничтожное влияние на её объем, и жидкость считают несжимаемой. В газах в виду малости значения a/2 внешнее давление легко изменяет их объем. Уравнение Ван-дер-Ваальса качественно верно отображает поведение жидких и газообразных веществ, для двухфазных состояний оно неприменимо. На PV – диаграмме (рис.6.1) показаны изотермы построенные по уравнению Ван-дер-Ваальса. Из кривых видно, что при сравнительно низких температурах имеются волнообразные участки. Чем выше температура, тем короче эти части кривых. Эти волнообразные кривые указывают на непрерывный переход от жидкого состояния в парообразное при данной температуре. Точка А соответствует состоянии жидкости, точка В относится парообразному состоянии вещества. 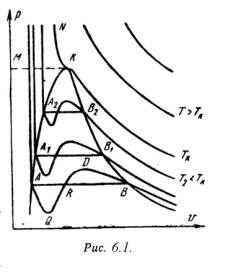 В действительности переход из жидкого состояния в парообразное всегда происходит через двухфазное состояние вещества. При этом при данной температуре процесс перехода происходит также и при постоянном давлении. Этот действительный переход из жидкого состояния в парообразное изображается прямой линией АВ. Практически для особо чистых веществ возможно осуществление участков волнообразной кривой AQ и DB. В первом случае имеют место неустойчивые состояния перегретой жидкости, а во втором – переохлажденного пара. При определенной температуре изотерма уравнения Ван-дер-Ваальса не будет иметь волнообразного участка (точка К). Эту температуру называют критической. Если соединить точки А1, А2, А3 … и В1, В2, В3 ... получим кривую похожую на параболу. Кривая АК называется нижней пограничной кривой и соответствует в состоянии кипения жидкости. Кривая КВ называется верхней пограничной кривой и соответствует состояния сухого насыщенного пара. Таким образом, для реального вещества PV – диаграмму можно разбить на 3 области: 1 - область жидкого состояния, расположена левее нижней пограничной кривой; 2 - область двухфазных состояний (влажный пар), расположена между нижней и верхней пограничной кривой); 3 – область перегретого пара, расположена правее верхней пограничной кривой и выше критической точки. Условно область жидкости ограничивают сверху линией КМ – критическая изобара. Критическую температуру Д.И.Менделеев называл абсолютной температуройкипения, при которой поверхностное натяжение в жидкости становится равным нулю, т.е. исчезает различие между жидкостью и парообразным состоянием вещества (насыщенным паром). Связь между критическими параметрами и постоянными уравнения Ван-дер-Ваальса: Тк = 8·а/(27·R·b) ; Pк = a/(27·b2) ; (6.4) а = (27· R2 ·Т2к)/(64 ·Pк) ; b = (27· R ·Тк)/(8 ·Pк). (6.5) Уравнение Ван-дер-Ваальса при больших плотностях газа дает значительные ошибки. Кроме этого экспериментальным путем доказана, что коэффициенты а, b зависят от температуры и давления, причем эта зависимость очень сложная. М.П.Вукалович и И.И.Новиков в 1939 г. предложили новое универсальное уравнение состояния реальных газов с учетом ассоциации и диссоциации их молекул, который имеет следующий вид: (P + a/2)·( – b) = R·T (1 – С/( ·Т(3+2m)/2), (6.6) где a, b – постоянные уравнения Ван-дер-Ваальса; С, m – постоянные, определяемые на основании опытных данных. 6.3. Понятия о водяном пареОдним из распространенным рабочим телом в паровых турбинах, паровых машинах, в атомных установках, теплоносителем в различных теплообменниках является водяной пар. Пар - газообразное тело в состоянии, близкое к кипящей жидкости. Парообразование – процесс превращения вещества из жидкого состояния в парообразное. Испарение– парообразование, происходящее всегда при любой температуре с поверхности жидкости. При некоторой определенной температуре, зависящей от природы жидкости и давления, под которым она находится, начинается парообразование во всей массе жидкости. Этот процесс называется кипением. Обратный процесс парообразования называется конденсацией. Она также протекает при постоянной температуре. Процесс перехода твердого вещества непосредственно в пар называется сублимацией. Обратный процесс перехода пара в твердое состояние называется десублимацией. При испарении жидкости в ограниченном пространстве (в паровых котлах) одновременно происходит обратное явление – конденсация пара. Если скорость конденсации станет равной скорости испарения , то наступает динамическое равновесие. Пар в этом случае имеет максимальную плотность и называется насыщенным паром. Если температура пара выше температуры насыщенного пара того же давления, то такой пар называется перегретым. Разность между температурой перегретого пара и температурой насыщенного пара того же давления называется степенью перегрева. Так как удельный объем перегретого пара больше удельного объема насыщенного пара, то плотность перегретого пара меньше плотности насыщенного пара. Поэтому перегретый пар является ненасыщенным паром. В момент испарения последней капли жидкости в ограниченном пространстве без изменения температуры и давления образуется сухой насыщенный пар. Состояние такого пара определяется одним параметром - давлением. Механическая смесь сухого и мельчайших капелек жидкости называется влажным паром. Массовая доля сухого пара во влажном паре называется степенью сухости – х.х = mсп / mвп , (6.7)mсп - масса сухого пара во влажном; mвп - масса влажного пара. Массовая доля жидкости во влажном паре нызвается степенью влажности – у.у = 1 – . (6.8) Для кипящей жидкости при температуре насыщения = 0, для сухого пара – = 1. 6.4. Характеристики влажного воздухаАтмосферный воздух, в основном состоящий из кислорода, азота, углекислого газа, содержит всегда некоторое количество водяного пара. Смесь сухого воздуха и водяного пара называется влажным воздухом. Влажный воздух при данном давлении и температуре может содержать разное количество водяного пара. Если смесь состоит из сухого воздуха и насыщенного водяного пара, то его называют насыщенным влажным воздухом. В этом случае во влажном воздухе находится максимально возможное для данной температуры количество водяного пара. При охлаждении этого воздуха, будет происходить конденсация водяного пара. Парциальное давление водяного пара в этой смеси равно давлению насыщения при данной температуре. Если влажный воздух содержит при данной температуре водяной пар в перегретом состоянии, то он будет называться ненасыщенным. Так как в нем находится не максимально возможное для данной температуры количество водяного пара, то он способен к дальнейшему увлажнению. Поэтому такой воздух используют в качестве сушильного агента в различных сушильных установках. По закону Дальтона общее давление влажного воздуха равно сумме парциальных давлений сухого воздуха и водяного пара, входящих в его состав:Р = РВ + РП , (6.9) где: РВ – парциальное давление сухого воздуха; РП - парциальное давление водяного пара. Максимальное значение РП при данной температуре влажного воздуха t представляет собой давление насыщенного водяного пара - РН. Для нахождения парциального давления пара пользуются специальным прибором – гигрометром. С помощью этого прибора определяют точку росы, т.е. температуру (tp), до которой нужно охладить при постоянном давлении воздух, чтобы он стал насыщенным. Зная точку росы, можно по таблицам определить парциальное давление пара в воздухе как давление насыщения (РН), соответствующее точки росы tp. Абсолютной влажностьювоздуха называется количество водяных паров, находящихся в 1 м3 влажного воздуха. Абсолютная влажность равна плотности пара при его парциальном давлении и температуре воздуха – tн . Отношение абсолютной влажности ненасыщенного воздуха при данной температуре к абсолютной влажности насыщенного воздуха при той же температуре называется относительной влажностью воздуха = сп / сн или = сп / сн ·100% , (6.10) Для сухого воздуха = 0, для ненасыщенного < 1, для насыщенного = 1(100%). Если водяной пар считать как идеальный газ, то по закону Бойля-Мариотта отношение плотностей можно заменить отношением давлений. Тогда: = П / РН или = РП / РН ·100% . (6.11) Плотность влажного воздуха слагается из масс, содержащихся в 1 м3 сухого воздуха и водяных паров: = в + п = PB/(RB·T) + /'' . (6.12) Молекулярная масса влажного воздуха определяют по формуле: = 28,95 – 10,934 PН/P (6.13) Значения РН и '' при температуре воздуха t берутся из таблицы водяного пара, – по данным психрометра, P - по барометру. Влагосодержание – представляет собой отношение массы пара к массе сухого воздуха: d = МП / МВ , (6.14) где: МП, МВ – соответственно массы пара и сухого воздуха во влажном воздухе. Связь между влагосодержанием с относительной влажностью: d = 0,622 ·РН·/(Р - ·РН). (6.15) Газовая постоянная: R = 8314/м = 8314/(28,95 – 10,934··РН/P). (6.16) Объем влажного воздуха, приходящегося на 1 кг сухого воздуха: VВЛ.В = R·T/P. (6.17) Удельный обьем влажного воздуха: = VВЛ.В/(1 + d). (6.17) Удельная массовая теплоемкостьпаровоздушной смеси: ссм = сВ + d·сП . (6.18) Тема 7. Термодинамические циклы7.1. Циклы паротурбинных установок (ПТУ)Паротурбинная установка является основой современных тепловых и атомных электростанций. Рабочим телом в таких установках является пар какой-либо жидкости (водяной пар). Основным циклом в паротурбинной установке является цикл Ренкина. Принципиальная схема ПТУ показана на рис.7.1 и процесс получения работы происходит в следующим образом. В паровом котле (1) и в перегревателе (2) теплота горения топлива передается воде. Полученный пар поступает в турбину (3), где происходит преобразование теплоты в механическую работу, а затем в электрическую энергию в электрогенераторе (4). Отработанный пар поступает в конденсатор (5), где отдает теплоту охлаждающей воде. Полученный конденсат насосом (6) отправляется в питательный бак (7), откуда питательным насосом (8) сжимается до давления, равного в котле, и подается через подогреватель (10) в паровой котел (1). 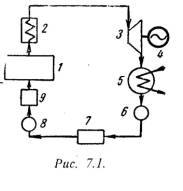 Рассмотрим цикл Ренкина на насыщенном паре. Схема установки отличается от предыдущей схемы тем, что в данном случае будет отсутствовать перегреватель. Поэтому на турбину будет поступать насыщенный пар. На рис.7.2,а изображен цикл Ренкина в TS-диаграмме. Процессы: 3-1 – подвод теплоты от источника в воде q1, состоит из двух процессов: 3-3/ - кипение воды в котле; 3/-1 – испарение воды в пар при постоянном давлении; 1-2 – в турбине пар расширяется адиабатически; 2-2/ - пар конденсируется и отдает тепло q2 охлаждающей воде; 2/-3 – конденсат адиабатически сжимается. Термический к.п.д. цикла Ренкина определяется по уравнению: t = (q1 – q2)/q1 . (7.1) Так как: q1 = h1 – h3 ; q2 = h2 – h2/ , то t = [(h1 – h2) - (h3 – h2/)] /( h1 – h3) = l / q1. (7.2) Полезная работа цикла равна разности работ турбины и насоса: l = lт – lн , где: lт = h1 – h2 , lн = h3 – h2/ . В основном lт >> lн , тогда считая h3 = h2/ , можно записать: t = (h1 – h2)/( h1 – h3) . (7.3) Теоретическуя мощность турбины рассчитывают по формуле: Nт = (h1 – h2)·D/3600 , [Вт] (7.4) где: D = 3600·m – часовой расход, [кг/ч] m – секундный расход, [кг/с] Цикл Ренкина на перегретом паре применяется для увеличения термического к.п.д. цикла ПТУ. Для этого перед турбиной ставят перегреватель 2 (Рис.7.1), котрый увеличивает температуру и давление пара. При этом возрастает средняя температура подвода теплоты в цикле. Диаграмма цикла показана на рис.7.2,б Формулы расчета l, t, Nт остаются без изменений. 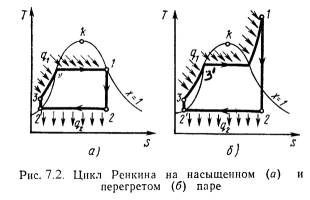 7.2. Циклы двигателей внутреннего сгорания (ДВС)Циклы поршневых двигателей внутреннего сгорания подразделяют на три группы:
Основными характеристиками или параметрами любого цикла теплового двигателя являются следующие безрамерные величины: степень сжатия (отношение удельных объемов рабочего тела в начале и конце сжатия) = 1 / 2 , (7.5) степень повышения давления (отношение давлений в конце и в начале изохорного процесса подвода теплоты) = Р3 / Р2 , (7.6) степень предварительного расширения или степень изобарного расширения (отношение удельных объемов в конце и в начале изохорного процесса подвода теплоты) = 3 / 2 . (7.7) 1). Рассмотрим цикл ДВС с подводом теплоты при постоянном объеме на примере четырехтактного двигателя. Диаграмма реального двигателя представлена на рис.7.3. 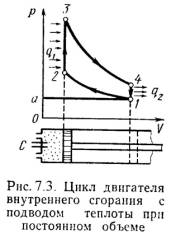 а-1 (1 такт) – в цилиндр через всасывающий клапан поступает смесь воздуха и паров горючего (нетермодинамичемкий процесс); 1-2 (2 такт) – адиабатное сжатие (повышается температура); 2-3 – сгорание горючей смеси, давление быстро возрастает при постоянном объеме (подвод теплоты q1); 3-4 (3 такт) – адиабатное расширение (рабочий процесс, совершается полезная работа); 4-а – открывается выхлопной клапан и отработанные газы покидают цилиндр давление цилиндра падает (отводится тепло q2). 1-а (4 такт) – выталкивание оставшихся в цилиндре газов. Затем процесс повторяется. Описанный процесс является необратимым (наличие трения, химической реакции в рабочем теле, конечные скорости поршня, теплообмен при конечной разности температур и т.п.). Для анализа теории тепловых машин термодинамика рассматривает идеальные циклы обратимые циклы. Диаграмма идеального процесса двигателя внутреннего сгорания показана на рис.7.4. 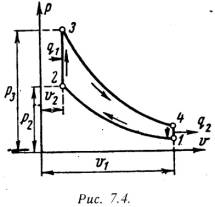 Из этой диаграммы выводится формула для термического к.п.д. цикла с подводом теплоты при постоянном объеме, который имеет следующий вид: t = 1 – 1/ , (7.8) где: –степень сжатия (основной показатель работы двигателя, чем выше е, тем выше экономичность ДВС); – показатель адиабаты. 2). Идеальный цикл ДВС со смещанным подводом теплоты при постоянном объеме (безкомпрессорные дизели). Диаграмма цикла показана на рис.7.5.  1-2 - чистый воздух с температурой Т1 сжимается до температуры Т2, которая больше температуры воспламенения топлива. В этот момент в цилиндр через форсунки под давлением впрыскивается топливо. 2-3 – горючая смесь самовоспламеняется и к рабочему телу подводится тепло q1/, давление повышается до Р3. 3-4 – поршень перемешается обратно, поступление и сгорание топлива продолжается при постоянном давлении и подводится тепло q1//. 4-5 – поршень продолжает перемещаться в нижнюю мертвую точку, давление падает (адиабатное расширение); 5-1 – процесс отвода теплоты q2 при постоянном объеме (через выпускной клапан покидают отработанные газы). Термический к.п.д. цикла определяется по формуле: t = – (· – 1) / -1·[( - 1) + ··( – 1)] . (7.9) Цикл двигателей с подводом теплоты при постоянном давлении широкое применение не нашли, так как у этих циклов очень большой коэффициент сжатия. 7.3. Циклы газотурбинных установок (ГТУ)Основными недостатками поршневых двигателей внутреннего сгорания явяляются ограниченность их мощности и невозможность адиабатного расширения рабочего тела до атмосферного давления, котрые отсутствуют в газотурбиннных установках. ГТУ рабочим телом являются продукты сгорания жидкого или газообразного топлива. На рис.7.6 дана схема простейшей газотурбинной установки со сгоранием топлива при постоянном давлении. Топливным насосом 5 и компрессором 4 топливо и воздух через форсунки 6 и 7 поступают в камеру сгорания 1. Из камеры продукты сгорания направляются в комбинированные сопла 2, где они расширяются, и поступают на лопатки газовой турбины 3. 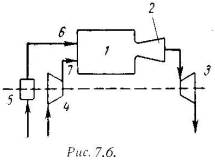 На рис.7.7 и рис7.8 представлены идеальный цикл ГТУ на PV и TS диаграммах. 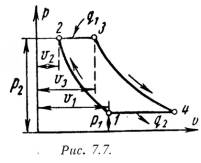 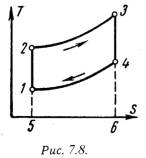 1-2 - адиабатное сжатие до давления Р2; 2-3 – подвод теплоты q1 при постоянном давлении Р2 (сгорание топлива); 3-4 – адиабатное расширение до первоначального давления Р1; 4-1 – охлаждение рабочего тела при постоянном давлении Р1 (отвод теплоты q2); Характеристиками цикла являются: степень повышения давления - = Р2/ Р1 ; степень изобарного расширения - = 3 /2 . Работа турбины: lт = h3 – h4 . (7.10) Работа компрессора: lн = h2 – h1 . (7.11) Полезная работа ГТУ равна разности работ турбины и компрессора: LГТУ = lт – lк . (7.12) Термический к.п.д. цикла ГТУ имеет вид: t = 1 – 1/ (-1)/ . (7.13) Теоретическая мощность газовой турбины, компрессора и установки (ГТУ): Nт = lт·D/3600 = (h3 – h4)·D/3600 , (7.14) Nк = lк·D/3600 = (h2 – h1)·D/3600 , (7.15) NГТУ = lГТУ·D/3600 = [(h3 – h4) (h2 – h1) ]·D/3600 . (7.16) Действительный цикл ГТУ отличается от теоретического наличием потерь на трение и вихреообразование в турбине и компрессоре. Эффективными методами повышения экономичности газотурбинных установок являются: регенерация теплоты, ступенчатое сжатие и расширение рабочего тела и пр. |
