Применение адреноблокаторов. Применение адреноблокаторов в лечении ряда патологий внутренних. Курсовая работа Применение адреноблокаторов в лечении ряда патологий внутренних органов
 Скачать 103.24 Kb. Скачать 103.24 Kb.
|
|
Курсовая работа: Применение адреноблокаторов в лечении ряда патологий внутренних органов Вводная часть адреноблокатор инсульт препарат гипертензия Созданные в конце 50–х годов XX века будущим лауреатом Нобелевской премии J.W. Black новые лекарственные средства, конкурентно и избирательно ингибирующие связывание катехоламинов с b–адренорецепторами, ведут историю своего клинического применения с 1962 г., когда появился и был внедрен в медицинскую практику пропранолол. За более чем 40–летний период b–адреноблокаторы заняли прочные позиции в фармакотерапии, в первую очередь в лечении сердечно–сосудистых заболеваний. В настоящее время доказана высокая эффективность b–адреноблокаторов при всех формах ИБС (стабильная и нестабильная стенокардия), артериальной гипертензии (АГ), хронической сердечной недостаточности (ХСН). ß-адреноблокаторы являются препаратами первого выбора при артериальной гипертензии, уменьшая частоту развития инсультов на 42%. Они обладают высокой антиаритмической активностью при нарушениях сердечного ритма (наджелудочковой тахикардии, тахисистолической форме мерцания предсердий, суправентрикулярной и желудочковой экстрасистолии), синдроме «удлиненного QT». ß-адреноблокаторы эффективно используются при вегетативных кризах (панических атаках), тиреотоксикозе, гипертрофической кардиомиопатии, расслаивающей аневризме аорты, пролапсе митрального клапана, эссенциальном треморе, абстинентном синдроме при наркомании и алкоголизме. Механизм действия ß-АДРЕНОБЛОКАТОРОВ Кардиальные фармакодинамические эффекты b–адреноблокаторов связаны с блокадой преимущественно b1–адренорецепторов сердца. b–адреноблокаторы, связываясь с b1–адренорецепторами, препятствуют взаимодействию с ними эндогенных катехоламинов (норадреналина, адреналина), что ведет к снижению стимулирующего действия Gs–белка, связанного с b1–адренорецептором на аденилатциклазу. Ее активность резко падает, что проявляется в замедлении синтеза цАМФ. Снижение содержания внутриклеточного цАМФ приводит к тому, что цАМФ–зависимые протеинкиназы остаются неактивными, не могут фосфорилировать мембранные кальциевые каналы, которые остаются закрытыми и, таким образом, снижается ток ионов кальция из внеклеточного пространства, который мог бы играть роль «кальциевой искры», необходимой для массивного высвобождения ионов кальция из депо (саркоплазматического ретикулума). В «рабочих» кардиомиоцитах отсутствие ионов кальция приводит к тому, что не может образоваться комплекс кальций–тропонин С, способный «освободить» места связывания сократительных белков актина и миозина, следствием этого является невозможность образования актино–миозинового комплекса и снижение силы сердечных сокращений (отрицательный инотропный эффект).Уменьшение концентрации ионизированного кальция в клетках проводящей системы сердца (сино–атриального узла – SA–узла) приводит к уменьшению ЧСС (отрицательный хронотропный эффект) и угнетению проводимости (отрицательный дромотропный эффект), в большей степени в антеградном направлении через AV узел и пучок Кента, а также снижению автоматизма (отрицательный батмотропный эффект), особенно в клетках SA–узла, AV–узла, предсердий, и в меньшей степени – желудочков. Снижение силы сердечных сокращений и ЧСС способствуют уменьшению потребности миокарда в кислороде, что обосновывает возможность применения b–адреноблокаторов в качестве антиангинальных ЛС у больных ИБС. Наличие у этой группы ЛС способности угнетать проводимость и автоматизм обусловливает антиаритмическое действие b–адреноблокаторов. Понижение содержания внутриклеточного кальция за счет блокады b1–адренорецепторов в клетках юкстагломерулярного аппарата (ЮГА) почек сопровождается угнетением выброса ренина в кровь, уменьшением образования ангиотензина II, что наряду со снижением сердечного выброса (за счет уменьшения силы сердечных сокращений и ЧСС) ведет к снижению АД и определяет эффективность b–адреноблокаторов в качестве антигипертензивных ЛС. β-адреноблокаторы блокируют ß -адренорецепторы, расположенные в различных органах. Различают 2 основных вида ß -адренорецепторов. Первые расположены в сердце и островковой части поджелудочной железы, вторые – в стенках артерий, легких, мочевом пузыре, матке. Эффекты их стимуляции показаны таблице 1. Таблица 1
Способность блокировать влияние медиаторов на ß-адренорецепторы миокарда и ослабление влияния катехоламинов на мембранную аденилатциклазу кардиомиоцитов с уменьшением образования цАМФ определяет фармакодинамику ß-адреноблокаторов – их отрицательное ино-, батмо, дромо- и хронотропное действие, антиангинальный, гипотензивный и антиаритмический эффекты. Влияние на ß 2 -адренорецепторы обусловливает значительную часть побочных действий и противопоказаний к применению ß-адреноблокаторов, в частности, бронхоспазм, сужение периферических сосудов и увеличение общего периферического сопротивления. Классификация ß-АДРЕНОБЛОКАТОРОВ Принципы классификации ß-адреноблокаторов основаны на нескольких свойствах: кардиоселективность, внутренняя симпатомиметическая активность, наличие вазодилатирующих свойств, продолжительность действия. Также они отличаются по липо- и гидрофильности. Основываясь на фармакодинамических эффектах, b–адреноблокаторы принято подразделять на неселективные (неизбирательные), блокирующие b1– и b2–адренорецепторы (пропранолол, тимолол, надолол, соталол) и кардиоселективные (избирательные), преимущественно блокирующие b1–адренорецепторы (бисопролол, ацебутолол, талинолол, атенолол, метопролол, бетаксолол). К α-β–адреноблокаторам относят лабеталол. Следует отметить, что ряд b–адреноблокаторов обладает собственной или, как ее еще называют, внутренней (частичной агонистической) симпатомиметической активностью (ВСМА), проявляющейся при низкой базальной (в покое) эндогенной симпатической активности, при повышении уровня эндогенной симпатической активности (например, при физической нагрузке) проявляется их b–адреноблокирующее действие. К таким препаратам (табл. 1) относят пиндолол, ацебутолол, талинолол, карведилол, окспреналол. Они в меньшей степени снижают ЧСС и сократимость миокарда в покое, не оказывают негативного влияния на липидный обмен, у них слабее выражен синдром «отмены». Выделяют также b–адреноблокаторы с дополнительными вазодилатирующими свойствами (ВДС). К ним относятся неселективные b–адреноблокаторы пиндолол, буциндолол, лабетолол и кардиоселективные b–адреноблокаторы – карведилол, проксодолол, небиволол. Вазодилатация может быть обусловлена четырьмя основными механизмами (по отдельности и в комбинации друг с другом): 1) выраженной ВСМА в отношении b2–адренорецепторов сосудов (как, например, у пиндолола); 2) сочетанием b–адреноблокирующей и a–адреноблокирующей активности (как у карведилола и проксодолола); 3) высвобождением из эндотелиальных клеток азота оксида, обладающего вазодилатирующими свойствами (как у небиволола); 4) прямым сосудорасширяющим действием. 1. b-Адреноблокаторы без вазодилатирующих свойств: а) неселективные (пропранолол, надолол, окспренолол, соталол, тимолол и др.); б) b1-селективные (атенолол, бетаксолол, бисопролол, метопролол и др.). 2. b-Адреноблокаторы с вазодилатирующими свойствами: а) неселективные (пиндолол, лабетолол и др.); б) b1-селективные (карведилол, целипролол и др.) При сравнении неселективных и кардиоселективных b–адреноблокаторов можно отметить, что последние в низких дозах мало влияют на физиологические реакции, опосредуемые периферическими b2–адренорецепторами (на тонус бронхов и артерий, секрецию инсулина, мобилизацию глюкозы из печени, сократительную активность матки во время беременности), что делает возможным их осторожное назначение для лечения больных с хроническими обструктивными заболеваниями легких, сахарным диабетом, выраженными нарушениями периферического кровообращения («перемежающаяся» хромота, синдром Рейно), а также во время беременности. Кроме того, кардиоселективные b–адреноблокаторы (такие как бисопролол и др.) в минимальной степени ограничивают физическую активность, так как в отличие от неселективных препаратов они не вызывают сужения сосудов скелетной мускулатуры; поэтому при их применении реже наблюдается повышенная утомляемость и мышечная слабость. На фоне назначения кардиоселективных b–адреноблокаторов у некоторых больных, например, с гиперкинетическим типом кровообращения, физическая работоспособность может даже увеличиться. ß-адреноблокаторы классифицируются также по продолжительности действия: длительного действия: надолол, атенолол, бетаксолол, бисопролол, сверхкороткого действия: эсмолол. Таблица 2
Механизм вазодилатирующего эффекта у различных препаратов различен: например, у лабетолола он опосредован блокадой альфа-рецепторов сосудов. В последние годы интерес практических врачей привлек именно небиволол, отличающийся, помимо высокой селективности, способностью вызывать вазодилатацию за счет модулирующего влияния на выделение окиси азота (NO) эндотелием сосудов. Последняя особенность препарата представляется настолько важной, что некоторые авторы предлагают считать небиволол бета-адреноблокатором третьего поколения Особенности фармакодинамики ß-АДРЕНОБЛОКАТОРОВ Сравнительные показатели кардиоселективности некоторых ß-адреноблокаторов представлены в таблице 3. Таблица3
Согласно результатам исследований in vitro сила связывания небиволола с ß 1 -адренорецепторами превосходит силу связывания с ß 2 -адренорецепторами почти в 290 раз. По этому показателю препарат опережает другие представители группы ß-адреноблокаторов (табл. 3). Это способствует меньшему риску развития побочных эффектов, связанных со стимуляцией ß 2 -адренорецепторов (бронхоспазм, вазоконстрикци я и т.д.). Как было отмечено выше, небиволол, помимо высокой кардиоселективности, способен вызывать вазодилатацию за счет модулирующего влияния на высвобождение окиси азота эндотелием сосудов (рис. 1). 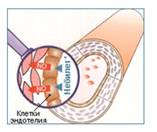 Рис. 1. Небиволол модулирует синтез эндогенной окиси азота клетками эндотелия. Окись азота, помимо вазодилатирующего эффекта, обладает антиагрегантным и антиатеросклеротическим действием, тормозит пролиферацию гладкомышечных клеток и таким образом предотвращает сосудистое ремоделирование (табл. 4). Соответственно, повышение синтеза окиси азота под влиянием небиволола обусловливает ангиопротективное действие путем нормализации базального тонуса кровеносных сосудов, антиагрегантного, антипролиферативного и антиоксидантного влияния. Таблица 4. Клиническое значение воздействия окиси азота на различные ткани организма
Особенности фармакокинетики ß-АДРЕНОБЛОКАТОРОВ Особенности фармакокинетики различных b–адреноблокаторов в значительной мере определяются степенью их растворимости в липидах и воде. По этому признаку различают 3 группы b–адреноблокаторов: липофильные, гидрофильные, липо– и гидрофильные. • Липофильные b–адреноблокаторы (бетаксолол, карведилол, метопролол, окспренолол, пропранолол, тимолол и др.) быстро и полностью (около 90%) всасываются в ЖКТ, легко проникают через гематоэнцефалический барьер (сопровождается повышением частоты побочных явлений со стороны ЦНС – бессонницей, общей слабостью, сонливостью, депрессией, кошмарными сновидениями, галлюцинациями и т.д.). Некоторые липофильные b–адреноблокаторы (карведилол, талинолол) являются субстратами для гликопротеина–Р1. Все липофильные b–адреноблокаторы подвергается биотрансформации путем окисления с участием изофермента цитохрома Р450 2D6 (CYP2D6), причем пресистемный метаболизм b–адреноблокаторов при первом прохождении через печень составляет до 80%. Необходимо учитывать, что метаболизм b–адреноблокаторов с эффектом «первого прохождения» через печень может меняться даже при нормальной функциональной активности гепатоцитов: липофильные b–адреноблокаторы, уменьшая печеночный кровоток (пропранолол, например, на 30%), могут замедлять свой собственный метаболизм в печени и таким образом удлинять период полувыведения (Т1/2) при длительном применении. Так, при длительном назначении Т1/2 пропранолола может увеличиться в 2–3 раза по сравнению с однократным приемом. Пропранолол, как и другие липофильные b–адреноблокаторы, может замедлять выведение из крови других ЛС, которые метаболизируются в печени (например, лидокаина, гидралазина, теофиллина). Снижение биотрансформации b–адреноблокаторов с выраженным пресистемным метаболизмом особенно выражено у больных циррозом печени, застойной недостаточностью кровообращения и в пожилом возрасте (у этих групп больных доза b–адреноблокаторов должна быть снижена). Липофильные b–адреноблокаторы интенсивно связываются с белками плазмы крови (пропранолол – на 80–93%). У липофильных b–адреноблокаторов отмечается большой объем распределения. • Гидрофильные b–адреноблокаторы (атенолол, надолол, соталол и др.) не полностью (30–70%) и неравномерно всасываются в ЖКТ и обычно в незначительной мере (0–20%) метаболизируются в печени. Они выводятся почками в неизмененном виде (40–70%), либо в виде метаболитов. Гидрофильные b–адреноблокаторы имеют более продолжительный Т1/2 (от 6 до 24 ч), чем липофильные. Т1/2 гидрофильных b–адреноблокаторов увеличивается у больных со сниженной скоростью клубочковой фильтрации (СКФ), т.е. при почечной недостаточности, а также у пожилых лиц; в таких случаях следует уменьшить суточную дозу препаратов за счет кратности приема. При выраженной почечной недостаточности более безопасным является назначение не гидрофильных, а липофильных b–адреноблокаторов (бисопролол и др.), которые метаболизируются в печени. Поскольку выведение гидрофильных b–адреноблокаторов мало зависит от функции печени, они не взаимодействуют с ЛС, которые метаболизируются в печени и более предпочтительны у больных с тяжелыми заболеваниями печени. • К третьей группе относятся b–адреноблокаторы, растворимые как в жирах, так и в воде (ацебутолол, бисопролол, пиндолол, целипролол и др.), они подвергаются частично подвергаются биотрансформации в печени (40–60%), остальная часть выводится почками в неизмененном виде. b–адреноблокаторы со сбалансированным клиренсом обычно имеют небольшой Т1/2 (от 3 до 12 ч). Так, сбалансированный клиренс бисопролола объясняет низкую вероятность взаимодействия этого препарата с другими ЛС и большую безопасность их применения у больных с умеренной печеночной или почечной недостаточностью. В то же время при тяжелой печеночной и/или почечной недостаточности суточные дозы b–адреноблокаторов со сбалансированным клиренсом рекомендуют уменьшать в 1,5–2 раза. Существуют b–адреноблокаторы (эсмолол), которые имеют очень короткий Т1/2, так как разрушаются эстеразами крови. Соответственно, они обладают сверхкоротким действием, которое полностью исчезает через 30 минут после прекращения внутривенной инфузии. Эсмолол может быть использован при гипертонических кризах, особенно они эффективны при т.н. симпатико–адреналовых кризах. Особенности фармакокинетики наиболее часто применяемых ß-адреноблокаторов представлены в таблице 5. Таблица 5. Особенности фармакокинетики некоторых бета-адреноблокаторов.
Для оценки выраженности и продолжительности гипотензивного действия пролонгированных препаратов Управление США по контролю за лекарствами и продуктами (FDA) предложило в 1988-1990 гг. использовать коэффициент «конечный/пиковый» (trough/peak, Т/Р), т.е. соотношение между наименьшим снижением систолического или диастолического давления в конце междозового интервала и максимальным его снижением на высоте эффекта препарата. Оптимальной представляется гипотензивная терапия, при которой отсутствуют значительные колебания АД в течение суток, т.е. этот коэффициент должен стремиться к единице или 100%. По рекомендациям FDA коэффициент «конечный/пиковый» должен быть не менее 50%, т.е. современные гипотензивные средства должны обеспечивать снижение АД через 24 ч после приема не менее чем на 50% от снижения показателей в период максимального гипотензивного действия. Невысокие колебания АД способствуют уменьшению повреждения сосудистой стенки, а следовательно, улучшают прогноз заболевания.(рис.2). 1. Небиволол 2. Эналаприл 3. Нифедипин 4. Амлодипин 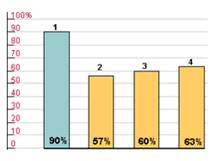 Рис. 2. Индекс "конечный/пиковый" (trough/peak) гипотензивных препаратов. |
