Производство 1,2-дихлорэтана. Курсовая работа Производство 1,2 дихлорэтана
 Скачать 7.36 Mb. Скачать 7.36 Mb.
|
|
Размещено на http://www.allbest.ru/ Московский государственный университет тонких химических технологий имени М. В. Ломоносова Кафедра Общей химической технологии Курсовая работа «Производство 1,2 - дихлорэтана» Студентка: Квашнина В. Ю. Группа: ХТ-412 Преподаватель: Брук Л.Г. Москва, 2015 г. ВведениеЗадача заключается в разработке технологического процесса производства 1,2-дихлорэтана окислительным хлорированием этилена. Причиной разработки процессов оксихлорирования явилась необходимость утилизации больших объемов отходящего газообразного хлорида водорода. Последний образуется в производствах хлорорганических продуктов во всех процессах заместительного хлорирования и дегидрохлорирования. Объединение стадий хлорирования и оксихлорирования позволяет создавать сбалансированные по хлору производства. 1,2–дихлорэтан в настоящее время является одним из важнейших продуктов органического синтеза. Ежегодно в мире получают более 17,5 млн. тонн 1,2-дихлорэтана. Производство дихлорэтана тесно связано с винилхлоридом, поэтому современные варианты получения винилхлорида содержат технологические схемы получения дихлорэтана, как полупродукта для переработки в винилхлорид. Из винилхлорида получают поливинилхлорид, занимающего по объему выпуска второе место после полиэтилена среди полимерных материалов. Дихлорэтан находит широкое применение в различных областях промышленности и как растворитель: для очистки нефтепродуктов от парафинов, для экстрагирования жиров, для обезжиривания шерсти, мехов, а также для очистки металлических изделий перед хромированием или никелированием. Производство дихлорэтана является одним из важнейших факторов в производственной цепи получения полимеров, конечная цель которого получение полимерных и синтетических материалов (пластмасс), без которых нельзя представить жизнь современного общества. Данные по исходному сырьюЭтилен 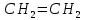 Физико-химические свойства: – молекулярная масса: 28 г/моль – плотность – 1,261 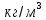 – растворимость в воде при н. у. – 0,281 г/л – температура кипения – минус 103,71 °С – температура плавления – минус 169,5 °С Этилен – бесцветный газ с удушливым сладковатым запахом. По степени воздействия на организм человека относится к 4-му классу опасности (ГОСТ 25070 – 87). Предельно допустимая концентрация (ПДК) этилена 100 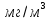 . При превышении ПДК этилен оказывает наркотическое действие, может вызвать головную боль, головокружение, ослабление дыхания, нарушение кровообращения, потерю сознания. . При превышении ПДК этилен оказывает наркотическое действие, может вызвать головную боль, головокружение, ослабление дыхания, нарушение кровообращения, потерю сознания.Этилен – горючий газ, способный к взрывному разложению при повышенном давлении, высокой температуре или при воздействии открытого огня в присутствии кислорода. Концентрированные пределы воспламенения в воздухе: нижний – не менее 3,11% объемных, верхний – не более 32% объемных. Основным промышленным методом получения этилена является пиролиз жидких дистиллятов нефти или низших насыщенных углеводородов. Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул. Галогенирование: 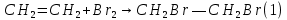 Происходит обесцвечивание бромной воды. Это качественная реакция на непредельные соединения. Гидрирование: 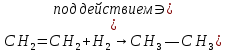 Гидрогалогенирование: 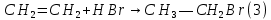 Гидратация: 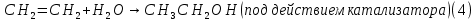 Эту реакцию открыл A.M. Бутлеров, и она используется для промышленного получения этилового спирта. Окисление: Этилен легко окисляется. Если этилен пропускать через раствор перманганата калия, то он обесцветится. Эта реакция используется для отличия предельных и непредельных соединений. Окись этилена — непрочное вещество, кислородный мостик разрывается и присоединяется вода, в результате образуется этиленгликоль. Уравнение реакции: 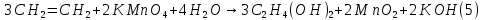 Горение: 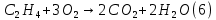 Полимеризация (получение полиэтилена): 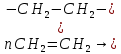 Хлороводород HCl Физико-химические свойства: – молекулярная масса - 36,5 г/моль – плотность – 1,477 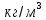 – растворимость в воде при н. у. – 72,47 г/л – температура кипения – минус 85 °C – температура плавления – минус 114,22 °C бесцветный, термически устойчивый газ (при нормальных условиях) с резким запахом, дымящий во влажном воздухе, легко растворяется в воде (до 500 объёмов газа на один объём воды) с образованием хлороводородной (соляной) кислоты. При −85,1 °C конденсируется в бесцветную, подвижную жидкость. При −114,22 °C HCl переходит в твёрдое состояние. Предельно допустимая концентрация (ПДК) хлористого водорода в воздухе населенных пунктов: среднесуточная - 0,02 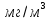 , максимально разовая - 0,05 , максимально разовая - 0,05 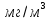 , в воздухе рабочей зоны производственных помещений - 5 , в воздухе рабочей зоны производственных помещений - 5 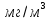 . Хлористый водород оказывает сильное раздражающее действие на органы дыхания. Длительное воздействие малых концентраций вызывает катары верхних дыхательных путей, быстрое разрушение эмали зубов. Концентрации 50-75 . Хлористый водород оказывает сильное раздражающее действие на органы дыхания. Длительное воздействие малых концентраций вызывает катары верхних дыхательных путей, быстрое разрушение эмали зубов. Концентрации 50-75 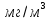 переносятся с трудом, острое отравление сопровождается охриплостью голоса, удушьем, кашлем. Концентрации 75-150 переносятся с трудом, острое отравление сопровождается охриплостью голоса, удушьем, кашлем. Концентрации 75-150 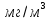 непереносимы, вызывают раздражение слизистых, конъюнктивит, чувство удушья, потерю сознания. непереносимы, вызывают раздражение слизистых, конъюнктивит, чувство удушья, потерю сознания.В промышленности хлороводород ранее получали в основном сульфатным методом (методом Леблана), основанном на взаимодействии хлорида натрия с концентрированной серной кислотой. В настоящее время для получения хлороводорода обычно используют прямой синтез из простых веществ: 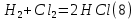 Хлорид водорода – стойкое соединение; при 1800ºС он диссоциирует на 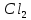 и и 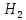 в незначительной степени. Химически в отсутствие в незначительной степени. Химически в отсутствие 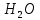 хлорид водорода малоактивен, в газообразном состоянии не реагирует с углеродом, фосфором серой, железом. Его используют для получения соляной кислоты, синтеза органических соединений, например винилхлорида. хлорид водорода малоактивен, в газообразном состоянии не реагирует с углеродом, фосфором серой, железом. Его используют для получения соляной кислоты, синтеза органических соединений, например винилхлорида.Химические свойства. Водный раствор хлористого водорода называется соляной кислотой. При растворении в воде протекают следующие процессы: 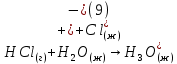 Со всеми металлами, стоящими в ряду напряжений после водорода, с основными и амфотерными оксидами, основаниями и солями, образуя соли – хлориды: 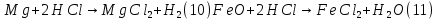 При действии сильных окислителей или при эликтролизе хлорводород проявляет восстановительные свойства: 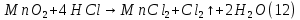 При нагревании хлороводород окисляется кислородом (катализатор 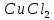 ): ):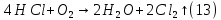 С медью, при этом образуется комплекс одновалентной меди: 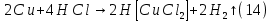 Благодаря высокой концентрации хлорид–ионов в растворе металл связывается в хлоридный комплекс, что способствует его растворению: 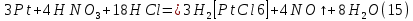 Присоединения к кратным связям (электрофильное присоединение): Присоединения к кратным связям (электрофильное присоединение):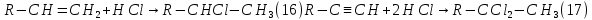 Присоединяется к серному ангидриду, образуя хлорсульфоновую кислоту: 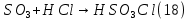 Характеристика целевого продукта дихлорэтан хлорирование этилен водород Дихлорэтан 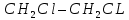 Физико-химические свойства: – молекулярная масса – 98 г/моль – плотность – 1282 кг/м3 – растворимость в воде при н. у. – 0.91% – температура кипения – 83.47 °С – температура плавления – минус 35.36 °С Дихлорэтан – бесцветная жидкость с характерным запахом, легко растворяется в обычных растворителях и сам является хорошим растворителем. В смеси с воздухом пары дихлорэтана образуют взрывоопасные смеси. Концентрированные пределы воспламенения смеси с воздухом: нижний – не менее 6,2, % объемных, верхний – не более 16,0% объемных. Дихлорэтан токсичен. При вдыхании паров и проникновении через кожу вызывает дистрофические изменения в печени, почках. Класс опасности – 2 (вещество высоко – опасное). Предельно – допустимая концентрация дихлорэтана 10 мг/м3 Основным методом получения является катализируемая хлоридом железа (III) реакция присоединения хлора к этилену. 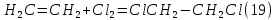 Также существует метод, основанный на реакции этилена с хлороводородом и кислородом в присутствии катализатора на основе хлорида меди (II), который рассматривается в данной работе: 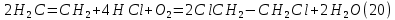 В принципе, он может также быть получен хлорированием этана или из этанола. Химические свойства При нагревании с водой, раствором соды или суспензией гашёной извести, дихлорэтан образует этиленгликоль: 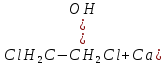 Под действием щёлочи или пиролизом превращается в хлористый винил. При нагревании дихлорэтана с аммиаком под давлением даёт этилендиамин 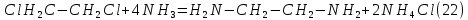 с цианистым натрием дихлорэтан образует динитрил янтарной кислоты. 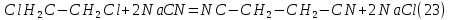 При нагревании с растворами полисульфидов натрия дихлорэтан образует каучукоподобное вещество - тиокол. 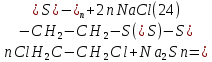 Реагирует с алюминием, а во влажном состоянии с цинком и железом. Способы получения дихлорэтана Существуют несколько способов получения дихлорэтана из этилена: 1) взаимодействие этилена с хлором в среде жидкого дихлорэтана при 20—30° С; 2) пропускание этилена через жидкий хлор при повышенном давлении и температуре не выше 0° С; 3) взаимодействие этилена с хлором при повышенных температурах (до 120° С) над различными катализаторами.(CuCl2, FeCl3, SbCl5, животный уголь и др.); 4) взаимодействие этилена, хлористого водорода и кислорода воздуха над медным катализатором при 300°С: 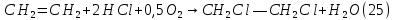 В промышленности распространен главным образом первый способ, технологически разработанный А. Ф. Добрянским с сотрудниками. Они доказали возможность использования для получения дихлорэтана не только чистого этилена, но и зтиленсодержащиж смесей, например этиленовой фракции газов пиролиза нефтяного сырья и этиленовой фракции коксового газа. По второму способу для достижения высокого выхода дихлорэтана требуются высококонцентрированный этилен и жидкий хлор. Кроме того, реакция образования дихлорэтана в этом случае протекает при избытке хлора, что приводит к образованию не только дихлорэтана, но и других продуктов хлорирования этилена. Недостатками остальных способов являются невысокий выход дихлорэтана вследствие образования побочных продуктов замещения, а также трудности очистки дихлорэтана. Выбор и обоснование метода производства 1,2 – дихлорэтана Основным способом проведения оксихлорирования является газофазный процесс с использованием гетерогенных катализаторов. В качестве катализаторов применяют соединения меди, щелочных, редкоземельных и некоторых других металлов (или их смесь) на пористых носителях разного состава и строения. Основой для процесса оксихлорирования послужил газофазный процесс окисления хлорида водорода, протекающий на катализаторах, содержащих хлорид меди (процесс Дикона). При совместном протекании реакций Дикона и хлорирования равновесие реакции сдвигается за счет расходования хлора, поэтому имеем практически полное превращение НС1. Все рассмотренные реакции оксихлорирования практически необратимы в интересующем нас интервале температур. При этом хлорид меди остается основным катализатором окисления HCl и оксихлорирования. Для этого процесса Диконом была предложена следующая схема протекания окисления HCl: 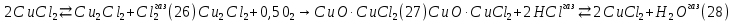 В дальнейшем был предложен механизм образования 1,2-дихлорэтана при взаимодействии этилена с CuCl2, в результате которого образуется восстановленная форма меди: 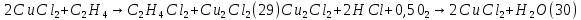 Таким образом, в случае окислительного хлорирования этилена при 210—280°С происходит присоединение хлора по двойной связи, а не замещение. Причем установлено, что хлорирование осуществляется не хлором, а непосредственно CuCl2 который регенерируется под действием НСl и O2: 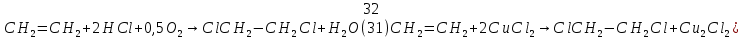 ) )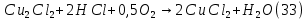 При этом, видимо, кислород окисляет Сu2Сl2 в оксохлориды меди (II), которые в присутствии НСl переходят в СuСl2 В данном случае катализаторы готовят пропиткой носителя (пемза, корунд, алюмосиликат) солями с последующей сушкой. Их основным компонентом является хлорид меди (II), к которому добавляют KI для снижения летучести за счет образования комплексов с СuСl2. Добавляются также различные модификаторы, например соединения редкоземельных элементов. Очень высокая экзотермичность процесса требует организации отвода тепла в реакторе. Если используется реактор с псевдоожиженным слоем катализатора, то в него подают холодные реагенты, а избыток тепла отводится с помощью внутреннего теплообменника за счет испарения парового конденсата. В кожухотрубных реакторах со стационарным слоем катализатора тепло отводится за счет испарения водного конденсата, подаваемого в межтрубное пространство. Из–за наличия в реакционной массе паров воды при процессах окислительного хлорирования наблюдается сильная коррозия аппаратуры. Кроме обычной защиты корпуса реакторов керамическими материалами, для изготовления охлаждающих устройств, применяют специальные сплавы. Недостатками этого способа является образование побочных продуктов замещения, а также трудности очистки дихлорэтана. Процесс газофазного хлорирования требует особенного требования по технике безопасности. Технологическое оформление процесса Процесс получения 1,2-дихлорэтана окислительным хлорированием этилена состоит из двух основных стадий: синтеза 1,2-дихлорэтана и его выделения. При этом в реакторе протекают две реакции (29) и (30), т. е. наблюдается совмещение двух реакций в одном аппарате (реакторе). Реакция (29) направлена на получение целевого продукта 1,2-дихлорэтана, а реакция (30) позволяет регенерировать катализатор, а именно превращать неактивную форму Сu2Сl2 в активную форму СuСl2 в присутствии НСl и О2 Суммарный процесс оксихлорирования может проводиться в реакторе со стационарным слоем катализатора (соли меди, нанесенные на оксид алюминия или алюмосиликат) — трубчатом реакторе или в реакторе с псевдоожиженным слоем катализатора. В первом случае тепло отводится за счет испарения водного конденсата, подаваемого в межтрубное пространство, а во втором случае - также за счет испарения водного конденсата, но подаваемого во встроенный теплообменник. 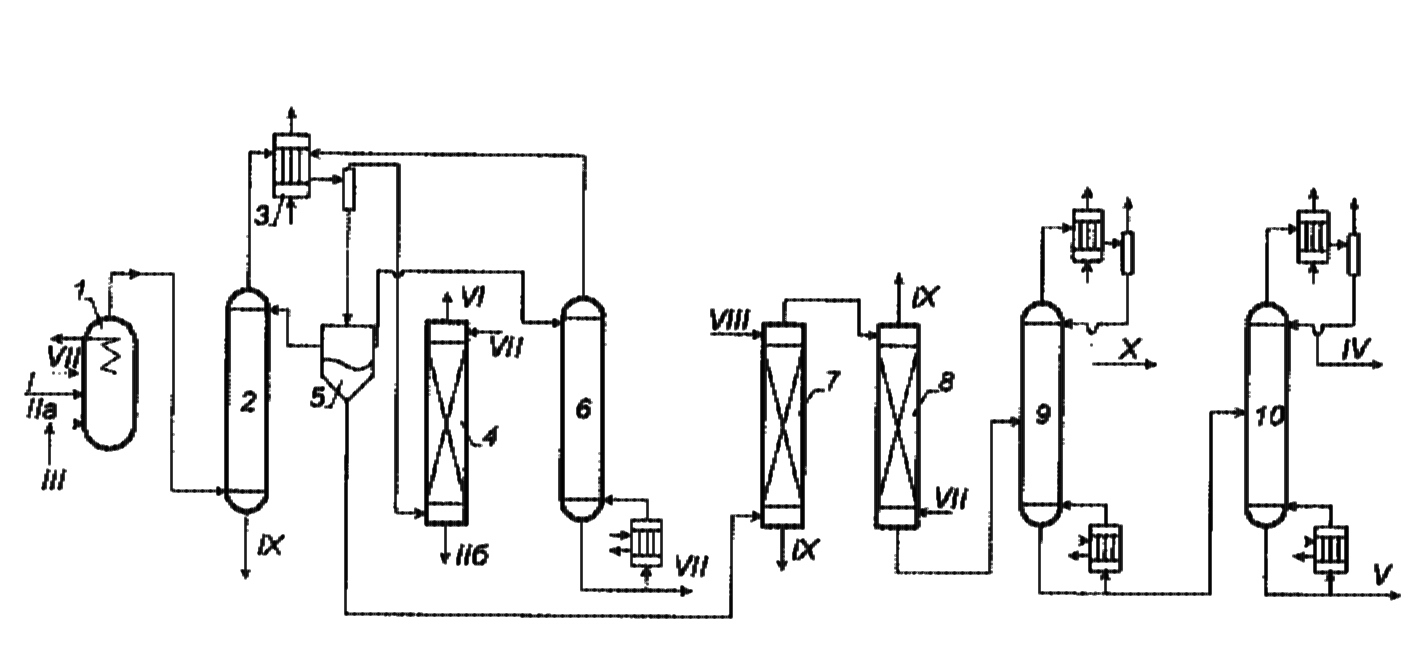 Рис. 1. Технологическая схема получения 1,2-дихлорэтана оксихлорированием этилена в паровой фазе: 1 - реактор; 2 - закалочная колонна; 3 — конденсатор; 4 - абсорбер; 5 - сепаратор жидкость-жидкость; 6 - колонна гетероазеотропной ректификации; 7,8 - колонны отмывки от хлораля; 9,10 - ректификационные колонны; I - этилен; II - хлористый водород (а) - газ; (б) - концентрированная соляная кислота; III - воздух (технический кислород); IV - 1,2-дихлорэтан; V - полихлориды; VI - абгаз; VII - вода; VIII - раствор щелочи; IX - солевые стоки; X - легколетучие примеси Описание технологической схемы В реактор 1 (в данном случае с псевдоожиженным слоем катализатора) подаются этилен, HCl и воздух (или кислород) в соотношении, обеспечивающем 3—5 % избыток этилена (по объему). Температура в реакторе поддерживается 210-260 °С. Выходящие из реактора реакционные газы содержат пары 1,2-дихлорэтана, полихлориды, реакционную воду, хлорид водорода и инертные газы. Они поступают в закалочную колонну 2, в которой происходит охлаждение парогазовой смеси и удаление из нее непрореагировавшего хлорида водорода и инертных газов. При этом пары конденсируются в конденсаторе 3. Хлорид водорода с инертными газами поступает в абсорбер 4, орошаемый водой, для улавливания хлорида водорода. Конденсат поступает во флорентийский сосуд 5. Водный слой из флорентийского сосуда 5 возвращается частично в закалочную колонну, а остальная часть направляется на очистку от 1,2-дихлорэтана в колонну гетероазеотропной ректификации 6. Из куба этой колонны фузельная вода направляется на очистку, а пары колонны - в конденсатор 3. Нижний слой (1,2-дихлорэтан-сырец) флорентийского сосуда 5 промывается раствором щелочи и водой в колоннах отмывки 7 и 8 от хлораля, образовавшегося в процессе оксихлорирования за счет побочной реакции. Далее 1,2-дихлорэтан поступает в ректификационную колонну 9 для отгонки легколетучих примесей. И наконец, в ректификационной колонне 10 1,2-дихлорэтан отделяется от полихлоридов. В этом процессе конверсия этилена составляет ≈ 95 %, хлорида водорода - ≈ 99 %; выход 1,2-дихлорэтана- ≈ 97%. Преимущество этого метода обусловлено тем, что в основном аппарате наблюдается меньшая коррозия за счет проведения процесса в паровой фазе и регенерируется теплота реакции с получением технического пара. Вместе с тем образуется много отходов в колоннах отмывки 7 и 8 и закалочной колонне 2, а также получается разбавленная соляная кислота в абсорбере 4. Следовательно, с точки зрения создания безотходного производства этот способ не может конкурировать с прямым хлорированием этилена. Технология получения 1,2-дихлорэтана оксихлорированием этилена относится к одностадийным по химической составляющей процесса и непрерывной. Используется дешевое и доступное сырье. Важной особенностью этого процесса является то, что в качестве галогенирующего агента применяется хлороводород, который получается при термическом пиролизе 1,2-дихлорэтана. Процесс имеет достаточно высокую эффективность, хотя и уступает по показателям галогенированию этилена. Высокие конверсии реагентов за один проход позволяют организовать технологию без рециркуляции по компонентам и потокам. В полной мере в технологии реализован принцип полноты выделения продуктов из реакционной смеси. В первую очередь это связано с высокими требованиями к чистоте 1,2-дихлорэтана (>99,2 %), поступающего на стадию термического пиролиза с получением винилхлорида. Высококипящая фракция может подвергаться деструктивному хлорированию с получением четыреххлористого углерода как товарного продукта. Процесс можно отнести к технологиям с низким энергопотреблением и высокой полнотой использования энергии системы, поскольку реакционная стадия продуцирует значительное количество высокопотенциального тепла, которое может быть утилизировано за счет использования в процессах разделения или в других производствах. В настоящее время в производствах винилхлорида сбалансированным по хлору методом степень утилизации тепла оксихлорирования этилена достигает более 97 %. К сожалению, процесс сопровождается образованием отходов в колоннах отмывки 7 и 8 и закалочной колонне 2, а также получением разбавленной соляной кислоты в абсорбере 4. Наличие отмывочных колонн не дает возможности отнести процесс оксихлорирования к технологиям с минимальным расходом воды. Технология позволяет применять аппараты и линии большой единичной мощности. В большей степени этот принцип может быть реализован именно построением линий большой единичной мощности, поскольку мощности реакторов даже при использовании кипящего слоя ограничены возможностью отвода тепла реакции. Не в полной мере реализован в технологии оксихлорирования и принцип полноты использования отходов производства. Как правило, легко и тяжелокипящие фракции хлорорганических продуктов направляются на сжигание. Раньше на отдельных промышленных предприятиях тяжелокипящая фракция использовалась как сырье для получения четыреххлористого углерода. Сейчас его производство запрещено Монреальской конвенцией по защите озонового слоя. Оптимальные условия Процесс оксихлорирования может проводиться в стационарном или псевдоожиженном слое катализатора - синтетического пористого носителя (оксида алюминия или алюмосиликат с нанесенными на него солями меди). Тепло снимается через встроенные в реактор теплообменники. Температура в реакторе поддерживается 210-260 °С. В качестве окислителя используют кислород воздуха (тогда воздух подается при давлении 0,3-1,0 МПа) или чистый кислород, что позволяет лучше организовать рециркуляцию непрореагировавших веществ. Кислород для окисления НС1 обычно подается с небольшим избытком (≈5 %) по отношению к стехиометрическому. При этом конверсия НС1 и кислорода достигает 80—90 %, а 2-5 % этилена превращается в СO2. Материальный балансИсходные данные:
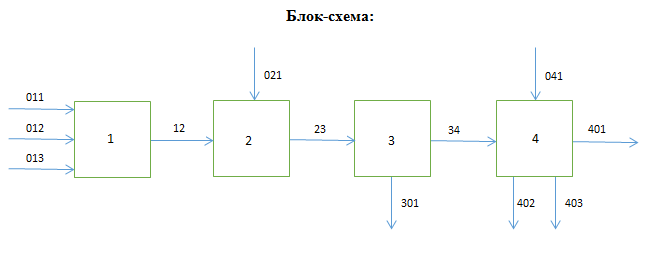 1 – синтез, 2 – закалка, конденсация, абсорбция, 3 – разделение органической и водной фаз, 4 – промывка; 011 – поток этилена 012 – поступающий хлороводород 013 – поступающий кислород 12 – реакционные газы 012 – вода в абсорбер 23 – конденсат на разделение 301 – хлороводород водный 34 – раствор на промывку 041 – раствор щелочи 401 – 1,2-дихлорэтан 402 – хлорид натрия 403 – гликосалиевая кислота Расчет Материального балансаМасса поступающего хлороводорода: 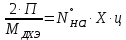 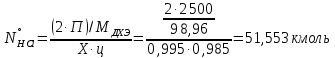 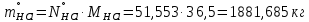 Масса поступающего этилена: 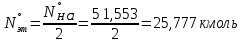 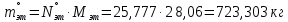 Масса поступающего кислорода: 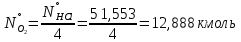 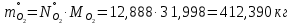 Масса непрореагировавшего хлороводорода: 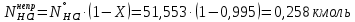 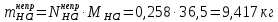 Масса воды, поступившей в абсорбер: 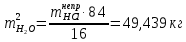 Количество образовавшегося хлораля: 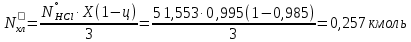 Масса поступившей щелочи: 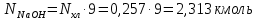 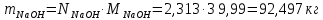 Масса воды, поступившей со щелочью: 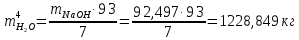 Масса образовавшегося хлорида натрия: 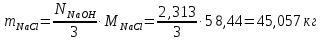
Технологические показатели
Поточная диаграмма синтеза этилбензола1- Свежий бензол 2- Этилен 3- Этилбензол 4- Тэтраэтилбензол 5- Непрореагировавший этилен 6- Возвратный бензол 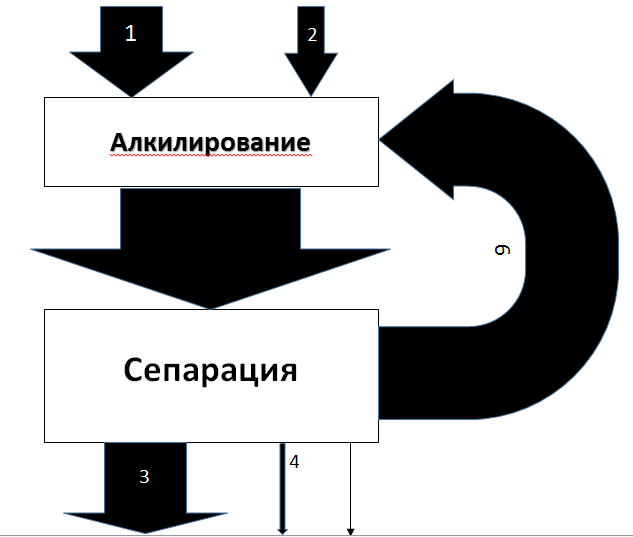 Список используемой литературы1. Флид М. Р. Винилхлорид: химия и технология. В 2-х кн. Кн. 1 / М. Р. Флид, Ю. А. Трегер. – М.: Калвис, 2008. – 584 с. 2. Лебедев Н.Н Химия и технология основного органического и нефтехимического синтеза. – М.: Химия, 1988. Приложение  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
