Лабораторный практикум_Термодинамика. Лабораторная работа 1 калориметрия раздел " Термодинамика" лабораторная работа " калориметрия" Цель работы
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
Теоретическая частьИзучение распределения вещества между двумя несмешивающимися растворителями представляет собой большой интерес, т.к. может дать ценные сведения, необходимые для проведения экстрагирования, а также указать на наличие диссоциации, ассоциации или других химических реакций растворённого вещества в растворе. Если к двум соприкасающимся несмешивающимся жидкостям прибавить какое-нибудь растворяющееся вещество, растворимое в той и другой жидкости, то оно распределяется между обоими жидкими слоями в определённом постоянной приданной температуре соотношении. Этот закон, характеризующий равновесное состояние системы, может быть выведен следующим образом. Предположим, что растворённое вещество в обоих растворителях находится в одинаковом состоянии, например в виде одиночных (мономерных) молекул и обозначим активность растворённого вещества в растворителе 1 (первая фаза) через aiI , в растворителе 2 (вторая фаза) аiII . как известно, химические потенциалы веществ, находящихся в двух сопряжённых фазах, должны быть одинаковыми. Таким образом, если в первой фазе химический потенциал исследуемого вещества (i -того) MiI=MiIcm + RT ln aiI А во второй фазе MiII=MiII,cm + RTln aiII В состоянии равновесия MiI=MiII, отсюда MiI,cm +RTln aiI=MiII ,cm +RTln aiII, отсюда 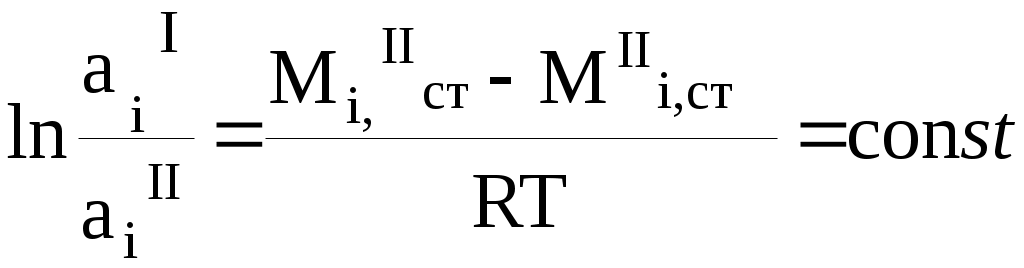 где: 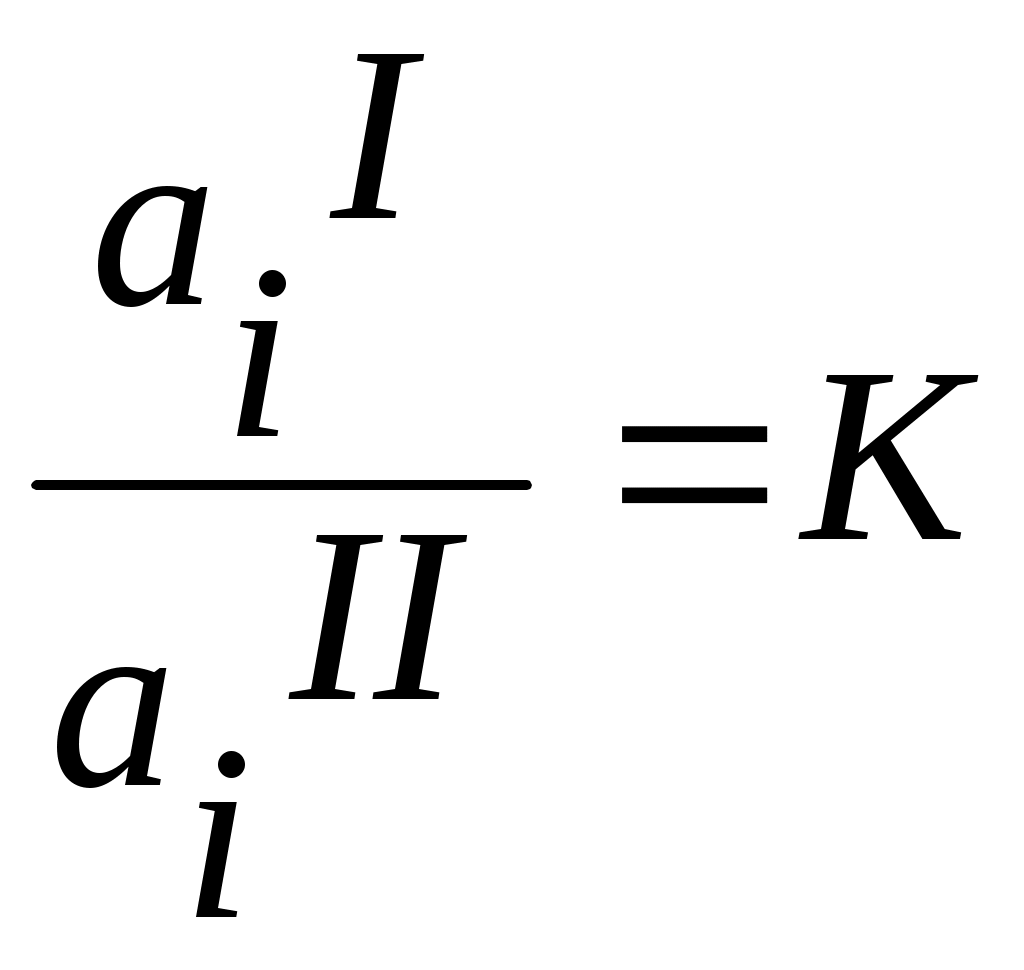 Величину К называют коэффициентом распределения, который зависит только от температуры. Для разбавленных растворов вместо отношения активностей для расчета коэффициента распределения можно использовать отношение мольных долей растворенного вещества в обоих фазах или отношение концентраций: 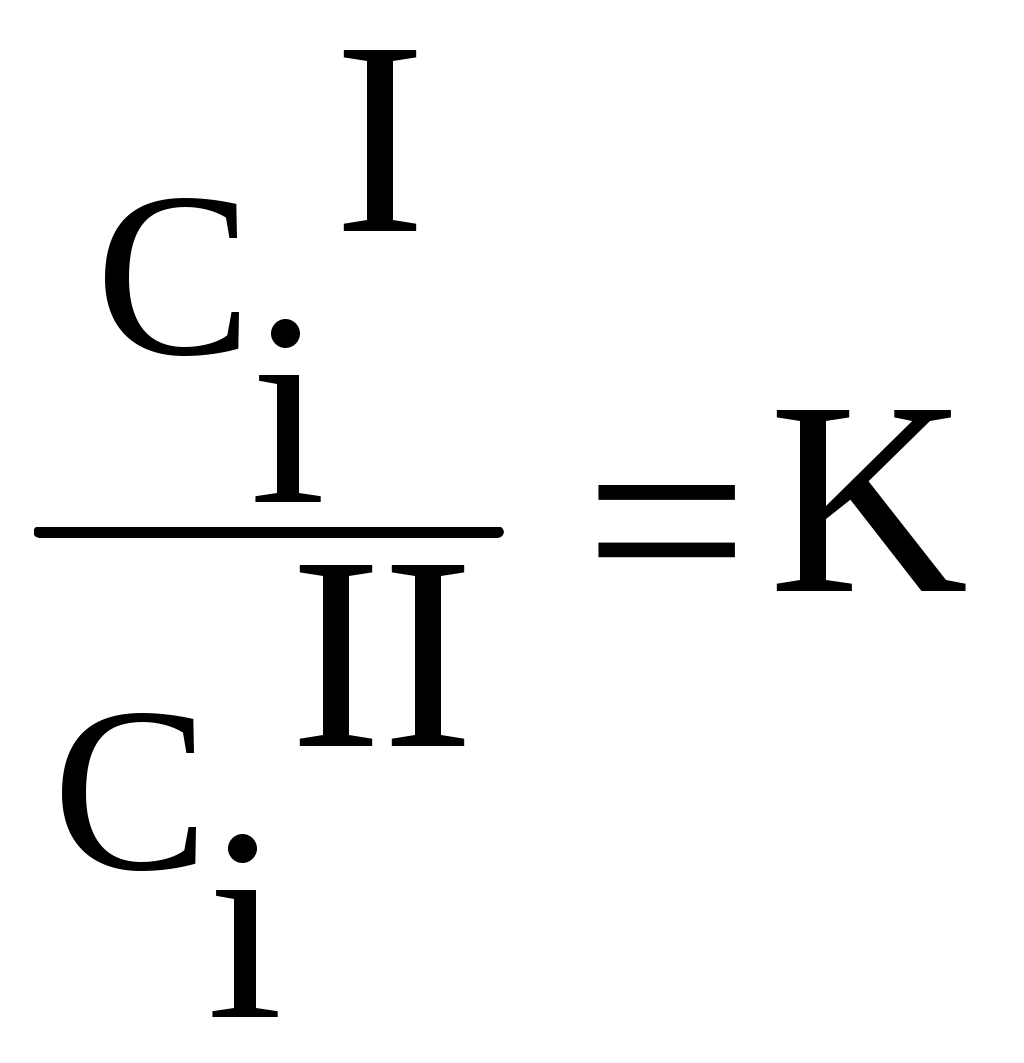 (1) (1)Н.А.Шилов и Л.К.Лепин нашли, что в ряде случаев закон распределения может быть представлен уравнением: 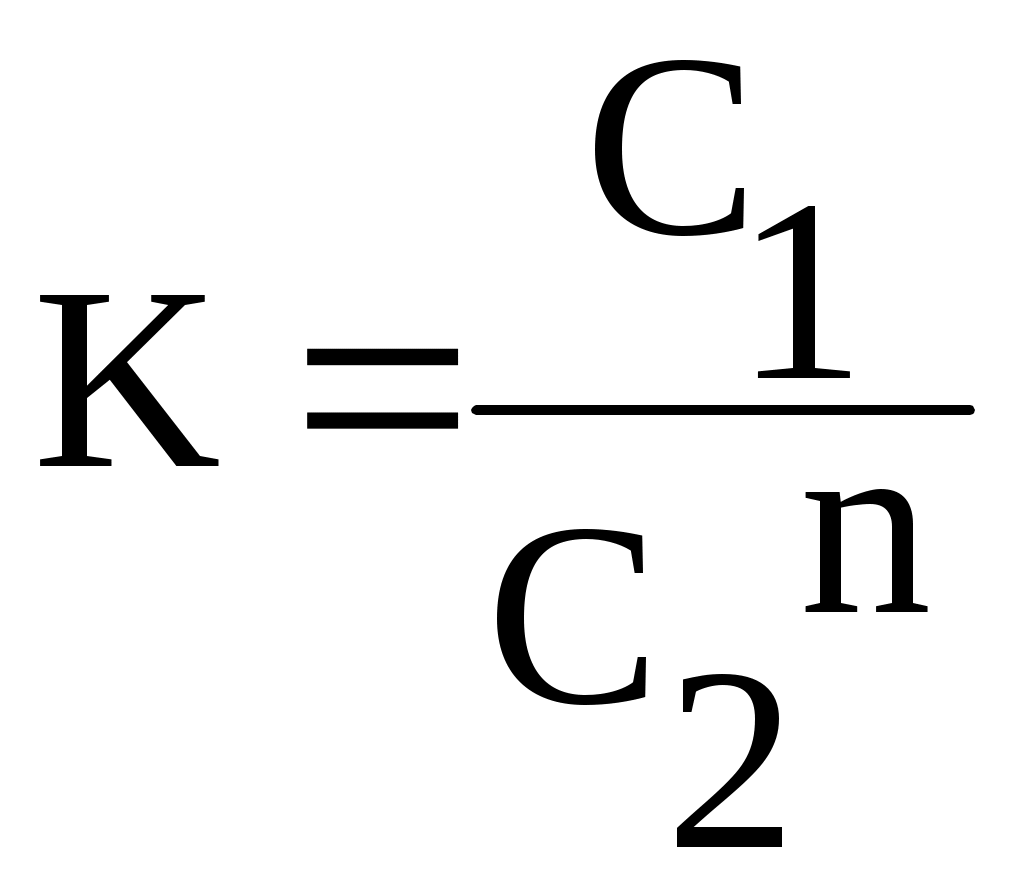 (2) (2)где n - показатель при постоянной температуре, не зависящий от концентрации и характеризующийся свойствами данных трёх компонентов. Отклонения от закона распределения наблюдается при изменении состояния растворённых молекул в одной из фаз системы. Такими изменениями могут быть, например, диссоциация или ассоциация растворённого вещества. При этом устанавливается сложное равновесие между простыми и ассоциированными или диссоциированными молекулами или ионами в пределах каждой фазы, а также между частицами, одинаковыми для всех фаз системы и распределение между ними в данном соотношении. В случае ассоциации или диссоциации закон распределения можно записать так: 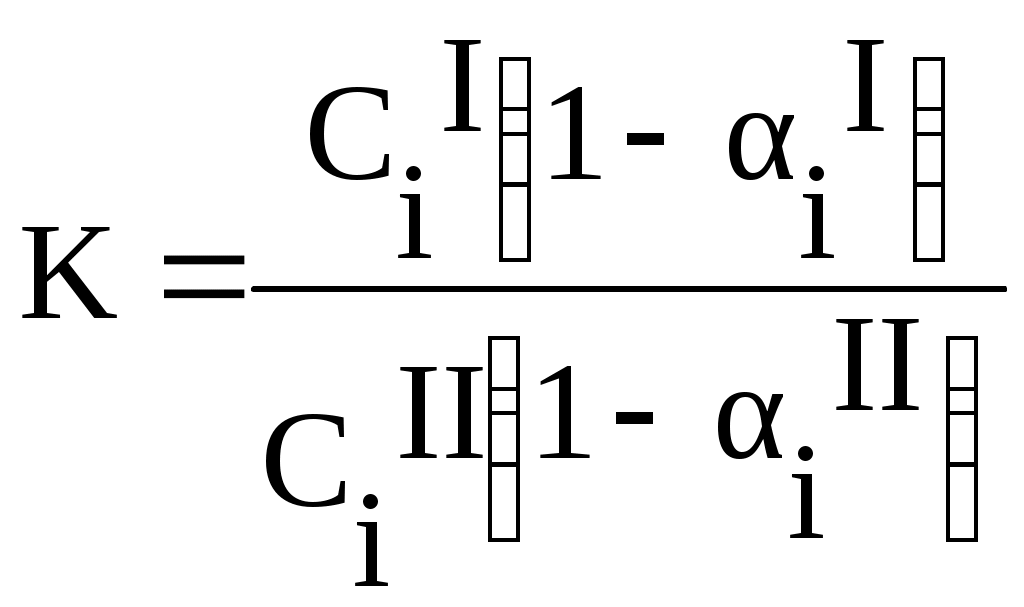 где αiI-степень диссоциации или ассоциации распределяемого вещества в первом растворителе; α iII-степень диссоциации или ассоциации распределяемого вещества в другом сопряженном растворителе. Закон распределения широко используется для решения задач, связанных с экстрагированием вещества из раствора. При экстракции коэффициентом распределения условились называть отношение концентрации раствора, из которого экстрагируется распределяющееся вещество, к концентрации раствора, которым производится экстрагирование. Принадлежности для работы: Колбы на 250мл - 4шт, аппарат встряхивания, пипетки на 20, 25мл, 0,05 н раствор йода в органическом растворителе, 0,05 н раствор тиосульфата, крахмал, органические растворители, колбы на 100 - 150 мл-6шт для титрования, пипетки на 5, 10, 20мл с делениями. Экспериментальная часть Работа состоит из двух этапов: Приготовление серии рабочих растворов. Определение содержания иода в водном и органическом слоях после установления фазового равновесия. Методика выполнения работы Этап 1. Приготовление рабочих растворов. Изучение равновесия распределения иода между водой и толуолом (CCI4, хлороформом) проводим при комнатной температуре. Иод плохо растворим в воде, но достаточно хорошо в толуоле (или CCI4, хлороформе), при этом указанные выше органические растворителя не смешиваются с водой. Для работы готовят четыре смеси из 0,05 н раствора йода в органическом растворителе и помещают их в отдельные чистые и сухие колбы с притертыми пробками, состав смесей указан в табл. 1.
Б) Приготовлены таким образом смеси, поставить на аппарат встряхивания на 30 -40 мин. По окончании встряхивания колбы оставить на 15-20 мин до полного расслоения жидкостей. В) Затем содержимое вылить в делительную воронку, отделить водный слой от неводного и определить содержание йода в обоих слоях титрования гипосульфитом в присутствии крахмала. Для определения концентрации органического слоя взять пипеткой 2 мл пробы и перенести в колбу для титрования, содержащую 25 мл дистиллированной воды, и титровать 0,05 н раствором Na2S2O3 в присутствии крахмала. Для определения концентрации водного слоя пипеткой 20-25 мл отобрать пробы и титровать 0,001 н раствором Na2S2O3 в присутствии крахмала. Если исходная водная проба окрашена в интенсивный коричневый цвет, то крахмал следует добавлять только в конце титрования, когда раствор приобретет соломенно-желтую окраску, в противном случае результаты титрования будут сильно завышены. Тиосульфатом натрия можно оттитровать йод только в водном слое. Поэтому при определении концентрации йода в органической фазе к титруемой пробе органической жидкости необходимо добавлять воду. Иод постепенно экстрагируется в водный слой, где и восстанавливается тиосульфатом. Для измерения концентрации йода в органическом слое отбирают аликвоту объемом 2 мл и переносят ее в колбу для титрования, содержащую 25 мл дистиллированной воды. Титрование проводят 0,05 М раствором Na2S2O3 в присутствии крахмала. В процессе титрования колбу все время встряхивают, чтобы облегчить экстракцию йода в водный слой, а титрант прибавляют медленно. Титрование продолжается до момента обесцвечивания водного и органического слоев. При работе с органическими веществами и электрическими приборами необходимо особо строго соблюдать требования техники безопасности. Также следует обратить внимание на следующие обстоятельства: а) йод быстро улетучивается, причем скорость этого процесса возрастает с увеличением температуры. Поэтому колбы с растворами после их разделения следует закрывать пробками (не резиновыми); б) оттитрованный раствор снова синеет, т.к. I" окисляется кислородом воздуха: Каждый раствор титровать по 3 раза и взять средний результат. В общем случае заранее трудно предсказать, будут ли молекулярный вес растворённого вещества одинаковым в обоих растворителях, поэтому надо пользоваться формулой: 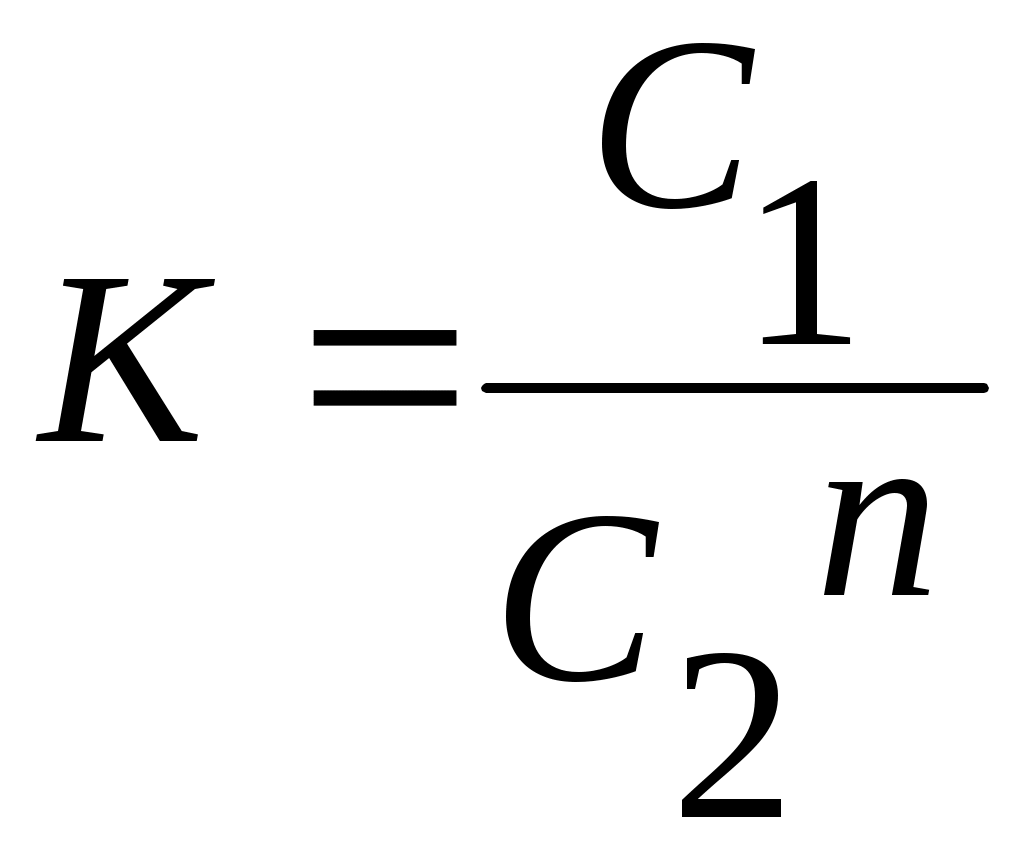 (3) (3)Условно в числитель ставят концентрацию в верхнем слое, а в знаменатель - в нижнем и в степень n возводят. Для расчёта величины К требуется знать равновесной концентрации С1 в верхнем и С2 в нижнем слоях и значение n. Концентрацию рассчитывают по формуле: C·V=V1·N Где: N- нормальность титрованного раствора, V- объём титруемого раствора V1- объём раствора, израсходованного на титрование пробы. Если исследовалось несколько различных концентраций, то экспериментальные данные наносят на график и получают прямую линию (или определяют по методу наименьших квадратов) в координатах lg C1=φ(lg C2), тангенс угла наклона которой и будет равен n. Зная С1 и С2 и n, рассчитывают коэффициент распределения для всех четырёх смесей и берут среднее значение. |
