Лабораторный практикум_Термодинамика. Лабораторная работа 1 калориметрия раздел " Термодинамика" лабораторная работа " калориметрия" Цель работы
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
КАРАГАНДИНСКИЙ УНИВЕРСИТЕТим. Е. А. БУКЕТОВА Химический факультет Кафедра физической и аналитической химииЛАБОРАТОРНАЯ РАБОТА №2 ВЗАИМНАЯ РАСТВОРИМОСТЬ ДВУХ ЖИДКОСТЕЙ Раздел: Термодинамика ЛАБОРАТОРНАЯ РАБОТА ВЗАИМНАЯ РАСТВОРИМОСТЬ ДВУХ ЖИДКОСТЕЙ Цель работы: определение температур расслаивания жидких смесей различного состава с ограниченной взаимной растворимостью и построение на основании опытных данных фазовой диаграммы системы вода-фенол Теоретическая частьПервые систематический исследования взаимной растворимости жидкостей был осуществлены В.Ф. Алексеевым. Взаимная растворимость жидкостей существенно изменяется с изменением внешних условий. При смешении двух жидкостей возможны три случая взаимной растворимости: Жидкости в любых отношениях смешиваются друг с другом, образуя гомогенный раствор, например, вода - этиловый спирт, вода-ацетон, вода - глицерин. Жидкости смешиваются ограниченно, например, вода-эфир, вода – анилин. Жидкости практически не растворимы друг в друге, например, вода-ртуть, вода-бензин. Ограниченная взаимная растворимость наблюдается в том случае, когда переход молекул через поверхность раздела сопряжён с совершением работы, заметно превышающей среднюю энергию движения молекул жидкостей при данных условиях. Если жидкости химически не взаимодействуют, то изменение температуры влияет на растворимость лишь постольку, поскольку оно вызывает перераспределение энергии поступательного движения молекул. В большинстве случаев из-за возрастания доли молекул с большим запасом энергии взаимная растворимость жидкостей при повышении температуры увеличивается и при некоторой температуре, называемой критической температурой растворения (КТР), она становится неограниченной. В некоторых системах (вода-диэтиламин) взаимная растворимость увеличивается при понижении температуры, причем при определенной температуре может быть достигнута полная взаимная растворимость. Температура, ниже которой жидкости смешиваются между собой в любых соотношения, называется нижней критической температурой растворения. Обнаружены и такие системы, у которых полная смешиваемость достигается как при повешении, так и при понижении температуры, например, вода-никотин. Зависимость концентрации обоих слоев от температуры можно изобразить графически (рис.1). Положение критической точки на диаграмме определяется по правилу Алексеева: середины нод, расположенных между точками, изображающими составы равновесных жидких фаз при разных температурах, лежат на одной прямой, идущей от критической точки. Диаграмма состояния, отражающая растворимость жидкостей друг в друге при различных температурах, называется диаграммой растворения (растворимости). На рисунке 1 показана типичная диаграмма растворимости с верхней КТР.  Т К н м Е Ж A B Рисунок 1. Диаграмма температура – состав для ограниченно смешивающихся жидкостей с верхней критической точкой При повышении температуры фазовые точки м и н поднимаются и сближаются (так как увеличивается взаимная растворимость жидкостей). Уменьшение разницы в составах сопряженных растворов объясняется тем, что процессы растворения Б в А и А в Б эндотермичны, т. е. дифференциальные теплоты растворения положительны; вследствие этого нагревание благоприятствует растворению. Кривые ЕмК и ЖнК характеризуют влияние температуры на растворимость соответственно Б в А и А в Б. При некоторой температуре (tKp.) состав сопряженных растворов совпадает. С ростом температуры связующая прямая поднимается и сокращается; при t — tКр она превращается в точку. Таким образом, часть диаграммы, ограниченная кривой ЕКЖ, отвечает области расслоения, а часть, находящаяся вне кривой, — гомогенной системе. Подлежащая изучению система вода - фенол схематически изображена на рис. 2 (для удобства правая часть диаграммы несколько увеличена). Кривые аБ и ВЭ отвечают процессу кристаллизации фенола при охлаждении; кривая 6Э — процессу кристаллизации льда; кривая БКВ— кривая расслоения, левая ее ветвь выражает состав фенольного раствора, правая ветвь — водного раствора. Над кривой аБКВЭб устойчива жидкая фаза. Области соответствуют: аБг — смеси фенола с раствором, насыщенным фенолом, БКВ — смеси фенольного и водного растворов, гВЭд — смеси фенола с раствором, насыщенным фенолом, Эбе — смеси льда с раствором, насыщенным льдом. Ниже изотермы дЭе — область смеси кристаллического фенола и льда. Рассмотрим диаграмму с точки зрения правила фаз и проследим изменения, происходящие с жидкостями различного состава при их охлаждении, причем примем, что во всех десяти рассматриваемых случаях взято одинаковое количество вещества, а давление фиксировано. Точка 1. При ta появляется твердый фенол; система становится безвариантной, что отвечает температурной остановке, длительность которой зависит от количества фенола и от скорости отвода тепла (отвердевания фенола). В момент исчезновения последней капли фенола система вновь станет одновариантной, а температура снова начнет понижаться, так как с исчезновением жидкой фазы будет исчерпан и источник теплоты. 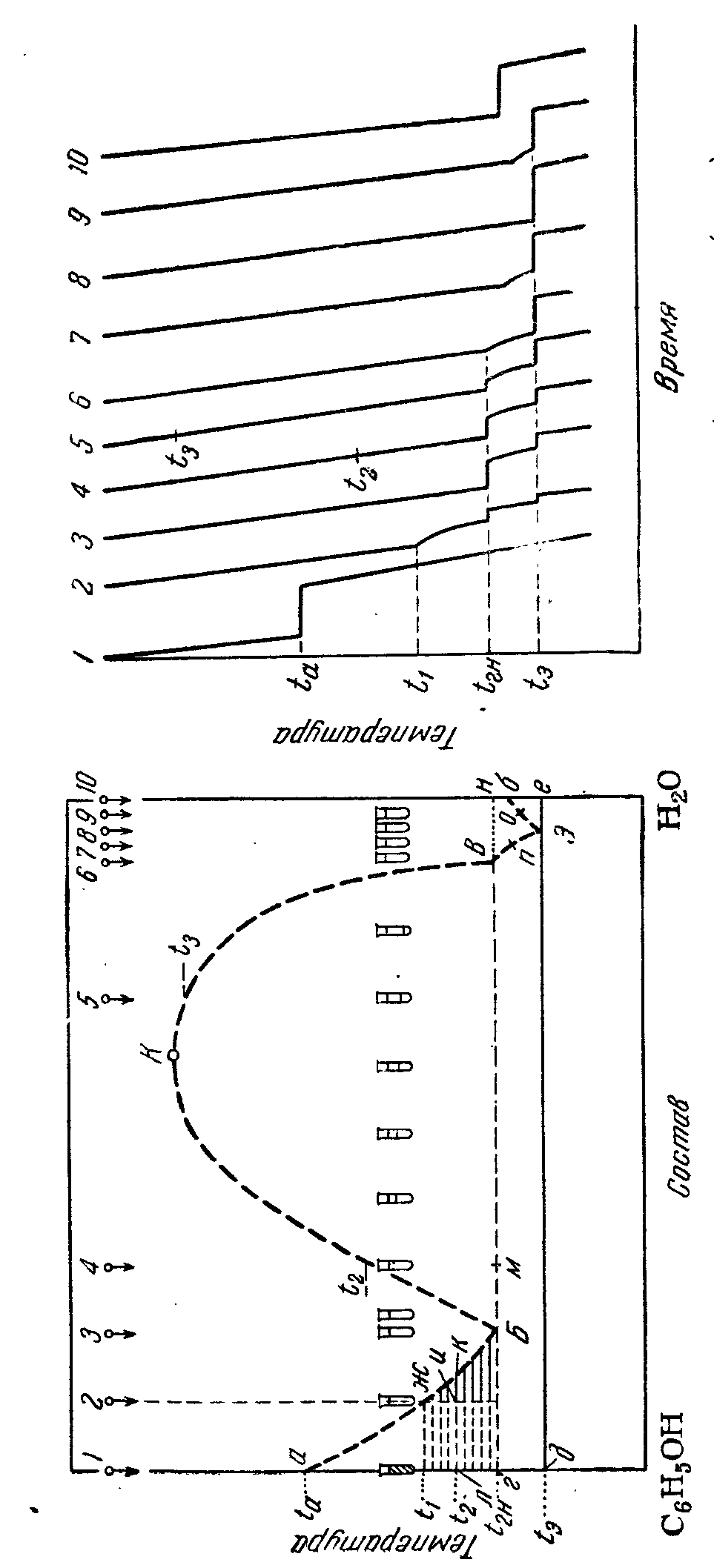 Рисунок 2. Диаграмма температура – состав и кривые охлаждения в системе вода - фенол Процесс охлаждения воды (точка 10 и кривая охлаждения 10) аналогичен рассмотренному. Точка 2. Будем называть эту смесь фенольным раствором. Система является двухвариантной. Следовательно, можно изменять в известных пределах температуру и состав, не нарушая числа фаз в системе. При U начнет кристаллизоваться фенол (точка ж). Темп охлаждения замедлится, что отразится на кривой охлаждения (см. кривую охлаждения 2). Система становится одновариантной, т. е. при t1 > t между концентрацией раствора и температурой будет определенная связь. Эта связь дается уравнением зависимости температуры отвердевания фенола от концентрации, которая графически выражается кривой аБ. Состав раствора, насыщенного фенолом, определяется пересечением данной изотермы с кривой аБ. Связь же между количеством твердого фенола и раствора определяется правилом рычага; так, при температуре t2 : Результатам кристаллизации фенола является относительное обогащение фенольного раствора водой. В точке Б раствор становится насыщенным обоими компонентами; это приводит к выделению Н2O и при этом в жидком виде, так как tгн > tб ввиду того, что при tгн вода обладает определенной растворяющей способностью (при этой температуре концентрация фенола в насыщенном растворе фенола в воде численно равна она образует первую каплю сопряженного раствора состава В. Появление третьей фазы в соответствии с правилом фаз означает превращение системы из одновариантной в безвариантную т. е. приводит к температурной остановке (см. кривую охлаждения 2). От фенольного раствора отделяются фенол и вода в пропорции, отвечающей точке Б, образуя водный раствор состава В, а избыток фенола кристаллизуется. Таким образом, по мере отвода теплоты раствор Б распадается на твердый фенол и раствор В, т. е. равновесие сдвигается вправо. Точка системы, отвечающая суммарному составу жидких фаз, перемещается от точки Б к точке В, и если в данное мгновение она занимает положение м, то это значит, что соотношение между образующимся и исчезающим растворами равно отношению отрезка Бм к отрезку мВ. В точке В в рассматриваемой системе исчезает последняя капля фенольного раствора, температура вновь начинает понижаться, и фенол выделяется из водного раствора, т. е. возобновляется процесс, протекавший на кривой аБ и прерванный из-за наличия области БКВ. При достижении t3 раствор будет насы- щенным не только фенолом, но и водой, т. е. начнется кристаллизация эвтектики Э без изменения состава жидкой фазы. Появление льда (третья фаза) вновь приводит к температурной остановке. После отвердевания последней капли жидкости температура будет падать без каких-либо изменений в системе. Длины отрезков на кривой охлаждения, отвечающих температурным остановкам как для состава 2, так и для составов 3, 4 и 5 (см ниже), приняты пропорциональными количеству кристаллизующегося вещества. Последнее легко определить, исходя из общего количества первоначально взятой смеси и положения точек Б, В и м. Точка 3. При охлаждении до tгн в системе одна фаза. В точке Б раствор начинает распадаться на твердый фенол и раствор В. Дальнейшие изменения уже рассмотрены в связи с анализом охлаждения смеси состава 2. Так как в смеси 3 воды содержится больше, чем в смеси 2, и так как до tгн фенол не выпадает, то при прочих равных условиях длительность температурных остановок на кривом охлаждения будет большая, чем для состава 2. Точка 4. При охлаждении раствора 4 он при t2 начнет распадаться на водный и фенольный растворы; на кривой охлаждения момент расслоения вследствие незначительности теплового эффекта почти незаметен. При tгн появится твердый фенол и т. д. Точки 5—7. Процессы охлаждения этих растворов могут специально не рассматриваться. Первый из них аналогичен охлаждению раствора 4; процессы охлаждения растворов 6 и 7 повторяют заключительную стадию процессов охлаждения растворов 2—5 (начиная соответственно с точек В и п). Разница будет заключаться в том, что иными будут температуры расслоения, соотношение между фазами и длительность температурных остановок. Точка 8. При 1Э (точка Э) будет происходить одновременная кристаллизация фенола и воды и образуется эвтектическая смесь. Точка 9. Из раствора в точке о начнет кристаллизоваться лед; в точке Э отвердевание веществ происходит одновременно т. е. кристаллизуется весь оставшийся раствор. |
