Лабораторный практикум_Термодинамика. Лабораторная работа 1 калориметрия раздел " Термодинамика" лабораторная работа " калориметрия" Цель работы
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН КАРАГАНДИНСКИЙ УНИВЕРСИТЕТим. Е. А. БУКЕТОВА Химический факультет Кафедра физической и аналитической химииЛАБОРАТОРНАЯ РАБОТА №1 КАЛОРИМЕТРИЯРаздел: ” Термодинамика” ЛАБОРАТОРНАЯ РАБОТА “КАЛОРИМЕТРИЯ” Цель работы: 1. Изучение тепловых эффектов химических реакций. 2. Ознакомление с калориметрическим методом измерения тепловых эффектов. Теоретическая часть При растворении соли в воде, так же и при других изменениях состояния вещества, наблюдается поглощение либо выделение теплоты. Выделяющаяся или поглощающаяся теплота называется тепловым эффектом. Изучением тепловых эффектов при изменениях, происходящих с веществами, занимается наука термохимия. В основе термохимии лежит закон Гесса. Закон Гесса устанавливает, что если из данных исходных веществ можно различными путями получить заданные продукты, то независимо от путей получения, т. е. от вида промежуточных реакций, суммарный тепловой эффект для всех путей будет одним и тем же. Закон Гесса справедлив, если процесс протекает при Р и V = const и при условии, что система, в которой происходит процесс, не производит никакой работы против внешнего давления. Тепловой эффект, отнесенный к 1 г. растворяемого вещества, называется удельной теплотой растворения. Различают интегральную теплоту растворения и дифференциальную теплоту растворения (растворение в бесконечно большом количестве раствора). Дифференциальные теплоты растворения определяют методом расчета, а интегральные теплоты растворения – экспериментально. Интегральная теплота растворения зависит от числа молей воды, приходящихся на 1 моль растворенного вещества (см. таблицу). Таблица Интегральные теплоты растворения ΔН хлорида калия КCl
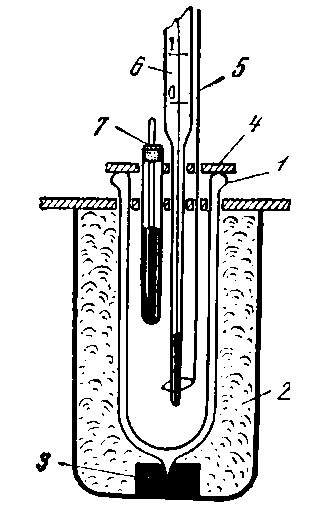
Устройство калориметра Тепловой эффект реакции измеряют в специальных приборах — калориметрах и наблюдают вызванное данным процессом изменение температуры ΔT. Калориметр состоит из калориметрического сосуда и изолирующей системы. Схема простейшего калориметра приведена на рис. 1.
Практическая часть Принадлежности для работы: Калориметр, термометр, ампула (стеклянная пробирка с двумя резиновыми пробками), стеклянная палочка, фарфоровая ступка, цилиндр. 1. ОПРЕДЕЛЕНИЕ ТЕПЛОВОЙ ПОСТОЯННОЙ КАЛОРИМЕТРА К – постоянная калориметра выражает количество тепла, которое необходимо подвести к участвующей в теплообмене части калориметра, чтобы поднять его температуру на 1 С0. Для определения тепловой постоянной К измеряют понижение температуры при растворении соли в воде и, зная теплоту растворения этой соли, рассчитывают К по уравнению теплового баланса: Q = [(G + g) · C+K] · Δt · Μ / g (1), где: Q – молярная интегральная теплота растворения КCl (см. таблицу) или исследуемого вещества (моль); G – навеска воды, г; g – навеска КCl или исследуемого вещества, г; С – теплоемкость раствора, 4,17 Дж/г*К; M – молекулярный вес растворенного вещества, г/моль; Δt – действительное изменение температуры в процессе растворения, которое находят графически, учитывая знак ΔТ, отвечающий понижению или повышению температуры. Последовательность выполнения работы: Установить термометр. Отвесить на технических весах 2 г. исследуемого вещества, перенести его во взвешенную на аналитических весах ампулу с точностью до 0,001г. Из разности находят массу соли. Взвешивают калориметрический сосуд на технических весах и наливают в него 300 мл дистиллированной воды. Закупоривают калориметр пробкой и укрепляют в ней термометр. Вставляют ампулу в специальное отверстие пробки сосуда, чтобы нижняя часть ампулы была покрыта водой. Пустить мешалку, постоянно увеличивая скорость оборотов, но не доводя до разбрызгивания воды. Записывать показания термометра с точностью до 0,002 С0 через каждые 30 сек. Для учета теплообмена калориметра с окружающей средой и определения истинного изменения температуры во время опыта весь процесс делится на три периода: а) Предварительный период, продолжающийся 5 мин. б) Главный период (процесс растворения соли). в) Заключительный период (5 мин). Включив мешалку, наблюдают за температурой, которая изменяется вследствие теплообмена с окружающей средой. Когда процесс этот станет стационарным, и изменение температуры в отрезок времени станет практически постоянным, т. е. когда установится равномерный ход температуры, делают ее отсчеты с точностью до 0, 002 С0 в течение 5 мин через каждые 30 сек (предварительный период). Затем палочкой пробивают пробку ампулы с солью так, чтобы вся соль высыпалась в воду, и наблюдают за изменением температуры (главный период), продолжая отмечать значения ее таким же способом, как и раньше, концом главного и началом заключительного периода принято считать установление вновь равномерного хода изменения температуры. В заключительном периоде температура отмечается так же, как и в предварительном (в течение 5 мин). Для расчета точного измерения температуры растворения соли вычерчивают на миллиметровке график, где на оси ординат откладывают изменения температуры за каждые 30 сек., а на оси абсцисс – время. Если соединять найденные точки, то для предварительного и заключительного периодов получаются две наклонные прямые (усредненные), наклон которых будет зависеть от разности температур между калориметром и окружающей средой. Примерный график, который может получиться, приведен на рисунке. В виду того, что во время процесса происходит обмен теплом между калориметром и окружающей средой, необходимо сделать соответствующую поправку, чтобы получить изменение температуры, вызванное растворением соли. Для этого продолжают линию, соединяющую температуру предварительного периода и линию заключительного периода (пунктирные линии на графике Bm и Cn). На середине главного периода в точке k проводят прямую, параллельную оси. Отрезок ЕF и будет ΔТ изменением температуры в результате растворения соли. Определив значение, вычисляют постоянную калориметра К по уравнению (1).  Рисунок где АВ – предварительный период, ВС – главный период, СD – заключительный период. Запись результатов измерений ведут по следующей схеме:
2. ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ РАСТВОРЕНИЯ ТВЕРДОГО РАСТВОРА После того, как найдена величина К - постоянной калориметра, можно приступить к определению теплоты растворения твердого раствора КCl + KBr. Опыт подобен предыдущему. Теплоту растворения вычисляют по уравнению: Q = [(G + g) · C + K] · Δt М/g (2), где Q – теплота растворения соли. 3.ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ ОБРАЗОВАНИЯ КРИСТАЛЛОГИДРАТОВ ИЗ БЕЗВОДНОЙ СОЛИ Растертый в порошок CuSO4·5H2O (9-10 г.) помещают в фарфоровую чашку и нагревают при постоянном перемешивании до тех пор, пока не получится серый порошок безводной соли. Последнюю пересыпают в пробирку, которую сразу закрывают резиновой пробкой. После охлаждения берут навеску безводной соли (2 г.) и определяют изменение при растворении ее в 155-300 мл воды, как описано выше. По найденной величине постоянной калориметра К и результатам опыта вычисляют теплоту растворения безводной соли по уравнению (2). 4. ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ НЕЙТРАЛИЗАЦИИ В этой части работы определяют удельную на 1 г. раствора кислоты и полную (на 1 г-экв) кислоты теплоту нейтрализации кислоты щелочью. Для проведения опыта берут избыточное против стехиометрического количества щелочи. Раствор готовят разбавлением 50 мл 10% раствора NaOH в мерной колбе до 500 мл. По разности весов заполненного щелочью и пустого калориметрического стакана устанавливают вес используемой в опыте щелочи с точностью до 0,1 г (250-300). Исследуемую кислоту вводят в пробирку (3-4 г.) кислоты HCl 6н. Пустую и заполненную кислотой пробирку взвешивают с точностью до 0,01 г. Выталкивают пробку и наблюдают за изменением температуры. В тепловой эффект, наблюдаемый при вливании раствора кислоты в раствор щелочи, помимо теплоты нейтрализации входят теплоты разведения кислоты щелочью и щелочи кислотой. Так как объем щелочи велик и мало изменяется от вливания к нему кислоты, то теплота разведения кислоты щелочью мала, ею можно пренебречь. Напротив, теплота разбавления кислоты щелочью значительна и ее нужно учесть. Теплоту разведения определяют, вливая раствор кислоты в чистую воду, взятую в таком же объеме, как щелочь. ΔH=ΔHнейтр. + ΔHразб. к-т ; ΔHразб.=К1*Δt1; где К1 – постоянная калориметра, Δt1 – изменение температуры при разбавлении кислот. Удельная теплота нейтрализации кислоты равна: Δh=(ΔHнетр. – ΔHразб.)/g, где ΔH НЕЙТР.=СК *Δt - тепловой эффект, наблюдаемый при нейтрализации g г кислоты. ΔHРАЗБ.=СК*Δt1– тепловой эффект, наблюдаемый при разбавлении g г. кислоты. Δh=СК*(Δt2 – Δt2)/g Теплоемкость системы вычисляют, как описано в пункте 1. Теплота нейтрализации 1 г-экв кислоты: Δ H =Δh*1000a/P, где: Δh – удельная теплота нейтрализации, кал/г, P – концентрация кислоты, вес.% а - эквивалентный вес кислоты. Задания: Составить график изменения теплоемкости с изменением температур. Определить постоянную калориметра.Определить интегральную теплоту растворения твердого раствора соли.Определить теплоту образования кристаллогидрата из безводной соли и воды. Определить удельную и полную теплоту нейтрализации сильной кислоты. Отчет о работе: Сделать чертеж калориметра. Составить график изменения температуры во времени Вычислить постоянную калориметра Вычислить теплоту растворения (по заданию преподавателя). Контрольные вопросы: Почему тепловые эффекты реакций, протекающих при постоянных объеме и давлении, являются функциями состояния системы? Что такое теплоты образования, нейтрализации, растворения, разбавления? Как вычислить тепловой эффект реакции по теплотам образования и теп- лотам сгорания веществ? Описать методы определения тепловой постоянной калориметра и истинного изменения температуры в нем. Почему надо записывать ход температуры, а не только начальное и конечное значения ее? В чем заключается основной закон термохимии? В каких случаях применяют основной закон термохимии для расчета тепловых эффектов? Какие процессы протекают при растворении соли? Что называется теплотой растворения вещества? В чем заключается калориметрический метод измерения теплоты растворения? Литература: Герасимов Я. И. «Курс физической химии», 1970 Киреев В. Я. «Курс физической химии», 1970 Горбачев С. В. «Практикум по физической химии», 1966, стр. 162-173. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН |