Лабораторный практикум_Термодинамика. Лабораторная работа 1 калориметрия раздел " Термодинамика" лабораторная работа " калориметрия" Цель работы
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
Отчёт о работеРезультаты опытов записывать по образцу:
Контрольные вопросыВ чём смысл закона распределения? Для чего при титровании прибавляется вода? Имеет ли значение, какое кол-во воды прибавляется? Можно ли считать Краспр идентичным константе равновесия? Каким образом можно определить Краспр графически? Изменится ли степень извлечения и коэффициент распределения иода, если: а) в системе изменить температуру; б) в водную фазу добавить вещество, образующее с иодом комплексное соединение; в) увеличить концентрацию иода в органическом слое? ЛитератураС.В. Горбачёв, Практикум по физической химии, Изд-во «Высшая школа», М., 1966, стр.249-257. Стромберг А.Г., Семченко Д.П. Физическая химия. М.: Высшая школа. - 1999,- 496 с. Практикум по физической химии. // Под ред. Кудряшова И.В.- М.: Высшая школа. - 1986,- 495 с. Практические работы по физической химии / Под ред. К.П.Мищенко и др. - Л.: Химия, 1982,- С.75-96. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН КАРАГАНДИНСКИЙ УНИВЕРСИТЕТим. Е. А. БУКЕТОВА Химический факультет Кафедра физической и аналитической химииЛАБОРАТОРНАЯ РАБОТА №6 АЗЕОТРОПНАЯ ПЕРЕГОНКА Раздел: Термодинамика Цель работы: изучение азеотропных свойств растворов. Теоретическая частьДиаграммы состояния, отражающие равновесие жидких и парообразных фаз, называются диаграммами кипения. Наиболее удобной формой представления диаграмм кипения является их изображение в координатах температура–состав. Если смесь двух летучих жидкостей представляет собой раствор с небольшими отклонениями от закона Рауля, её диаграмма кипения будет иметь вид, изображенный на рисунке: 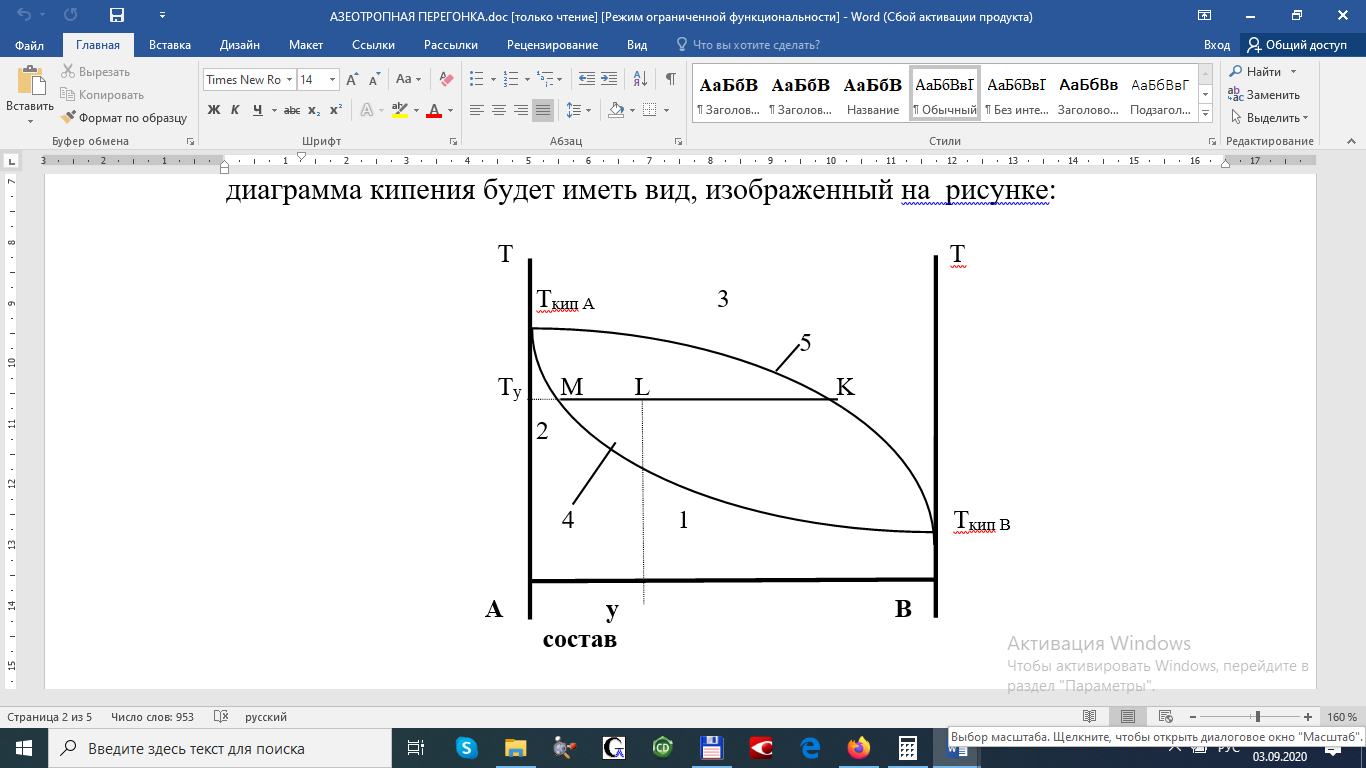 Диаграмма кипения. 1 область жидкости, 2 область кипящей жидкости, находящейся в равновесии с паром, 3 область пара, 4 ликвидус, 5 линия пара. Каждая точка линии ликвидуса 4 отвечает температуре начала кипения при нагревании смеси с определенным составом (или полной конденсации пара при охлаждении). Точки линии 5 соответствуют окончанию кипения при полном переходе жидкости в пар (или началу конденсации пара в жидкость при охлаждении). Область диаграммы над линией 5 отвечает парообразным (газообразным) системам, область под линией 4 – жидким растворам. Фазовое поле между линиями 4 и 5 соответствует гетерогенным системам, в которых находятся в равновесии кипящая жидкость и пар. При значительных положительных отклонениях от закона Рауля, когда общее давление пара над раствором превышает давление пара любого из чистых компонентов, и на диаграммах температура – состав появляется минимум, две ветви ликвидуса сходятся в точке Х с линией пара. При значительных отрицательных отклонениях от закона Рауля, когда общее давление пара над раствором становится ниже давления пара любого из чистых компонентов, на диаграммах температура состав появляется максимум: 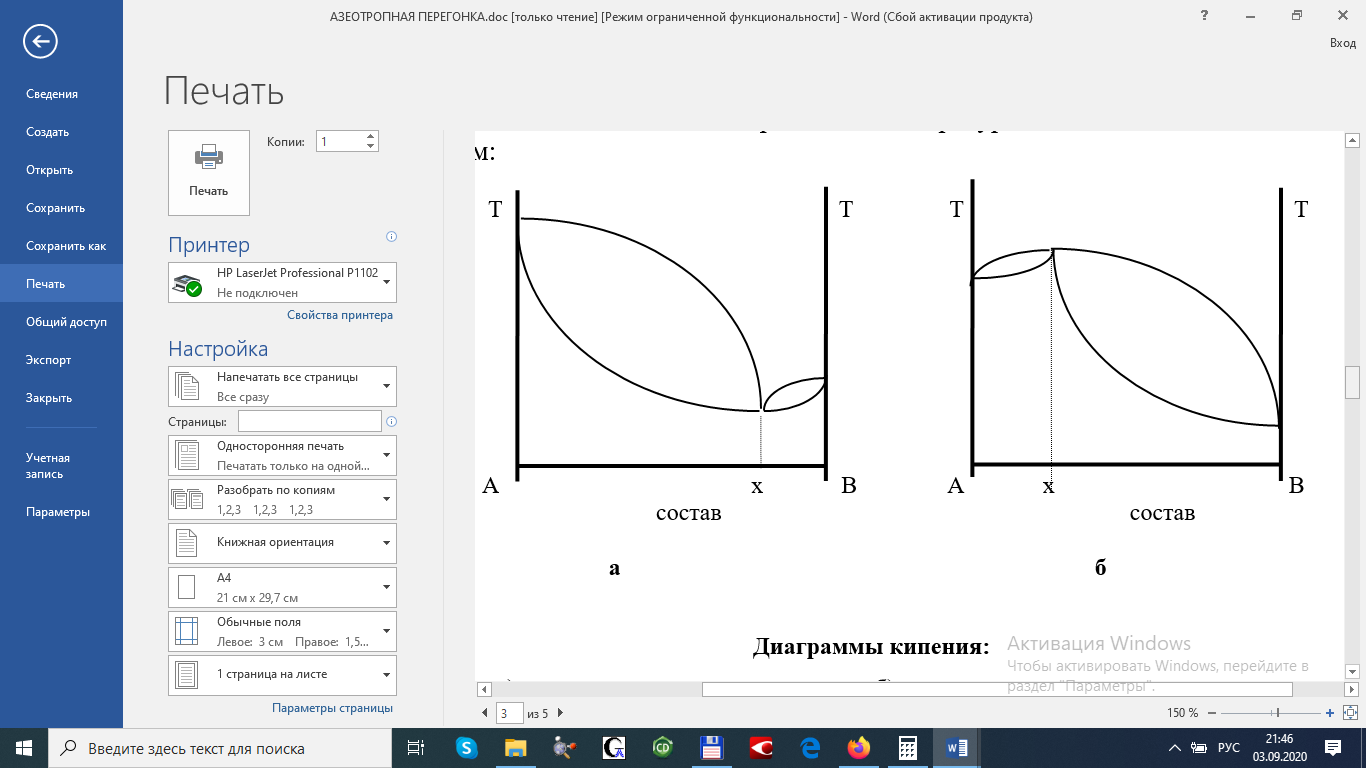 Диаграммы кипения: а) положительное отклонение б) отрицательное отклонение от закона Рауля (минимум от закона Рауля (максимум температуры кипения) температуры кипения) Растворы, состав которых отвечает этим экстремальным точкам, называются азеотропными (нераздельно кипящими или азеотропами). Их состав не меняется при кипении, и температура остается постоянной до полного перехода жидкости в пар (или до полной конденсации пара в жидкость при охлаждении). Такие смеси, в отличие от остальных, нельзя разделить перегонкой. В случае максимума при перегонке сначала будет отгоняться азеотропная смесь, имеющая более низкую температуру кипения и более высокое давление пара, чем температура кипения обоих компонентов. После отгона азеотропной смеси начнёт отгоняться тот компонент, который присутствует в перегоняемой смеси в избытке по сравнению с составом азеотропной смеси. Такой азеотроп называют «максимальным», если кривая упругости раствора проходит через минимум, то при перегонке сначала отгоняется компонент, присутствующий в избытке по отношению к составу смеси. После этого отгоняется азеотроп, имеющий минимальную упругость паров, т.е. максимальную температуру кипения («минимальный» азеотроп).В настоящее время известно большое количество азеотропных смесей, из которых более 90% являются «минимальными» азеотропами. Выбор добавляемой жидкости при азеотропной перегонкеВыбор добавляемой жидкости при азеотропной перегонке является необходимым условием и её успешного проведения. Для выделения из смеси компонента, присутствующего в небольшом количестве (например, следов влаги); при перегонке целесообразно добавлять такое количество вещества, которое образует с ним азеотроп с минимальной температурой кипения. Отделение влаги упрощается в том случае, если перегонный азеотроп расслаивается на две фазы. Например, для обезвоживания алифатических кислот или спиртов можно добавлять бензол. При этом примере отгонки воды с бензолом (азеотроп) верхний слой его посредством ловушки Дина – Старка возвращается в реакционную колбу, а вода может быть замерена в ловушке с делением. При азеотропной этерификацией смесь нелетучей или малолетучей кислоты кипятят с соответствующим спиртом, 1 мл воды и несколькими каплями концентрированной серной кислоты, которая является дегидратирующим агентом. В предлагаемой работе этерификация протекает по схеме: ROH + RCOOH RCOOR + H2O Контроль глубины реакции осуществляется по количеству выделившейся воды. Принадлежности для работыПрибор Дина – Старка, органическая кислота, концентрированная серная кислота, бензол, дистиллированная вода, пипетка на 25мл, на10мл, на 1 мл. Экспериментальная частьПорядок выполнения работы: А) в короткогорлую стеклянную колбу прибора Дина – Старка помещают 5 – 15 мл органической кислоты и спирта (по выбору преподавателя), 1мл воды и 10 капель концентрированной серной кислоты, а также 25 мл сухого бензола. В эту же колбу помещают несколько кусочков пемзы для предотвращения толчков при нагревании. Б) колбу присоединяют к отводу со шлифом ловушки Дина – Старка, которую в свою очередь соединяют с обратным холодильником. В рубашку холодильника пускают воду и нагревают колбу на электроплитке с закрытым обогревом с таким расчётом, чтобы из обратного холодильника в градуированный приёмник отгонялось 2 – 4 капли в секунду. В) перегонку продолжают до тех пор, пока уровень воды в пробирке не перестанет изменяться в течение 30 – 40 минут. Г) если растворитель имеет мутный вид, то пробирку выдерживают 30 минут в водяной бане с температурой 60 – 65 . Д) по выходу воды, выделяющейся за счёт этерификации (а), рассчитывают в весовых % количество полученного сложного эфира (х). Где: а – количество воды в мл, выделяющееся за счёт этерификации С – количество воды в мл, соответствующее теоретическому расчёту для заданной пары. Е) по количеству выделившейся воды рассчитать константу равновесия и реакции. Контрольные вопросыПричина положительных и отрицательных отклонений от законов Рауля. Первый и второй законы Коновалова. Пояснить эти законы на диаграммах состав – температура и состав – давление. Как должна выглядеть диаграмма бензол – вода в координатах состав – температура и состав – давление? Каким методом можно удалить воду из азеотропной смеси? Каким образом воздействуют на протекание реакции этерификации добавление к смеси бензола? Изменяются ли при этом её термодинамические характеристики? ЛитератураКиреев В.А., «Курс физической химии». Госхимиздат, М – Л, 1955г. Физическая химия. / П од ред. Краснова К .С. - М .: Высшая школа, 1999.- т.1.- 365 с. Физическая химия. Теоретическое и практическое руководство. /П од ред.Н икольского Б.Н .- Л .: Х имия, 1987.- 820 с. Практические работы по физической хим ии. /П од ред. М ищ енко К .П., Равделя А .А ., Пономаревой А .М .- Л .:Х им ия, 1982.-С.87-98. | ||||||||||||||||||||||||||
