Лекции по биохимии тверь,2012 1 модуль. Строение и свойства белков и ферментов Вводная лекция
 Скачать 0.64 Mb. Скачать 0.64 Mb.
|
|
ГБОУ ВПО Тверская ГМА МЗ ЗФ Кафедра химии и биохимии ЛЕКЦИИ ПО БИОХИМИИТВЕРЬ,2012 1 модуль. Строение и свойства белков и ферментовВводная лекция. Предмет и задачи биологической химии, ее значение для биологии и медицины. Важнейшие этапы в истории биохимии. Основные принципы биохимических исследований в медицине. Место биохимии среди других биологических дисциплин. Биохимия как молекулярный уровень изучения явлений жизни. Биохимия и медицина (значение клинической биохимии в диагностике и определении тактики лечения различных заболеваний). Аминокислоты и структуры белка. –аминокислоты — это органические кислоты, у которых один из атомов водорода у α-С-атома замещен на аминогруппу. Классификация протеиногенных аминокислот возможна: по строению радикала, по полярности радикала, по степени незаменимости аминокислот, по кислотно-основным свойствам. Для аминокислот характерны следующие физико-химические свойства: ионизация (диссоциация карбоксильных и протонирование аминогрупп), изоэлектрическое состояние, изоэлектрическая точка, амфотерность аминокислот и их буферные свойства. Белки – это высокомолекулярные азотсодержащие органические соединения, состоящие из аминокислот, соединенных пептидной связью в полипептидные цепи. Белки выполняют в организме многочисленные функции: ферментативную, гормональную, рецепторную, транспортную, структурную, иммунологическую и др. Белки имеют сложную форму структурной организации. Первичная структура белка – это линейная последовательность аминокислот, соединенных между собой в цепь пептидными связями. Вторичная структура белка - это способ укладки стержня пептидной цепи (первичной структуры) в упорядоченную –спираль или –структуру при помощи водородных связей. Альфа-спираль (-спираль) – вторичная структура, формируемая остовом полипептидной цепи. Она представляет собой правую спираль, у которой на один виток приходится 3,6 аминокислотных остатка. Спираль стабилизирована водородными связями между группами СО и NH различных мономерных звеньев, отстоящих друг от друга на расстояние 4 остатков аминокислот. Водородные связи направлены вдоль оси спирали. Бета-структура --слой или «складчатый лист» - один из регулярных элементов вторичной структуры белка: между несколькими вытянутыми (деспирализованными) полипептидными цепями возникают водородные связи (между группами СО одной цепи и NН другой). Третичная структура белка – способ укладки –спирали или –структуры в пространстве (глобулярные, фибриллярные белки). Третичную структуру стабилизируют ионные, водородные, ковалентные (дисульфидные) связи и гидрофобные взаимодействия. Четвертичная структура белка –это объединение нескольких полипептидных цепей с третичной структурой в единую функциональную молекулу белка. Классификация белков осуществляется: по структурным признакам (простые и сложные); по электрохимическим признакам (кислые, основные и нейтральные); по полярным признакам (полярные [гидрофильные], неполярные [гидрофобные], амфифильные); по форме молекул (глобулярные, фибриллярные); по функциям (транспортные, белки–ферменты, гормоны, антитела, структурные и т.д.). Характеристика (особенности аминокислотного состава, молекулярнуая масса, заряд, структура и функции) и основные представители простых белков (альбумины, глобулины, протамины, гистоны). Химический состав и структура сложных белков: белковая часть – апопротеин, небелковый компонент – простетическая группа. Принцип классификации (по названию простетической группы) и классы сложных белков. Методы изучения аминокислот и белков: выделение, очистка, качественный и количественный анализ, хроматография, электрофорез. Физико-химические свойства белков. Простые и сложные белки. Белки — высокомолекулярные соединения. Гидролиз белка состоит из двух этапов: разрыва гидролизуемой связи и присоединения по месту разрыва фрагментов воды (Н- и НО- групп). Пептидная связь является ковалентной и химически устойчивой, поэтому гидролиз белков проводят в жестких условиях. Различают кислотный, щелочной и ферментативный способы гидролиза белков. Кислотный или щелочной гидролиз проводят кипячением белка в растворе кислоты или щелочи в течение длительного времени. При ферментативном гидролизе раствор белка инкубируют с энзимом при температуре, не выше 40◦ С. В воде большинство белков образует истинные растворы. Однако, по причине высокой молекулярной массы и большого размера молекулы белка приобретают свойства коллоидных частиц, а растворы белка — свойства коллоидных растворов. Коллоидные растворы белка достаточно устойчивы. Это обусловлено: 1) наличием на белковой частице электрического заряда и 2) образованием вокруг белковой молекулы гидратной оболочки. Заряд на молекуле белка формируется при ионизации в воде карбокси- и аминогрупп: образуются ионы R-СОО - и NH3+ . Такие ионы на поверхности белковой частицы и полярные радикалы аминокислот (—ОН серина, —SH цистеина), притягивая диполи воды, способствуют образованию гидратной оболочки, обеспечивая, тем самым, растворимость. Факторы, влияющие па гидратную оболочку, заряд или структуру белковой молекулы, могут повысить или, наоборот, понизить растворимость молекул белка, изменить их физико-химические свойства и функциональную активность. Белки, как и их структурные элементы – аминокислоты, благодаря одновременному присутствию СООН – групп (кислотных) и NН2 – групп (основных), являются амфотерными электролитами. В кислой среде они проявляют основные свойства и несут положительный заряд (катионы). В щелочной среде они проявляют кислотные свойства и несут отрицательный заряд (анионы): 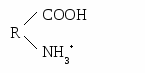 Н+ 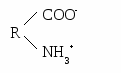  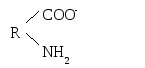  ОН- Однако, в зависимости от преобладания в молекуле дикарбоновых или диаминомонокарбоновых аминокислот, белки в водных растворах при рН=7 приобретают, соответственно, свойства либо слабых кислот или слабых оснований. Кислые белки (альбумины, глобулины) в водном растворе несут суммарный отрицательный заряд, основные белки (протамины, гистоны) – положительный заряд. Растворимость белка, как правило, увеличивается при добавлении к раствору солей щелочных и щелочноземельных металлов (хлоридов и сульфатов натрия, калия, кальция, магния, аммония и др.) в небольших концентрациях (> 5 %). Однако, при дальнейшем повышении в растворе концентрации этих же солей растворимость белков может резко понижаться, они выпадают в осадок. При разбавлении этих растворов водой белки снова растворяются, восстанавливая свои специфические (нативные) свойства. Вышеописанный метод выделения белков называют высаливанием. Поскольку разные белки высаливаются (осаждаются) при различной концентрации солей, этот метод широко используется для фракционирования и получения относительно гомогенных белковых препаратов (альбуминов, глобулинов, белков-ферментов и др.). Другой химизм имеет осаждение белков солями тяжелых металлов (ртути, серебра, меди, свинца, стронция и др.). Их токсическое действие основано на образовании с белками нерастворимых солей, что является причиной денатурации белков. Под влиянием различных физических и химических факторов (нагревания, действия ультразвука, ультрафиолетового и радиоактивного излучения, концентрированных кислот, щелочей, солей тяжелых металлов, органических соединений, алкалоидов и многих других) белки денатурируют. При этих воздействиях в молекуле белка происходит разрушение слабых связей (водородных, электростатических, гидрофобных), формирующих четвертичную, третичную и вторичную структуры. Полипептидная цепь разворачивается, и гидрофобные радикалы аминокислот понижают растворимость белка. При этом изменяются физико-химические и, главное, биологические (нативные) свойства белка. Процесс разделения высокомолекулярных и низкомолекулярных частиц с помощью полупроницаемых мембран называется диализом. Метод основан на неспособности коллоидных частиц проникать через полупроницаемые мембраны. Обладая большим диаметром, частицы белка не способны к проникновению через такие мембраны. В то же время низкомолекулярные примеси легко проходят через поры полупроницаемых мембран. На основе диализа создан аппарат «искусственная почка». С помощью диализа могут быть получены очищенные от солей растворы белков. Простые белки состоят только из аминокислот. Сложные белки классифицируют в зависимости от простетической группы. Основная роль простетической группы: стабилизация третичной структуры белка и участие в выполнении биологической функции. Фосфопротеины, наряду с апопротеином, содержат фосфорную кислоту. Присоединение или отщепление фосфорной кислоты изменяет активность ферментов (фосфорилаза и гликогенсинтаза). Второй тип фосфопротеинов – питательные белки (казеиноген). К металлопротеинам относят макромолекулы, у которых, помимо белка, имеются ионы одного или нескольких металлов. Например, белки, содержащие негеминовое железо (ферритин, трансферрин), ионы цинка (алкогольдегидрогеназа, карбоангидраза), меди (тирозиназа, цитохромоксидаза), натрий, калий, кальций, магний (АТФ-азы и многие др. ферменты). Ферменты. Строение и механизм действия Ферменты по химической природе являются: 1) простыми белками – состоят только из аминокислот; 2) сложными белками – (апофермент + кофактор)  металлы (Zn2+, Mg2+, Cu2+, K+, Na+, Fe2+, Fe3+ и др.) металлы (Zn2+, Mg2+, Cu2+, K+, Na+, Fe2+, Fe3+ и др.)к  офактор офакторкофермент: витаминный (производные витаминов) невитаминный (гем, УДФ-глюкоза, глутатион и др.) Активный центр фермента - участок в молекуле фермента, к которому присоединяется субстрат (акцепторный участок) и который обеспечивает превращение субстрата в продукты реакции (каталитический центр). Активный центр ферментов - простых белков состоит из функциональных групп аминокислот (12-16 радикалов). В активный центр сложных ферментов входит также небелковая часть. Формирование активного центра происходит в момент возникновения третичной и четвертичной структуры белка и присоединения кофактора, если фермент является сложным белком. Аллостерический центр фермента – другой участок в молекуле фермента, к которому могут присоединяться вещества-регуляторы (эффекторы), вследствие чего каталитическая активность фермента меняется. Аллостерические эффекторы (модификаторы, модуляторы) - вещества, изменяющие активность фермента. К ним относятся метаболиты, ионы металлов, коферменты, лекарственные препараты и др. Положительные аллостерические эффекторы активируют фермент, отрицательные - ингибируют. Изоферменты (изоэнзимы) – это группа ферментов, катализирующих одну химическую реакцию, но отличающихся по аминокислотному составу, сродству к субстрату, локализации в тканях. Биологическое значение наличия изоферментов: в определенных тканях различные условия для протекания реакций, например, в скелетных мышцах - анаэробные условия – активен ЛДГ5, в миокарде – аэробные условия – активен ЛДГ1. Таким образом, изоферменты выполняют своеобразную роль регуляторов метаболизма. Полиферментные системы по своей организации делятся на: 1. Функциональные - ферменты не связаны друг с другом, объединены по функции, молекулы субстратов и ферментов перемещаются путем диффузии (ферменты гликолиза, синтеза триглицеридов, холестерина). 2. Структурно-функциональные - ферменты связаны с определенными клеточными структурами и объединены по функции (ферменты дыхательной цепи). 3. Смешанные - (ферменты цикла трикарбоновых кислот), часть ферментов связаны структурно-функционально, а часть функционально. Механизм действия ферментов - современная теория механизма действия ферментов - это теория промежуточных соединений (Михаэлис, Ментен). E+S↔ES↔ES*↔EP↔E+P
Кинетика, классификация, ингибирование ферментов Кинетика ферментативных реакций
Вначале при увеличении концентрации субстрата скорость реакции быстро возрастает, далее прирост скорости замедляется, а затем прекращается (кривая Михаэлиса). Km - характеризует сродство фермента к субстрату. Чем Km меньше, тем выше сродство фермента к субстрату (на примере глюкокиназы и гексокиназы).
Зависимость прямо пропорциональная, то есть чем больше фермента в клетке, тем больше скорость ферментативной реакции.
При увеличении температуры до 40ºС скорость ферментативной реакции возрастает (на каждые 10ºС, в 1,5-2 раза). При дальнейшем повышении температуры скорость реакции резко падает, вследствие тепловой денатурации ферментов.
Каждый фермент проявляет максимальную активность при оптимальном для него значении pH среды. Оптимум pH для большинства ферментов лежит в нейтральной среде (исключения: для пепсина оптимум pH - 1,5-2, для щелочной фосфатазы - 9-10). Активирование ферментов может протекать различными путями, например, активность аллостерических ферментов повышается в присутствии положительного модификатора; проферменты активируются путем гидролиза (пепсиноген пепсин); некоторые ферменты активируются по принципу ковалентной модификации (фосфорилирование/дефосфорилирование). Ингибирование ферментов бывает: 1) необратимое – при связывании с ингибитором активность фермента не восстанавливается (например, действие диизопропилфторфосфата на ацетилхолинэстеразу). 2) обратимое – после отделения ингибитора от фермента его активность восстанавливается. Конкурентное ингибирование – разновидность обратимого. Конкурентный ингибитор похож по структуре на субстрат и способен связываться с активным центром фермента. Степень ингибирования зависит от соотношения концентраций субстрата и ингибитора. При повышении концентрации субстрата можно снять ингибирование. Примеры конкурентных ингибиторов: малонат Na для сукцинатдегидрогеназы; трасилол для трипсина; прозерин для ацетилхолинэстеразы. Ингибирование по типу обратной связи: продукты реакции ингибируют аллостерический фермент, который находится в начале биохимического процесса, например, холестерин ингибирует ГМГ-редуктазу. Специфичность действия ферментов определяется уникальным набором радикалов в активном центре и их расположением. Высокоспецифичные ферменты катализируют превращение только одного субстрата, например, аргиназа действует только на аргинин. Более широкий вид специфичности, когда фермент может действовать на несколько различных веществ, например, монооксигеназа в присутствии цитохрома Р450 окисляет множество различных гидрофобных веществ, ксенобиотиков. Ферменты классифицируют по типу химической реакции на 6 классов. I – оксидоредуктазы – катализируют окислительно-восстановительные реакции. II – трансферазы – обеспечивают перенос групп атомов. III – гидролазы – расщепляют внутримолекулярные связи с участием воды. IV – лиазы – катализируют разрыв С-О; С-С; С-N и др. связей без участия воды. V – изомеразы – катализируют реакции изомеризации, например превращение альдозы в кетозу. VI – лигазы (синтетазы) – катализируют реакции синтеза молекул с участием АТФ. Номенклатура ферментов – название ферментов. Рабочее наименование фермента составляется из названия субстрата + тип реакции + окончание «аза», например, лактатдегидрогеназа. Систематическое название фермента складывается из названия субстратов + тип реакций + окончание «аза», например, L-лактат:НАД-оксидоредуктаза = ЛДГ5. Методы определения активности ферментов: Активность фермента определяется в стандартных (оптимальных) условиях по: - убыли концентрации исходных субстратов или - приросту продуктов реакции. Единицы активности ферментов: 1Е = 1 мкмоль/мин, то есть это такое количество фермента, которое превращает 1 мкмоль субстрата за 1 минуту при оптимальных условиях. 1 катал = 1 моль/сек. Удельная активность фермента = мкмоль/(мин мг белка). Медицинская энзимология Энзимопатология – раздел медицины, изучающий заболевания, связанные с нарушением функционирования ферментов. Различают энзимопатии: 1) первичные (наследственные), например, фенилкетонурия, галактоземия, гликогенозы и др. 2) вторичные (приобретенные), например, снижение активности пепсина при нарушении выработки соляной кислоты в желудке и др. Энзимодиагностика – определение активности органоспецифичных ферментов в биологических жидкостях (крови, моче и др.) с целью постановки диагноза заболевания, а также использование ферментных препаратов в качестве реактивов при проведении биохимических анализов. Например, при инфаркте миокарда в сыворотке крови увеличивается активность ЛДГ1, АСТ (аспартатаминотрансфераза), КФК (креатинфосфокиназа, МВ-форма). При поражении поджелудочной железы – амилаза. При заболевании печении – АЛТ (аланинаминотрансфераза). Энзимотерапия – использование в лечебных целях ферментов и лекарственных средств, влияющих на активность ферментов. Например, пепсин, трипсин применяют для лечения заболеваний желудочно-кишечного тракта; коллагеназу, гиалуронидазу - для обработки ран с интенсивным воспалением с целью предотвращения келоидных рубцов. |
