Лекции по биохимии тверь,2012 1 модуль. Строение и свойства белков и ферментов Вводная лекция
 Скачать 0.64 Mb. Скачать 0.64 Mb.
|
|
6) тормозит активность ферментов глюконеогенеза Эти эффекты действия инсулина понижают содержание глюкозы в крови. При недостатке инсулина (гипоинсулинемии) вышеописанные метаболические процессы приобретают противоположное направление, и тогда развивается гипергликемия – главный симптом сахарного диабета. Влияние инсулина на обмен липидов. Инсулин: 1) стимулирует синтез ВЖК в печени, путем повышения скорости гликолиза, ЦТК, ПФП, повышения содержания интермедиатов, используемых на пути биосинтеза ВЖК (НАДФН2, а-ГФ, малонил-КоА и др.); 2) повышает скорость этерификации жирных кислот; 3) стимулирует синтез ЛПОНП; 4) активирует на поверхности клеток эндотелия и жировой ткани липопротеинлипазу и облегчает этим поглощение тканями триглицеридов из плазмы крови; 5) ингибирует в липоцитах жировой ткани активность триглицеридлипазы и этим ограничивает гидролиз триглицеридов и выход продуктов их распада в кровяное русло. Влияние инсулина на обмен аминокислот, белков и нуклеиновых кислот. Инсулин увеличивает белковые запасы организма путем: 1) увеличения поглощения тканями аминокислот; 2) стимуляции синтеза белков за счет увеличения скорости образования в клетке ДНК и РНК; 3) ингибирования катаболизма белков; 4) снижения скорости окисления аминокислот. Влияние инсулина на обмен электролитов и воды. Инсулин понижает в сыворотке крови содержание калия. В связи с этим, при лечении сахарного диабета инсулин принято вводить совместно с калием. Инсулин повышает реабсорбцию натрия и затем воды из первичной мочой. Это действие инсулина лежит в основе отеков, которые появляются у больных диабетом после инсулинотерапии. Инактивация инсулина. Выполнив функции, инсулин разрушается под влиянием глутатионинсулин-трансдегидрогеназы и инсулиназы, которые разрушают дисульфидные мостики и гидролизуют полипептидную цепь инсулина. Классификация сахарного диабета включает в себя 5 его разновидностей: Первичный: 1. Тип – I (инсулинзависимый, ИЗСД, ювенильный) СД. 2. Тип - I I (инсулиннезависимый, ИНСД, диабет взрослых). Вторичный: 3. Наблюдается при панкреатите и других заболеваниях поджелудочной железы, после операции на этом органе, при гиперсекреции контринсулярных гормонов, повреждающего действия лекарств, этилового спирта и др. ксенобиотиков на функцию поджелудочную железу. 4. Нарушение толерантности к глюкозе (ранее называли бессимптомным, латентным, скрытым, субклиническим диабетом). Натощак у таких больных уровень глюкозы в пределах нормы, но через 2 часа после сахарной нагрузки повышается до 140-200 мг% (до 7-11 мМ/л). 5. Диабет беременных (возникает при беременности, после беременности симптомы заболевания могут исчезнуть, но далеко не всегда). Глюкагон – это полипептид, местом биосинтеза которого являются α-клетки островков Лангерганса. Стимулом секреции глюкагона является белковая пища и физическая нагрузка, а также низкий уровень глюкозы в крови. У здоровых лиц обычно наблюдается бигормональная реакция клеток поджелудочной железы на количество глюкозы в крови, т.е. происходит повышение одновременно уровня, как глюкагона, так и инсулина, что обеспечивает сохранение концентрации и использования глюкозы на стабильном уровне. Глюкагон – контринсулярный гормон, т.е. он, вызывает увеличение концентрации глюкозы в крови. Органами-мишенями для глюкагона являются печень, миокард, жировая ткань, но не скелетные мышцы. Гипергликемический эффект обеспечивается стимуляцией одновременно гликогенолиза и глюконеогенеза, Глюкагон принимает участие в регуляции скорости кетогенеза. Он стимулирует, в отличие от инсулина, кетогенез, т.е. синтез кетоновых тел. Выполнив функции, глюкагон разрушается (гидролизуется до аминокислот), в основном, в почках. Гормоны щитовидной железы. Щитовидная железа вырабатывает 2 основных йодсодержащих гормона Т3 – трийодтиронин и Т4 – тетрайодтиронин (тироксин), а также в особых С-клетках – кальцитонин. Биосинтез тиреоидных гормонов.В фолликулах щитовидной железы продуцируется белок йодтиреоглобулин. Около 70% йода в этом белке находится в составе моно- и дийодтирозинов (МИТ и ДИТ) и 30% присутствует в составе Т3 и Т4 коллоидного содержимого фолликула. После стимуляции клеток ЩЖ тиреотропным гормоном усиливается протеолиз йодтиреоглобулина на аминокислоты, включая МИТ и ДИТ. Конденсация 2-х молекул ДИТ или МИТ + ДИТ приводит к образованию Т3 и Т4. Транспорт и метаболизм гормонов ЩЖ. Большая часть Т3 и Т4 в крови связанна с белками: 1) тироксин-связывающим глобулином (ТСГ) и 2) тироксин-связывающим проальбумином (ТСПА). Метаболически наиболее активной формой гормона является Т3. Однако, время полужизни Т4 в 4-5 раз больше, чем у Т3. Выполнивфункцию,Т3 и Т4 инактивируются путем дейодирования, дезаминирования и декарбоксилирования и соединения с глюкуроновой или серной кислотам. Механизм действия тиреоидных гормонов. Т3 и Т4 –липофильные гормоны. Они проникают в цитоплазму, связываются с специфическими для них рецепторами и стимулируют экспрессию генов, повышают скорость транскрипции и синтеза белков-энзимов. Главная метаболическая функция гормонов ЩЖ состоит в повышении поглощения кислорода, т.е. в усилении основного обмена. Эффект наблюдается во всех органах, кроме мозга, ретикуло-эндотелиальной системы и гонад. Гормоны ЩЖ повышают эффективность Na\K-АТФ-азного насоса. Доказано, гормоны ЩЖ необходимы также для нормального умственного развития человека. Гипотиреоз у плодов или новорожденных приводит к кретинизму, который характеризуется множественными врожденными нарушениями и тяжелой необратимой задержкой умственного развития. Патология функции ЩЖ. Причинами нарушений могут быть недостаток йода в пище, недостаточность ауторегуляторных механизмов и другие дефекты биосинтеза гормона: а) нарушение йодирования тирозина и тиронина; б) нарушение конденсирования; в) высокая активность дейодиназы; г) недостаточность ТСГ; д) образование аномальных йодированных белков; е) нарушение транспорта гормона. Недостаточность любых перечисленных выше функций может вызвать снижение содержания Т3 и Т4 - простой зоб у взрослых людей. Простой зоб лечат экзогенными тиреоидными гормонами Гипотиреоз. Наблюдается при дефиците Т3 и Т4. Обычно это связано с недостаточной функцией ЩЖ, но может также быть результатом заболевания гипофиза или гипоталамуса. При гипотиреозе снижается основной обмен, а также скорость других вышеперечисленных процессов, зависящих от тиреоидных гормонов. У взрослых гипотитеоз характеризуется: а) низкой частотой сердечных сокращений; б) диастолической гипертензией; в) вялостью, сонливостью; г) запорами; д) чувствительностью к холоду; е) сухостью кожи и волос; ж) бледностью. У детей при дефиците Т3 и Т4 развивается кретинизм (выраженное умственное отставание в развитии). У детей старшего возраста при кретинизме наблюдается отставание в росте без задержки умственного развития. Различные формы гипотиреоза лечат заместительным введением тиреоидных гормонов. Гипертиреоз или тиреотоксикоз, обусловлен избыточным образованием тиреоидных гормонов Т3 и Т4. Существует множество причин и форм этой патологии. Болезнь Грейвса является результатом образования тиреоидстимулирующего иммуноглобулина (Ig G), активирующего рецептор тиреотропина. Это приводит к диффузному разрастанию ЩЖ и избыточной неконтролируемой продукции Т3 и Т4. Патология проявляется: а) учащением сердцебиения; б) увеличением пульсового давления; в) нервозностью; г) бессонницей; д) похуданием; е) слабостью, потливостью; ж) повышенной чувствительностью к теплу; з) гиперемией и влажностью кожи. Паратиреоидный гормон (ПТГ). Это одноцепочечный пептид. Биологический эффект действия гормона: 1) повышает скорость деминерализации кости - вымывание как органических, так и неорганических компонентов, что обеспечивает переход кальция во внеклеточную жидкость; 2) снижает почечный клиренс, т.е. экскрецию Са с мочой, стимулирует его ресорбцию и, тем самым, повышает концентрацию этого катиона во ВЖ и тормозит реабсорбцию фосфата. 3) посредством стимуляции образования кальцитриола увеличивает эффективность всасывания Са из кишечника. Суммарный эффект действия ПТГ на кость – деструкция кости, которая сопровождается высвобождением Са, Р, а также элементов органического матрикса, в том числе продуктов распада коллагена. Патология функции ПТГ. Недостаток ПТГ называют гипопаратиреозом. В сыворотке крови понижается содержание Са ионизированного и повышается уровень фосфата. Это повышает нейромышечную возбудимость. Тяжелая, острая гипокальциемия ведет к тетаническому параличу дыхательных мышц, ларингоспазм, сильным судорогам и смерти Псевдогипопаратиреоз наблюдается, когда железой продуцируется биологически активный гормон в достаточном количестве, но органы-мишени к нему резистентны. В результате возникают те же биохимические и клинические сдвиги, что и при гипопаратиреозе. У молодых пациентов задерживаются рост и умственное развитие. Гиперпаратиреоз возникает вследствие аденомы паратиреоидных желез, но может быть также следствием гиперплазии их клеток, либо эктопической продукции ПТГ злокачественной опухолью. Биохимические проявления гиперпаратиреоза – повышение уровня ионизированного кальция и снижение фосфата в сыворотке крови. В запущенных случаях гиперпаратиреоза можно наблюдать выраженную резорбцию костей скелета и различные повреждения почек (камни), частое инфицирование мочевых путей и снижение функции почек. Вторичный гиперпаратиреоз можно наблюдать у больных с почечной недостаточностью. Полагают, что развитие патологии обусловлено снижением синтеза 1,25 (ОН)2-D3 (кальцитриола) в измененной паренхиме почек, и, как следствие, нарушением всасывания кальция в кишечнике. Это вызывает компенсаторную реакцию организма – усиление образования и секрецию в кровь ПТГ для поддержания нормального уровня Са во внеклеточной жидкости. Кальцитонин (КТ). Это пептид (32 аминокислоты), бразуется и секретируется он С-клетками щитовидной железы. Регуляция секреции.Уровни секреции КТ и ПТГ связаны обратной зависимостью и регулируются содержанием ионизированного кальция и Mg2+ во внеклеточной жидкости. Секреция КТ возрастает пропорционально увеличению концентрации кальция в крови. Механизм действия. До сих пор не изучен. В тест-системах первичной мишенью КТ служит кость, где этот гормон тормозит резорбцию матрикса и тем самым снижает высвобождение Са и фосфата. Более того, он способствует входу фосфата в клетки кости и периостальную жидкость, снижая этим выход кальция из костей в плазму крови. Вход фосфата стимулирует вход кальция. Такое действие КТ, наряду с его способностью тормозить опосредованную остеобластами резорбцию костей, позволяет объяснить эффективность применения данного гормона при гиперкальциемии у больных раком, локализованным в костной ткани. Клиническое проявление недостаточности КТ не выявлено. Избыточность КТ наблюдается при тиреокарциноме. Уровень КТ у таких больных может в 1000 раз превышать норму, однако это не сопровождается гипокальциемией. Кальцитриол. Кальцитриол – во всех отношениях гормон. Он образуется в сложной последовательности химических реакций, протекающих к тому же в разных тканях. Пища содержит небольшие количества витамина D. Большая часть его образуется в эпидермисе кожи из 7-дегидрохолестерина в ходе неферментативной, зависимой от УФ света реакции. Активность процесса находится в прямой зависимости от интенсивности УФ облучения и в обратной - от степени пигментации кожи. С возрастом содержание7-дегидрохолестерина в эпидермисе снижается. Специфический белок связывает витамин D и переносит его от кожи или кишечника в печень, где он подвергается 25-гидроксилированию. Продукт реакции поступает в плазму крови, при участии особого белка переносится в почки, где он гидроксилируется уже в С-1 положении. 1,25(ОН)2-D3 – самый активный из природных метаболитов витамина D, который стали называть гормоном кальцитриолом. Регуляция метаболизма и синтеза КТ. Подобно другим гормонам, кальцитриол является объектом точно сбалансированной (жесткой) регуляции его биосинтеза по механизму обратной связи. У интактных животных низкое содержание Са в пище и гипокальциемия вызывают усиление биосинтеза кальцитриола. В механизме этого эффекта участвует ПТГ, который стимулирует образование кальцитриола в почках. Механизм действия кальцитриола. Кальцитриол функционирует подобно другим липофильным стероидным гормонам. На поверхности клеток-мишеней (кишечных ворсинок) кальцитриол соединяется со специальным рецептором. Далее комплекс проникает в клетку и, соединяясь в ядре с хроматином, стимулирует транскрипцию генов и образование м-РНК и биосинтез кальцийсвязывающих белков (КСБ), которые стимулируют всасывание Са и фосфора из содержимого кишечника. При дефиците витамина Д замедляется формирование новых костей и нарушается обновление костной ткани. В регуляции этих процессов участвует также ПТГ, воздействующий непосредственно на костные клетки, а также на образование кальцитриола. Патология функции кальцитриола. Чаще всего рахит является следствием недостатка витамина D. Различают также 2 типа наследственного рахита. Тип-I обусловлен нарушением превращения 25-ОН-D3 в кальцитриол – в почках. Тип-II является следствием отсутствия рецепторов для кальцитриола. У взрослых недостаток витамина D вызывает остеомаляцию. Это является результатом снижения всасывания Са и Р в кишечнике и уменьшения уровня этих ионов во внеклеточной жидкости. Вследствие этого нарушаются минерализация остеоида и формирование кости, что обуславливает формирование их структурной слабости. Остеомаляция может наблюдаться также, когда значительно повреждена патологическим процессом или утрачена функция паренхимы почек.Образование кальцитриола в почках снижается и, соответственно, уменьшается всасывание Са из кишечника.Формирующаяся гипокальциемия вызывает компенсаторное увеличение секреции ПТГ, который усиливает резорбцию костной ткани, чтобы повысить содержание Са во внеклеточной жидкости и усугубляет этим патологический процесс - остеопороз. . Простагландины. Арахидоновая кислота является основным предшественником простагландинов, только после того, как под действием фосфолипазы А2 отщепляется от фосфолипидов мембран необратимо поврежденных клеток. Эта самая медленная реакция пути биосинтеза ПГ, поэтому она является скорость лимитирующей реакцией. Кортикостероиды ингибируют этот фермент, поэтому они обладают противовоспалительным действием. Аспирин и индометацин также обладают противовоспалительным действием, т.к. ингибируют простагландинсинтетазу и снижают концентрацию простагландинов в очаге воспаления. Типы простагландинов отличаются друг от друга типом и числом О-заместителей, а также расположением двойной связи в их пятичленном кольце. Циклооксигеназный путь приводит к образованию простагландинов, тромбоксанов и простациклинов. Липооксигеназный путь к трансформации арахидоновой кислоты приводит к образованию лейкотриены. Роль простагландинов: 1) Образуются они в каждой клетке в ответ на любое раздражение; 2) Стимулируют, либо ингибируют (в зависимости от ткани и типа простагландинов) синтез ц-АМФ; 3) Являются медиаторами воспаления: увеличивают содержание гистамина, повышают проницаемость сосудистой стенки, кожи и слизистых оболочек; 4) Повышают артериальное давление; 5) Усиливают секрецию желудочного сока; 6) Являются медиаторами аллергических реакций; 7) Обеспечивают расслабление гладких мышц бронхов, матки (родостимулирующее действие); 8) Обладают пирогенным действием; 9) Контролируют свёртывающую и антисвёртывающую системы крови (тромбоксаны и простациклины). Кинины. Кининами, или кининовыми гормонами, были названы вещества полипептидной природы, обладающие высокой биологической активностью. Они не производятся специализированными клетками, а возникают из неактивных предшественников, находящихся в плазме крови или в тканях. Основными кининами являются брадикинин и лизилбрадикини (каллидин). Брадикинин образуется из кининогена, который присутствует в α2-глобулиновой фракции сыворотки крови. Под влиянием калликреинов (энзим), катализирующих расщепление кининогена образуются брадикинин и каллидин. Каллекриин образуется путем частичного протеолиза из прекалликреина. Это происходит под действием фактора Хагемана, который в свою очередь, образуется из неактивного предшественника при контакте с межклеточным веществом (коллагеном), базальной мембраной сосудов или эндотоксинами. Период полураспада брадикинина в большом круге кровообращения равен 17-24 сек. Это обусловлено наличием в крови высокоактивных кининаз, осуществляющих физиологический контроль уровня кининов. Они гидролизуют отдельные пептидные связи в молекуле брадикинина и тем самым переводят его в неактивные продукты. Кинины осуществляют контроль за проницаемостью клеточных мембран и реакциями воспаления. Биохимия крови. Физико-химические и биологические свойства крови. Кровьсостоит изплазмы (55%) и форменных элементов (45% - эритроциты, лейкоциты, тромбоциты). Функции крови чрезвычайно важны и многообразны: - дыхательная – переносит О2 из легких в ткани в составе гемоглобина эритроцитов и СО2 из тканей в легкие; - трофическая – доставляет продукты переваривания пищи из кишечника в ткани; - выделительная – уносит конечные продукты обмена из тканей в экскреторные органы; - регуляторная – доставляет сигнальные молекулы – гормоны, биологически активные вещества к органам-мишеням; - защитная – содержатся клеточные – (лейкоциты) и гуморальные – (антитела) элементы иммунной системы, защищающие организм от чужеродных ему молекул и микроорганизмов; - гемостатическая – при нарушении целостности кровеносного сосуда из белков крови образуется тромб, который останавливает кровотечение; - поддерживает кислотно-основной и водный баланс (буферные системы обеспечивают сохранение рН в крови в пределах 7,37-7,43); - терморегуляторная – обеспечивает постоянство температуры тела. Большинство белков, присутствующих в плазме крови синтезируются в печени, некоторые в других органах или клетках крови (γ-глобулины в В-лимфоцитах). Все они, за исключением альбуминов, являются гликопротеинами. Основные белки сыворотки крови: Альбумины участвуют в поддержании онкотического давления крови, поддерживают pH крови, осуществляют транспорт различных веществ (жирные кислоты, билирубин, стероидные и лекарственные вещества и др.). Глобулины при электрофорезе разделяются на α1, α2, β и γ-глобулиновые фракции. В транспорте различных веществ участвуют следующие белки-глобулины: гаптоглобин, трансферин, церулоплазмин, α- и β-липопротеиды. В формировании иммунитета принимают участие: иммуноглобулины (IgA, IgD, IgE, IgM, IgG). Фибриноген - белок плазмы крови, участвующий в свертывании крови (является I фактором свертывания крови). Электрофореграмма белков плазмы крови 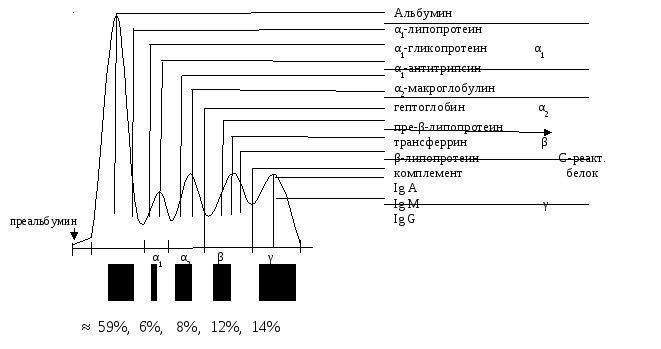 При патологии содержание белков в плазме крови может существенно изменяться. Возможны различные варианты патологических состояний: гипер-, гипо-, пара-, и диспротеинемии. Гиперпротеинемия (увеличение содержания белков). Основными причинами этого состояния организма могут стать:
Гипопротеинемия (снижение содержания белков, чаще всего альбуминов). Основными причинами этого состояния организма могут быть:
При ревматизме, туберкулезе, пневмонии и многих других заболеваниях общее содержание белков в плазме крови может находиться в пределах физиологической величины, но при этом изменяется соотношение отдельных белковых фракций (диспротеинемия). Диагностика заболеваний на основе анализа белков плазмы крови относительно сложна. Рекомендуется результаты полученных исследований сопоставлять со «стандартами» электропротеинограм, характерными для определенных заболеваний. Парапротеинемия сопровождается появлением в крови нехарактерных для нормального состояния белков (парапротеинов): С-реактивный белок «появляется» в крови в остром периоде заболеваний, сопровождающихся воспалением и некрозом тканей; криоглобулины обнаруживаются при миеломной болезни, лейкозах, нефрозах, циррозе печени; макроглобулины появляются при липоидном нефрозе, циррозе печени, коллагенозах и другой патологии. Ферменты плазмы крови. Для диагностики различных заболеваний используют секреторные энзимы для установления причины коагулопатии, экскреторные и клеточные органно-специфичные энзимы для установления заболеваний соответствующих органов (ЛДГ, КК, ЩФ, ГОТ, ГПТ и др.). Остаточный азот крови в норме составляет 15-25 ммоль/л. В состав остаточного азота крови входят азот мочевины (до 50%), аминокислот (до 25%), мочевой кислоты (4%), креатинина (2,5%), креатина (5%), билирубина, солей аммония и др. Безазотистые органические компоненты крови- липиды (триглицериды, холестерин, фосфолипиды), углеводы (глюкоза и др. моносахариды), кетоновые тела (ацетоацетат, -гидроксибутират). Кислотно-щелочное равновесие (КЩР) поддерживается: 1) за счет различных буферных систем; 2) с помощью физиологических механизмов выделения из организма продуктов метаболизма. Буферные системы плазмы крови: 1) карбонат-бикарбонатный буфер. Компоненты: H2CO3 и NaHCO3 в соотношении 1:20. Нейтрализует 40% всех свободных H+ в организме. Емкость составляет 10% от всей буферной емкости крови. 2) фосфатный буфер. Компоненты: NaH2PO4 и Na2HPO4 в соотношении 1:4. Емкость составляет 1% от всей буферной емкости крови. 3) гемоглобиновый буфер. Компоненты: KHb и KHbO2. Емкость составляет до 75% от всей буферной емкости крови. Действие гемоглобиновой буферной системы направлено на нейтрализацию H2CO3, возникающей из поступающего из тканей CO2. Нейтрализация протонов за счет удаления CO2 с помощью легких: HHb + O2 → H+ + HbO2 H+ + HCO3- → H2CO3 → H2O + CO2↑ Нейтрализация протонов с помощью почек: H+ + Na2HPO4 → NaH2PO4 ↓ H++NH3 → NH4+ + Cl- → NH4Cl ↓ В зависимости от механизма формирования патологии КЩР различают ацидоз или алкалоз. Ацидоз (рН < 7,37) – снижение рН крови. Газовый (дыхательный) ацидоз возникает как следствие гиповентиляции легких (при бронхите, бронхиальной астме, эмфиземе легких, пневмонии, асфиксии т.е. заболеваниях легких, а также патологии ЦНС, отравлении лекарствами и др. ситуациях, связанных с ограничением дыхания). Это приводит к гиперкапнии (↑ рСО2 > 40 мм Hg) и снижению рН крови. Компенсаторно избыток СО2 превращается в бикарбонат-анион (↑ НСО3- > 24 мэкв/л). Метаболический (нереспираторный) ацидоз – наиболее частое нарушение КЩР. Возникает как следствие повышения в крови содержания органических кислот в связи с увеличением скорости их образования или снижения экскреции почками (кетоацидоз - при декомпенсации сахарного диабета, голодании, алкогольном опьянении; лактоацидоз -при гипоксии, ишемии, отравлении и др. патологии). Снижение уровня бикарбонат-аниона (НСО3- < 20 мэкв/л) сопровождается компенсаторным снижением в крови рСО2 < 35 мм Hg. Алкалоз (рН > 7,44) – повышение рН крови. Газовый (дыхательный) алкалоз – является результатом повышения альвеолярной вентиляции (при стрессе, септическом шоке, отравлении салицилатами, травмах мозга, искусственной вентиляции легких, в барокамере и др.). Развивается гипокапния (рСО2 < 30 мм Hg), что компенсаторно сопровождается снижением содержания бикарбонат-аниона (НСО3- < 20 мэкв/л). Метаболический алкалоз – наиболее распространенная форма нарушения КЩР у больных, поступивших в отделение интенсивной терапии, вероятно, из-за необоснованного применения диуретиков (при рН > 7,55 летальность может достигать 40%). В основе этой патологии лежат либо потеря протонов (с HCl при обильной и частой рвоте), либо введение в организм с терапевтической целью бикарбонатов, диуретиков. Метаболический алкалоз характеризуется увеличением в крови содержания бикарбонат-анионов (НСО3- > 30 мэкв/л) и компенсаторным повышением (рСО2 > 50 мм Hg). Диагностика типа нарушения КЩР устанавливается путем определения в крови изменения основных показателей кислотно-щелочного равновесия: pH, парциального давления кислорода (рО2), парциального давления углекислого газа (рСО2), бикарбонатов (НСО3-). Транспорт газов кровью. - Транспорт кислорода осуществляет основной белок эритроцитов гемоглобин. В норме содержание гемоглобина в крови составляет 120-140 г/л у женщин и 130-160 г/л у мужчин. Уменьшение содержания гемоглобина в крови бывает при кровопотере, дефиците железа, витаминов B9, B12, усиленном гемолизе эритроцитов. Увеличение содержания гемоглобина в крови – при увеличении числа эритроцитов, легочно-сердечной недостаточности, при некоторых пороках сердца, при сгущении крови и др. - Транспорт углекислого газа кровью. 1) в физически растворенном виде (6-7% СО2 в покое); 2) в связанной с гемоглобином форме – карбгемоглобин (3-10% СО2); 3) в форме бикарбоната при участии гемоглобина эритроцитов. Гипоксия (кислородное голодание) - состояние, возникающее при недостаточном снабжении тканей организма кислородом или нарушении его утилизации в процессе биологического окисления. Виды гипоксий: 1) при понижении PO2 во вдыхаемом воздухе (экзогенная). Возникает при подъеме на высоту, при нарушении поступления кислорода, при авариях в шахтах, неисправности наркозной аппаратуры и др. 2) при патологических процессах, нарушающих снабжение тканей кислородом при нормальном содержании его в окружающей среде. Различают: 1) дыхательный (легочный тип), например, при нарушении проходимости дыхательных путей, отеке легкого, пневмонии и т. д.; 2) сердечно-сосудистый (циркуляторный тип) - при нарушении кровообращения, приводящего к недостаточному кровоснабжению органов и тканей; 3) кровяной (гемический тип), возникает при уменьшении эритроцитов или содержания гемоглобина в эритроцитах; 4) тканевой (гистотоксический тип) - нарушена способность тканей поглощать кислород, например, при отравлении цианидами, которые блокируют конечный фермент дыхательной цепи цитохромоксидазу. Система гемостаза обеспечивает: - образование тромба при повреждении кровеносного сосуда с целью остановки кровотечения; - растворение тромба и восстановление кровотока в кровеносном сосуде. Гемостатический процесс (процесс свертывания крови) может быть подразделен на пять стадий: - повреждение и локальная вазоконстрикция кровеносного сосуда; - формирование тромбоцитарного (белого) тромба; - стабилизация тромба фибрином; - ретракция тромба; - лизис тромба и восстановление поврежденной стенки сосуда. Обеспечивается этот процесс взаимодействием многочисленных белков плазмы (факторов свертывания крови) и клеток крови с поврежденным эндотелием или субэндотелиальными структурами кровеносного сосуда. Тромбоциты, прикрепляясь к месту повреждения образуют непрочную тромбоцитарную пробку (белый тромб). В состав этого тромба включается растворимый белок плазмы крови (фибриноген), который превращается в нерастворимый белок фибрин. В результате формируется прочный фибриновый тромб. Он содержит эритроциты и поэтому его называют красным тромбом. Существует 2 пути свертывания крови: - прокоагулянтный (внешний) начинает действовать при повреждении структуры тканей и тромбоцитов; - контактный (внутренний) запускается при повреждении эндотелия сосудов. Кровь здорового человека свертывается in vitro за 5-10 минут. Быстрая и высокоэффективная остановка кровотечения достигается каскадом ферментативных реакций с элементами их усиления на многих этапах. Активация факторов свертывания происходит частичным их протеолизом. В результате белки свертывания крови приобретают каталитическую активность – становятся ферментами (сериновыми протеазами), способными катализировать реакции и в целом процессе свертывания крови приобретает лавинообразный характер, что приводит к быстрому образованию тромба и остановке кровотечения. Роль витамина К в свертывании крови. Факторы свертывания крови (II, VII, IX, X) содержат в своем составе остатки γ-карбоксиглутаминовой кислоты, которые, посредством ионов Са++, обеспечивают связь этих ферментов с фосфолипидами клеточных мембран. В отсутствии ионов Са++ кровь не свертывается. γ-карбоксилирование глутаминовой кислоты катализируется карбоксилазой, коферментом которой является витамин К. В связи с этим при недостатке витамина К нарушается γ-карбоксилирование выше названных факторов свертывания, что сопровождается кровоточивостью, подкожными и внутренними кровоизлияниями. Противосвертывающая система крови включает различные ингибиторы свертывания крови, чаще белковой природы, способствуют сохранению крови в жидком состоянии. К ним относятся: антитромбин III, α2-анитплазмин, α1-антитрипсин, α1-антихимотрипсин, С1-инактиватор, α2-макроглобулин и др. Искусственные антикоагулянты: дикумарин, неодикумарин, варфарин и другие лекарственные препараты являются антивитаминами К, которые назначают для снижения активности свертывающей системы крови. Механизм их действия: образование комплекса фактор свертывания крови + ингибитор, далее комплекс выводится из кровотока, гидролизуется и свертывание прекращается. Фибринолитическая система – система протеаз, способных гидролизовать образованный тромб. Тромб образуется за несколько минут, а растворяется в течение нескольких дней. Таким образом, процесс свертывания крови, противоствертывающая система и система фибринолиза представлены большим набором белков - предшественников. Активация этих белков осуществляется в каскаде ферментативных реакций – путем их протеолиза, что обеспечивает быстрое свертывание крови. Водно-минеральный обмен Для нормальной жизнедеятельности организма, наряду с белками, жирами, углеводами, витаминами, необходимо поступление воды и минеральных веществ, которые являются также незаменимыми факторами питания. Вода и растворенные в ней вещества, в том числе минеральные, создают внутреннюю среду организма, кроме того, минеральные вещества входят в состав тканевых структур и придают им характерные свойства. Биохимическая значимость воды определяется ее химическими и физическими свойствами, обусловленными строением воды. Вода:
Суточная потребность в воде – 1500 мл, таковы же и потери с потом, калом, мочой, выдыхаемым воздухом. Потребность обеспечивается поступлением из вне (питьевая и пищевая вода) и за счет тканевого дыхания (до 300 мл – метаболическая вода). Содержание воды зависит от возраста, степени упитанности, функционального состояния организма. Различные ткани и органы отличаются по содержанию воды. Печень, мозг, кожа содержат 70% воды, мышцы, сердце – 76-80%, кости и жировая ткань содержат наименьший процент воды. Регуляция водного обмена осуществляется антидиуретическим гормоном (АДГ, вазопрессин) и реннин-ангиотензиновой системой (РАС). Нарушение водного обмена приводит к серьезной патологии (гипергидратации или дегидратации тканей). Всем без исключения организмам абсолютно необходимы С, Н, N, О, Р и S. Более 96 % органической массы приходится на долю четырех элементов - водорода, кислорода, углерода и азота и почти 4% - на долю семи так называемых макроэлементов: кальция, фосфора, натрия, серы, калия, хлора и магния. Среди важнейших микроэлементов выделяют железо, кобальт, медь, цинк, хром, молибден, марганец, фтор, йод и селен. Минеральные вещества поступают в организм с пищевыми продуктами и водой. Дополнительно человек употребляет только поваренную соль. Большинство солей легко всасываются в кишечнике и поступают в кровь, тканевые жидкости и ткани. Некоторые ионы задерживаются определенными тканями, являющимися их депо. Например, NaCl – в коже, Fe, Cu, Co, Mn – в печени, I – в щитовидной железе, K в мышцах, Ca, P, Mg, F – в костной ткани. В крови минеральные вещества находятся либо в связанном с белками состоянии – транспортная неактивная форма, либо в ионизированном состоянии – активная форма, а также в виде солей, например, в костной ткани. Минеральные вещества имеют большое значение для функционирования организма. Они используются как пластический материал в образовании костной ткани, построении клеточных мембран, влияют на проницаемость клеточных мембран и сосудов, определяют многие химические и физические свойства биологических жидкостей (осмотическое давление, буферные свойства и др.), участвуют в нервно-мышечном возбуждении, входят в состав биологически активных веществ. Суточная потребность в минеральных веществах незначительна и близка к потребности в витаминах. В организме человека около 65 минеральных элементов. Макроэлементы (кислород, углерод, водород, азот, кальций, фосфор, натрий, калий, магний, сера, магний, железо) содержаться в сравнительно больших количествах в организме (в концентрации от 0.001% до 70%). Натрий – основной катион внеклеточного отдела, играет главную роль в поддержании осмотического давления и сохранения кислотно-щелочного состояния, которое определяется тем, что натрий входит в состав буферных систем, в частности обеспечивает щелочной резерв крови – концентрацию бикарбоната плазмы. Натрий участвует в возникновении и поддержании электрохимического потенциала, влияет на процессы нервной деятельности, на состояние мышечной и сердечно-сосудистой системы, на способность внутритканевых коллоидов к набуханию, активирует ряд ферментов (амилазу, транспортную АТФазу).У здорового человека содержание натрия в плазме колеблется от 135 до 150 ммоль/л. Главная роль в поддержании гомеостаза натрия в плазме крови принадлежит почкам. Гормон, задерживающий натрий в организме – альдостерон. Он усиливает реабсорбцию натрия в почечных канальцах. Гипонатриемия наступает вследствие недостаточного поступления натрия в организма (бессолевая диета), при обильном пототделении, тяжелых длительных рвотах, острой и хронической надпочечниковой недостаточности (снижении секреции альдостерона), избыточном выведении натрия почками, избыточном поступлении воды в организм или задержке ее в организме (сердечная недостаточность). Гипернатриемия может возникнуть при олигоурии или анурии любого происхождения, гиперпродукции коры надпочечников (синдром Кушинга, первичный альдостеронизм), вследствие приема большого количества лекарственных средств (кортикостероидов, АКТГ), при парентеральном введении гипертонического раствора натрия или в результате ограничения приема жидкости. Калий – основной катион внутриклеточной жидкости. Содержание калия в сыворотке крови – 4-5,5 ммоль/л. Физиологическая роль калия в организме обусловлена участием К+ в создании электро-химического потенциала на клеточной мембране. Встроенная в плазматическую мембрану клетки Na+, К+-АТФаза (Na+, К+-насос) осуществляет сопряженный с гидролизом АТФ активный выброс Na+ из клетки и закачивание К+ в клетку: транспорт калия и натрия через клеточную мембрану лежит в основе возникновения процесса возбуждения мышечной и нервной ткани. Ионы К+ обладают выраженной биологической активностью и участвуют в регуляции функций сердца, нервной системы, скелетной и гладкой мускулатуры, участвует в биосинтезе гликогена, поддержании осмотического давления и кислотно-щелочного состояния (буферные системы). Гипокалиемия возникает при недостаточном приеме калия с пищей; усиленном выделении калия с мочой (гиперфункция коры надпочечников и передней доли гипофиза); усиленной секреции АДГ; алкалозе; гиперсекреции (введении) АКТГ, альдостерона. Гиперкалиемия наблюдается при повышенном распаде клеток и тканей; нарушении выделения калия с мочой; обезвоживании; анафилактическом шоке. Кальций – внеклеточный катион. Содержание кальция в плазме (сыворотке) крови человека, весьма тонко регулируемая биологическая константа, колеблется в пределах 2,25-2,5 ммоль/л. Физиологическая роль кальция сводится к тому, что он:
Большая часть кальция (около 99 %) находится в костной ткани и зубах. Общий кальций крови включает три фракции: белок-связанный, ультрафильтрующийся (ионизированный) и неионизированный (в составе пирофосфата, сульфата и фосфата). В регуляции кальциевого обмена участвуют: 1. Паратгормон – активирует мобилизацию кальция из костной ткани, усиливает канальцевую реабсобцию кальция и тормозит ребсорбцию фосфата. 2. Кальцитонин – обеспечивает депонирование кальция в костной ткани. 3. Активная форма витамина D3 – 1,25-дегидроксихолекальцеферол - в слизистой кишечника способствует превращению белка предшественника в кальций-связывающий белок, который участвует во всасывании кальция из кишечника. Гипокальциемия наблюдается при гипофункции паращитовидных желез; нарушении всасывания или повышенном выведение кальция при нарушениях переваривания и всасывания; дефиците витамина D или резистентности к нему при рахите; нарушении образования кальцитонина. Гиперкальциемия возникает при приобретенной повышенной чувствительности к витамину D; гиперпаратиреоидизме; повышенном всасывании кальция; снижении выделения кальция с мочой. Магний. Содержание магния в сыворотке крови составляет от 0,74 до 1,23 ммоль/л. Во внеклеточном сегменте содержится в меньших количествах по сравнению с внутриклеточной жидкостью (примерно в 10 раз). Депонируется магний, главным образом, в коже и мышцах, а выводится через желудочно-кишечный тракт от 40 до 80 %. Магний имеет большое значение для нормальной жизнедеятельности, т.к. входит в состав многих ферментных систем (биосинтеза белка, ассоциации рибосом), активирует ацил-КоА-синтетазу, фосфорилазу, обеспечивает гликолиз, циклы Кребса и мочевинообразования, принимает участие в нервно-мышечной возбудимости; в виде фосфата и бикарбоната входит в состав костной ткани; является антагонистом кальция. Повышение концентрации магния в крови происходит при ануриях, хронической почечной недостаточности, гипотиреозе. Снижение концентрация магния в крови наблюдается при раковых опухолях, хронической сердечной недостаточности, острой и хронической почечной недостаточности, гипертиреозе. Фосфор. Содержание фосфатов в плазме крови 0,8-2 ммоль/л, в клетках крови примерно в 30-40 раз выше, чем в плазме. Фосфат крови и костной ткани находится в состоянии динамического равновесия – при снижении содержания фосфатов в плазме они переходят в кровь из костей и наоборот. Биологическая роль: - входит в состав нуклеотидов, нуклеиновых килот, фосфолипидов, фосфопротеидов, витаминов, коферментов и т.д.; - фосфорилирование и дефосфорилирование биомолекул является одним из механизмов активации и инактивирования; - присоединения фосфата к АДФ – основа процесса окислительного фосфорилирования; - анионы НРО42- и Н2РО4- представляют фосфатную буферную систему, которая участвует в регуляции кислотно-щелочного равновесия; - анионы фосфата – главные минеральные компоненты скелета. Гиперфосфатемия наблюдается при гиперпаратиреоидизме; гипервитаминозе D; поражении почек. Гипофосфатемия сопровождает диабетический кетоацидоз; гиповитаминоз D; нарушения реабсорбции фосфатов и др. Хлор. Содержание хлора в сыворотке крови – 45-110 ммоль/л. В организме он находится в ионизированном состоянии в виде солей натрия, калия, кальция, магния и др. Играет важную роль в поддержании кислотно-щелочного равновесия (между плазмой и эритроцитами), осмотического давления (между кровью и тканями) и баланса воды в организме, активирует ферменты (амилазу). Соляная кислота входит в состав желудочного сока, участвует в переваривании белковой пищи. Хлор – важнейший анион внеклеточного пространства. В регуляции обмена хлора принимает участие щитовидная железа: при недостаточной функции ее происходит задержка хлора и натрия и развивается микседема. Сера в организме находится, преимущественно, в составе сложных органических соединений. Сера теснейшим образом связана с белковым, углеводным и липидным обменом. В составе аминокислот метионина, цистеина и цистина сера входит в состав различных белков, стабилизируя их структуру дисульфидными связями. Кроме того, сера является одним из липотропных факторов, принимает участие в биосинтезе фосфолипидов, предотвращая жировую инфильтрацию печени. С углеводами сера связана в форме гликозаминогликанов (основа соединительной ткани), является составной частью липидов нервной ткани - сфинголипидов. Сера входит в состав гормонов (инсулина), витаминов (биотина, тиамина, липоевой кислоты), коэнзима А, глутатиона, ФАФС. Микроэлементы - железо, медь, марганец, цинк, фтор, молибден, иод и др. содержаться в организме в низких концентрациях (10-3-10-5 % весовых процентов, не превышают 1 мкг на грамм веса живой ткани), Биологическая роль микроэлементов определяется участием практически во всех видах обмена веществ: они являются кофакторами многих ферментов, компонентами витаминов, гормонов, участвуют в процессах кроветворения, роста, размножения и дифференцировки, стабилизации клеточных мембран, тканевом дыхании, иммунных реакциях и многих других процессах, обеспечивающих нормальную жизнедеятельность. Железо содержится в организме 3,5 –4,2 г, в сыворотке крови – 11,64-31,34 мкмоль/л. Суточная потребность в железе – 15 мг. Снижение содержания железа в пище до 5-6 мг приводит к малокровию, т.к. снижается синтез гемоглобина; избыток железа в организме вызывает гемохроматоз. Во всасывании железа участвует апоферритин, белок крови трансферрин регулирует количество железа в сыворотке крови. Депонируется железо в форме ферритина (резервная форма). Железо выделяется в основном через кишечник и в незначительном количестве с мочой. Функции железосодержащих биомолекул:
Медь участвует в биохимических процессах как составная часть электронпереносящих белков, осуществляющих реакции окисления органических субстратов молекулярным кислородом. Находясь в составе церулоплазмина (белок, обладающий ферментативной активностью, транспортирует медь по крови), медь участвует в переводе железа из двухвалентного в трехвалентное состояние, ускоряя образование трансферрина, и таким образом, участвует в кроветворении. Ферменты, содержащие медь: - аминоксидаза и др. (окисление первичных аминов); - супероксиддисмутаза (СОД); тирозиназа; - цитохром-с-оксидаза; - церулоплазмин – обладает активностю ферроксидазы, аминноксидазы, СОД, участвует в гомеостазе меди, играет роль реактанта острой фазы в воспалительных процессах, защищает липидные мембраны от перекисного окисления. Цинк играет важную роль в обмене белков, кроветворении и окислительно-восстановительных процесса. Цинку принадлежит важная роль в синтезе белка и нуклеиновых кислот. Он присутствует во всех 20 изученных в настоящее время нуклеотидилтрансферазах, необходим для стабилизации структуры ДНК, РНК и рибосом, играет важную роль в процессе трансляции, развитии скелета и процесса кальцификации, стабилизирует клеточные мембраны. Он входит в состав инсулина, усиливает активность половых гормонов. Ферменты, содержащие цинк: алкогольдегидрогеназа; супероксиддисмутаза (СОД); карбоксипептидаза А, В; щелочная фосфатаза; карбоангидраза. Марганец активирует биологическое окисление, в ряде биологических реакциях действует как окислитель и активирует ряд ферментов, принимающих участие в углеводном обмене. Ферменты, содержащие марганец: аргиназа; пируваткарбиксилаза. Ферменты, активируемые марганцем: мевалонаткиназа; РНК-полимераза; ДНК-полимераза; галактозилтрансфераза; щелочная фосфатаза; кислая фосфатаза; фосфоенолпируват-карбоксикиназа; глутаминсинтетаза. Марганец необходим для нормальной секреции инсулина. Хром усиливает действие инсулина во всех метаболических процессах, регулируемых этим гормоном. Прочно связывается с нуклеиновыми кислотами и защищает их от денатурации. Способен замещать йод в тиреоидных гормонах. |
