Лекция Историческая справка и основные положения аналитической химии
 Скачать 287.62 Kb. Скачать 287.62 Kb.
|
|
Лекция № 2. Стадии аналитического процесса Решение аналитической задачи осуществляется путем выполнения анализа вещества. По терминологии ИЮПАК анализом* называют процедуру получения опытным путем данных о химическом составе вещества. Независимо от выбранного метода проведение каждого анализа складывается из следующих стадий: отбор пробы (пробоотбор); подготовка пробы (пробоподготовка); измерение (определение); обработка и оценка результатов измерений.
Метод анализа ─┘ └─────────── Методика анализа ────┘ Рис1. Схематическое изображение аналитического процесса. 1.Отбор проб Проведение химического анализа начинают с отбора и подготовки пробы к анализу. Следует отметить, что все стадии анализа связаны между собой. Так, тщательно измеренный аналитический сигнал не дает правильной информации о содержании определяемого компонента, если неправильно проведен отбор или подготовка пробы к анализу. Погрешность при отборе пробы часто определяет общую точность определения компонента и делает бессмысленным использование высокоточных методов. В свою очередь отбор и подготовка пробы зависят не только от природы анализируемого объекта, но и от способа измерения аналитического сигнала. Приемы и порядок отбора пробы и ее подготовки настолько важны при проведении химического анализа, что обычно предписываются Государственным стандартом (ГОСТ). Рассмотрим основные правила отбора проб: Результат может быть правильным только в том случае, если проба достаточно представительна, то есть точно отражает состав материала, из которого она была отобрана. Чем больше материала отобрано для пробы, тем она представительней. Однако с очень большой пробой трудно работать, это увеличивает время анализа и расходы на него. Таким образом, отбирать пробу нужно так, чтобы она была представительной и не очень большой. Понятие «анализ» в философском смысле – это процесс мысленного или фактического разложения целого на составные части. Сущность первоначально имевшегося целого затем познают, воссоздавая его воображаемым синтезом. Анализ и синтез взаимосвязаны и дополняют друг друга.  9 Оптимальная масса пробы обусловлена неоднородностью анализируемого объекта, размером частиц, с которых начинается неоднородность, и требованиями к точности анализа. Для обеспечения представительности пробы необходимо обеспечить однородность партии. Если сформировать однородную партию не удается, то следует использовать расслоение партии на однородные части. При отборе проб учитывают агрегатное состояние объекта. Должно выполняться условие по единообразию способов отбора проб: случайный отбор, периодический, шахматный, многоступенчатый отбор, отбор «вслепую», систематический отбор. Один из факторов, который нужно учитывать при выборе способа отбора пробы – возможность изменения состава объекта и содержания определяемого компонента во времени. Например, переменный состав воды в реке, изменение концентрации компонентов в пищевых продуктах и т.д. 2.Подготовка пробы к анализу Как правило, главное в этой стадии – это усреднение и растворение пробы. Начальную пробу (генеральную) гомогенезируют и усредняют методом квартования до такого количества, которое используется для анализа (лабораторная проба). Растворение пробы, сопровождается переводом определяемого компонента в раствор. Различают „мокрое‖ и „сухое‖ озоление. 3.Стадия измерения Энергетическое или вещественное воздействие на пробу приводит к появлению динамических сигналов (изменение окраски, фазовые превращения и т.п.). На заключительном этапе измерения аналитические сигналы регистрируют тем или иным способом и получают регистрограммы, фотографии, наборы чисел и т.д. Для выражения связи между результатами анализа и измерительными данными используют обычно следующие способы: 1)Табличное сопоставление (качественный анализ) – схема хода химического систематического анализа). 2)Графическое представление – для решения задач количественного анализа. Это кривые и диаграммы титрования, различные градуировочные графики. 3)Функциональные уравнения. Полученное цифровое значение подставляют в формулу, например, в уравнение титрования: V1H1=V2H2 ; H1= V2H2 /V1 10 4.Оценка результатов измерений Это заключительная аналитическая стадия, ее осуществляют, рассчитывая случайные и систематические погрешности (ошибки). Установление химического состава вещества относится к метрологическим процедурам, связано это с тем, что в аналитической химии измерение носит не прямой, а косвенный характер, так как измеряется не число химических частиц, а, например, их общая масса, физические свойства, расход реагента и т.д. Кроме того, компоненты химической системы оказывают взаимное влияние, и часто очень сильное, что приводит к искажениям аналитических сигналов. Все это вызывает появление погрешностей при каждом аналитическом определении. Результаты количественного анализа оценивают такими метрологическими характеристиками, как правильность и воспроизводимость. Если при параллельных опытах получают близкие значения количеств или концентраций определяемого вещества, то такие результаты называют воспроизводимыми. Если полученные значения близки к истинному, то говорят о правильности результатов анализа. Результаты могут быть правильными и воспроизводимыми; воспроизводимыми, но неправильными; неправильными и невоспроизводимыми. Все усилия химиков-аналитиков направлены на разработку методов и методик анализа, обеспечивающих правильные и воспроизводимые результаты. Результат, получаемый при однократном проведении последовательных операций, предусмотренных методикой анализа, называют единичным определением. Параллельные определения –получение нескольких результатов единичныхопределений для одной пробы в практически одинаковых условиях. Результат анализа –среднее значение результатов параллельных определений,характеризуется значением границ доверительного интервала (стандартным отклонением), а также воспроизводимостью и правильностью (точностью) анализа.
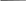 где:  – среднее арифметическое значение; ε р = tрSх – доверительный интервал; tр - коэффициент Стьюдента; Sx – стандартное отклонение. 11 Лекция №3. Качественный анализ Основные понятия качественного анализа Несмотря на возросшую роль теоретических и инструментальных аспектов в курсе химии, изучение химических свойств по-прежнему составляет неотъемлемую основу любого химического образования. Важную роль в изучении свойств веществ играет курс качественного неорганического анализа. В настоящее время качественный анализ рассматривается не столько как часть аналитической химии, сколько как введение в общую химию. Качественный анализ заключается в обнаружении отдельных элементов (или ионов), из которых состоит анализируемое вещество. Исследуя какое-нибудь новое соединение, прежде всего, определяют из каких элементов (или ионов), оно состоит, а затем уже количественные отношения, в которых они содержатся. Поэтому качественный анализ вещества, как правило, предшествует количественному. Аналитические реакции и способы их выполнения Анализируемые вещества могут находиться в различных агрегатных состояниях (твердом, жидком и газообразном). Соответственно этому и качественные аналитические реакции могут быть выполнены „сухим‖ или „мокрым‖ путем. Анализ сухим путем осуществляют с помощью таких приемов, как проба на окрашивание пламени, получение цветных стекол („перлов‖) и рассмотрение металлических ―корольков‖. Эти приемы называют пирохимическими (от греч. „пир‖ - огонь). При выполнении окрашивания в пламени пробы, исследуемое вещество на петле платиновой (или нихромовой) проволочки вносят в бесцветное пламя горелки. По характерной окраске пламени узнают о присутствии того или иного элемента. Например, натрий окрашивает пламя в ярко желтый цвет , калий- в фиолетовый, медь и бор - в ярко-зелѐный, свинец и мышьяк – в бледно-голубой. Окрашенные стекла, или перлы, приготовляют сплавлением исследуемого вещества с бурой Na2B407•10H2O (или с гидрофосфатом натрия-аммония NaNH4HPO4•4Н2О) в ушке платиновой проволочки над пламенем. Окраска перла указывает на присутствие того или иного металла. Например, хром окрашивает перл буры в зеленый цвет, кобальт - в синий, марганец - в фиолетовый. Металлические корольки получаются при прокаливании анализируемых минералов на древесном угле с помощью паяльной трубки. По внешнему виду их также можно судить о составе испытуемого материала. Анализ „сухим‖ путем используют главным образом в полевых условиях для качественного или полуколичественного исследования минералов и руд. лабораторных условиях обычно применяют анализ „мокрым‖ путем, который основан на реакциях в растворах. Естественно, что при этом исследуемое вещество должно быть сначала переведено в раствор. Если оно не растворяется в дистиллированной воде, то используют уксусную, соляную, азотную и другие кислоты. Химически взаимодействуя с кислотами, анализируемое вещество (соль, гидроксид или оксид) превращается в легко растворимое соединение: 12 СаСО3 + 2НСН3СОО = Са (СНзСОО)2 + Н2О + СО2 Аl(ОН)3 + 3НСl = АIСl3 + 3Н2О, СuО + 2НNО3 = Сu(NО3)2 + Н2О В полученном растворе обнаруживают те или иные ионы. Не все химические реакции пригодны для качественного анализа. Аналитическими являются только те реакции, которые сопровождаются каким-нибудь внешним эффектом, позволяющим установить, что химический процесс происходит: выпадением или растворением осадка, изменением окраски анализируемого раствора, выделением газообразных веществ. Кислотно-основные реакции СН3СОО- + Н3О+ ↔ СН3СООН(г.) + Н2О Выделение свободной уксусной кислоты (обозначение г. — газ) при добавлении сильной кислоты (например, соляной или серной) используется для обнаружения ацетат-ионов. Партнером ацетат-иона в этой реакции является ион водорода, существующий в воде и гидратированной форме, формулу которой записывают обычно как Н3О+ (правильнее было бы записывать (H2O)4H+ или H9O4+). Аналогичным образом (по выделению свободного аммиака при действии сильных щелочей, например гидроксида натрия) можно обнаружить и ион аммония: NH++ОН↔NH3(г.) Реакции комплексообразования AgCl + 2NH3↔ [Ag(NHg)2]2+ + 2Сl- Растворение малорастворимого хлорида серебра (см. ниже, «реакции осаждения») при действии аммиака происходит вследствие образования диаминного комплекса серебра. Cu(H2O)42+ + 4NH3 ↔ [Cu(NH3)4J2+ + 4H2O гидратированном ионе Cu2+ происходит обмен молекул воды на молекулы аммиака с образованием интенсивно окрашенного синего аммиаката меди. Используются также реакции комплексообразования с органическими реагентами 8-оксихинолином, ализарином S и др. Реакции осаждения Ag+ + Сl- ↔ AgCl (тв.) Ионы Ag+ (или Сl-) осаждаются в виде малорастворимого хлорида серебра (о его растворении см. выше). Вa2+ + SO42- ↔BaSO4(тв.) Ионы Ba2+ (или SO42-) осаждаются в виде малорастворимого сульфата бария. Реакции полимеризации Многие вещества в водных растворах способны образовывать димеры или полимеры линейного или циклического строения. Простейшим примером может 13 служить димеризация хромат-иона с образованием бихромат-иона, сопровождающаяся изменением желтой окраски на оранжевую: CrO42- + ↔ HCrO4- 2HCrO4- ↔ Cr2O72- + H2O (Cr2O72- = [O3Cr-O-CrO3]2-) Еще одной важной в аналитическом отношении реакцией является взаимодействие ионов двух различных типов с образованием смешанного полимерного соединения, так называемого гетерополисоединения. Примером может служить взаимодействие молибдат- и фосфат-ионов:
Эта реакция применяется для обнаружения фосфат-иона по образованию желтого осадка гетерополисоединения. Окислительно-восстановительные реакции Эти реакции связаны с переносом электронов и могут протекать в различных формах. Простой обмен электронами: Ce4+ + Fe2+ ↔ Ce3+ + Fe3+ Гетерогенные реакции между ионами в растворе и твердыми веществами: Cu2+ + Fe (тв.) ↔ Cu(тв.) + Fe2+ Реакции диспропорционирования: 2Cu+ ↔ Cu2+ + Cu(тв.) Реакции компропорционирования (синпропорционирования): IO3- + 5I- + 6H+ ↔ 3I2 + 3H2O Реакции с выделением газов Для обнаружения ионов часто используют реакции с выделением газов (например, см. приведенные выше кислотно-основные реакции). Выделяющийся газ затем обычно вступает в другую реакцию, которая, собственно, и используется для обнаружения. Например, для обнаружения карбонат-ионов используют выделе- ние диоксида углерода при действии кислот. Выделяющийся газ можно затем обнаружить при помощи реакции образования малорастворимого карбоната бария: H++ HCO3-→H2O+ СO2(г.) СO2(г.) + Ba2+ + 2OH- → BaCO3(тв.) + H2O аналитическом отношении важное значение имеет также реакция диоксида кремния и плавиковой кислоты (HF), сопровождающаяся образованием летучих соединений кремния с фтором: SiO2(тв.) + 4HF ↔ SiF4(г.) + 2H2O SiO2(тв.) + 6HF ↔ H2SiF6(г.) + 2H2O зависимости от количества плавиковой кислоты образуется либо тетрафторид кремния, либо летучая кремнефтороводородная кислота. Чтобы равновесия 14 указанных реакций сместить вправо, необходимо связать выделяющуюся воду путем добавления концентрированной серной кислоты. Смещение этих равновесий обратном направлении можно использовать для обнаружения выделившихся газов по выпадению осадка диоксида кремния. точки зрения наблюдаемых эффектов все реакции обнаружения можно разделить на четыре группы: 1)образование характерных осадков, 2)растворение осадков, 3)появление (изменение) окраски, 4)выделение газов. |
