Лекции ОХТ для заочников. Лекция 1 Предмет и содержание курса охт
 Скачать 1.88 Mb. Скачать 1.88 Mb.
|
|
Лекция № 1 Предмет и содержание курса «ОХТ» Слово «технология» греческого происхождения и имеет дословный перевод «наука о мастерстве». С современной точки зрения мы можем определить технологию как науку, изучающую способы и процессы массовой переработки сырья в продукты потребления с максимальным экономическим эффектом. Технологии бывают механические и химические. Механическая технология изучает процессы, связанные с изменением формы и физических свойств перерабатываемого сырья главным образом, путем механических операций. Например, изготовление изделий из древесины – деревообрабатывающие технологии, изготовление изделий из металла – машиностроение и т.д. Химическая технология изучает процессы, связанные с изменением состава и химических свойств перерабатываемого сырья за счет протекания химических реакций. Существует великое множество частных химических технологий, которые можно объединить в две большие группы:
При разработке любой частной технологии нужно знать три общеинженерные дисциплины: общую химическую технологию (ОХТ), процессы и аппараты химической технологии (ПАХТ) и промышленную теплотехнику (ПТ), которые вместе составляют основу промышленной химии.
Общая химическая технология – наука, изучающая теоретические основы разработки технологий для различных классов химических реакций. Предмет изучения ОХТ – закономерности, лежащие в основе функционирования химического производства. Задачи ОХТ как науки: 1) отыскание общих закономерностей протекания химико-технологических процессов; 2) на основе знания общих закономерностей нахождение оптимальных условий ведения химико-технологических процессов; 3) изучение химических превращений с учетом массо- и теплообменных процессов; 4) повышение эффективности использования сырья, энергии, снижение количества отходов и выбросов в окружающую среду; повышение качества выпускаемой продукции. Методы ОХТ: - экспериментальный; - моделирование. Основные понятия химической технологии Химическое производство – совокупность процессов и операций, осуществляемых в машинах и аппаратах и предназначенных для переработки сырья путем химических превращений в необходимый продукт. Химико-технологический процесс (ХТП) – часть химического производства, состоящая из трех основных стадий: 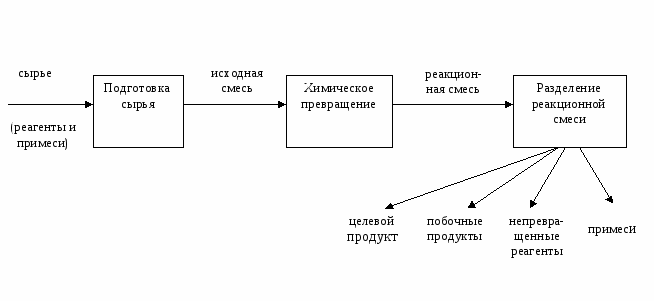 Целевой продукт – продукт, ради которого организован данный ХТП. Все остальные продукты называют побочными. Побочные продукты могут получаться как в целевой, так и в побочных реакциях. Если побочный продукт не находит применения, его называют отбросом; если он используется, то его называют отходом или вторичным сырьем. Если целевой продукт используется в качестве исходного материала в другом производстве, то он называется полупродуктом. Исходный материал, поступающий на переработку и обладающий стоимостью, называют сырьем. Вещество, принимающее непосредственное участие в целевой химической реакции, называется реагентом. Реагент – это главный, но не единственный компонент сырья. Все компоненты сырья, которые не участвуют в целевой реакции, называют, обычно, примесями. В технологии часто пользуются понятиями «превращенный» и «непревращенный» реагент. Превращенный реагент – это то количество реагента, которое вступило в реакции (как целевые, так и побочные). Непревращенный реагент – это то количество реагента, которое выходит из реактора в непревращенном, первоначальном состоянии. Сумма масс превращенного и непревращенного реагента равна массе поданного в реактор реагента. Вспомогательные материалы – химические вещества, которые обеспечивают нормальное протекание ХТП (катализаторы, растворители и др.). Исходная смесь – смесь веществ, поступающих в реактор, на стадию химического превращения. Реакционная смесь – смесь веществ, находящихся в реакторе или выгружаемых из него. Ее состав меняется в процессе реакции. Мы можем говорить о составе реакционной смеси в определенный момент времени от начала реакции. Пример: 4NH3 + 5O2 → 4NO + 6H2O 4NH3 + 3O2 → 2N2 + 6H2O 4NH3 + 4O2 → 2N2O + 6H2O Первая реакция является целевой, две другие – побочные. Оксид азота (II) – NO –целевой продукт на стадии окисления аммиака и полупродукт в производстве азотной кислоты. Вода, азот и оксид азота (I) – побочные продукты. Реагентами в этом процессе являются аммиак и кислород; сырьем – аммиак, содержащий некоторое количество примесей, и воздух, в котором примесями являются азот и другие газы. Вспомогательным материалом является платина, используемая в процессе в качестве селективного катализатора, ускоряющего только первую реакцию. Исходная смесь представляет собой аммиачно-воздушную смесь с содержанием аммиака 9,5 – 11,5 % об. Реакционная смесь – нитрозные газы, содержащие NO, N2O, N2, пары H2O, а также непревращенные О2 и NН3. Анализ эффективности проведения ХТП Для оценки эффективности проведения ХТП служат ряд показателей, которые можно объединить в четыре группы.  Об эффективности химического производства в целом судят, прежде всего, по экономическим показателям. Одним из самых значимых экономических показателей является себестоимость, то есть затраты предприятия в денежном выражении, связанные с производством единицы химического продукта. Разница между ценой и себестоимостью продукта, умноженная на объем производства составляет прибыль производителя. Снижение себестоимости продукции является чрезвычайно важной задачей для химика-технолога как производителя химического продукта. Для оценки целесообразности и эффективности различных путей снижения себестоимости продукта оценим вклад затрат различного вида в общую сумму затрат на его производство.
Из проведенного сравнения можно сделать вывод, что наиболее эффективными путями снижения себестоимости является рациональное использование сырья и уменьшение энергоемкости производства. При оценке эффективности химического производства большое значение имеют также социальные критерии, показывающие степень безопасности производства для людей и окружающей природы. При определении эффективности отдельных этапов процесса производства химического продукта пользуются технологическими и технико-экономическими показателями. Конверсия, выход целевого продукта и селективность с разных сторон характеризуют эффективность проведения конкретной химической реакции:
Наиболее обобщенным показателем является выход целевого продукта. Его величина зависит от «α» и «S». Для простых реакций S = 100% и α = β. Для сложных реакций, когда наряду с целевой реакцией протекают побочные реакции, S < 100% и α ≠ β. Производительность и интенсивность характеризуют эффективность работы отдельных аппаратов. Величина этих показателей определяется эффективностью использования возможностей, как самой химической реакции, так и реактора, в котором она проводится. Производительность и интенсивность в обобщенном виде содержат величины выхода целевого продукта и средней скорости процесса. Конверсия (степень превращения) реагента рассчитывается по формуле: где Nпод., Nпрев., Nнепревр. – соответственно количество поданного, превращенного и непревращенного реагента. Эти величины можно задавать в единицах количества вещества (моль, кмоль) или в единицах массы (г, кг и др.). Степень превращения выражают в долях или в процентах; в последнем случае выражение (1) для расчета умножают на 100. Часто, особенно в непрерывных процессах, конверсию рассчитывают через концентрацию реагента в исходной и реакционной смеси: где С0 –концентрация реагента в исходной смеси, С – концентрация реагента в реакционной смеси. Выражение (2) справедливо лишь в том случае, когда реакция протекает без изменения объема реакционной смеси. Изменение объема реакционной смеси в процессе реакции можно учесть с помощью коэффициента изменения объема ε. где V0 – начальный объем, V- объем реакционной смеси к определенному моменту времени. Величина ε является положительной при увеличении объема смеси во время реакции и отрицательной при его уменьшении. Изменение объема при жидкофазных процессах происходит, например, при поглощении какого-либо газа жидкостью или при разложении жидкого вещества с образованием летучих продуктов. Для газофазных процессов изменение объема обычно происходит из-за изменения числа молей веществ во время реакции. В последнем случае ε зависит от начального и конечного числа молей смеси. Если реагенты взяты в стехиометрическом соотношении и в реакционной смеси отсутствует разбавитель, то для реакции aA + bB → rR +sS коэффициент изменения объема «ε» равен При избытке одного из реагентов или при наличии в реакционной смеси разбавителя (инертного газа) «ε» рассчитывается по формуле: где k – доля стехиометрической смеси исходных реагентов в реакционной смеси. Для стехиометрической смеси k = 1. С учетом коэффициента изменения объема реакционной смеси конверсия реагентов рассчитывается по формуле (7). Степень превращения реагентов в реакторе изменяется во времени от нуля до некоторой максимальной величины. В необратимых процессах максимальное значение конверсии равно 100%, т.е. все количество реагентов может превратиться в продукты. Пределом протекания обратимой реакции является достижение равновесного состояния системы, при котором скорость прямой и обратной реакции равны, а состав реакционной смеси остается постоянным во времени. Степень превращения реагентов, достигаемая к этому моменту, называется равновесной конверсией (*) и является максимальной для данного процесса при определенных условиях его проведения. Селективность (избирательность, избирательная конверсия) используется для характеристики сложных процессов, в которых наряду с целевой реакцией протекают побочные реакции. Полная (интегральная) селективность где Эти величины можно задавать в единицах количества вещества (моль, кмоль) или в единицах массы (г, кг и др.). Полную селективность выражают в долях или процентах; в последнем случае выражение (8) умножают на 100. Мгновенная (дифференциальная) селективность где rцел.р. – скорость расходования реагента по целевой реакции; rобщ. – суммарная скорость расходования реагента. Понятие мгновенной селективности имеет смысл только для сложных параллельных реакций. Если в процессе химической реакции объем реакционной смеси не изменяется (V=const), то селективность можно рассчитывать, используя концентрацию реагента и целевого продукта в реакционной смеси. Например, для реакции aA + bB → rR +sS , где R - целевой продукт где М(А), М(R) – молярные массы, Выход целевого продукта – это отношение реально полученного количества продукта (Nфакт.) к максимально возможному его количеству (Nmax), которое могло быть получено при данных условиях осуществления химической реакции. Nфакт. и Nmax можно задавать в единицах количества вещества (моль, кмоль) или в единицах массы (г, кг и др.). Выход выражают в долях или процентах; в последнем случае выражение (10) умножают на 100. Расчет величины β зависит от типа химической реакции. В случае необратимой реакции величину Nmax (в молях) рассчитывают по уравнению реакции: aA + bB → rR +sS , где R – целевой продукт Если NА – количество подаваемого в реактор реагента, полученное значение Nmax является максимально возможным для этой реакции, а рассчитанный по уравнению (10) выход называют выходом на поданный реагент А. Если NА – количество превращенного реагента, то рассчитанная по уравнению (10) величина называется выходом на превращенный реагент А. В случае обратимой химической реакции пользуются понятием «равновесный выход» - β*. 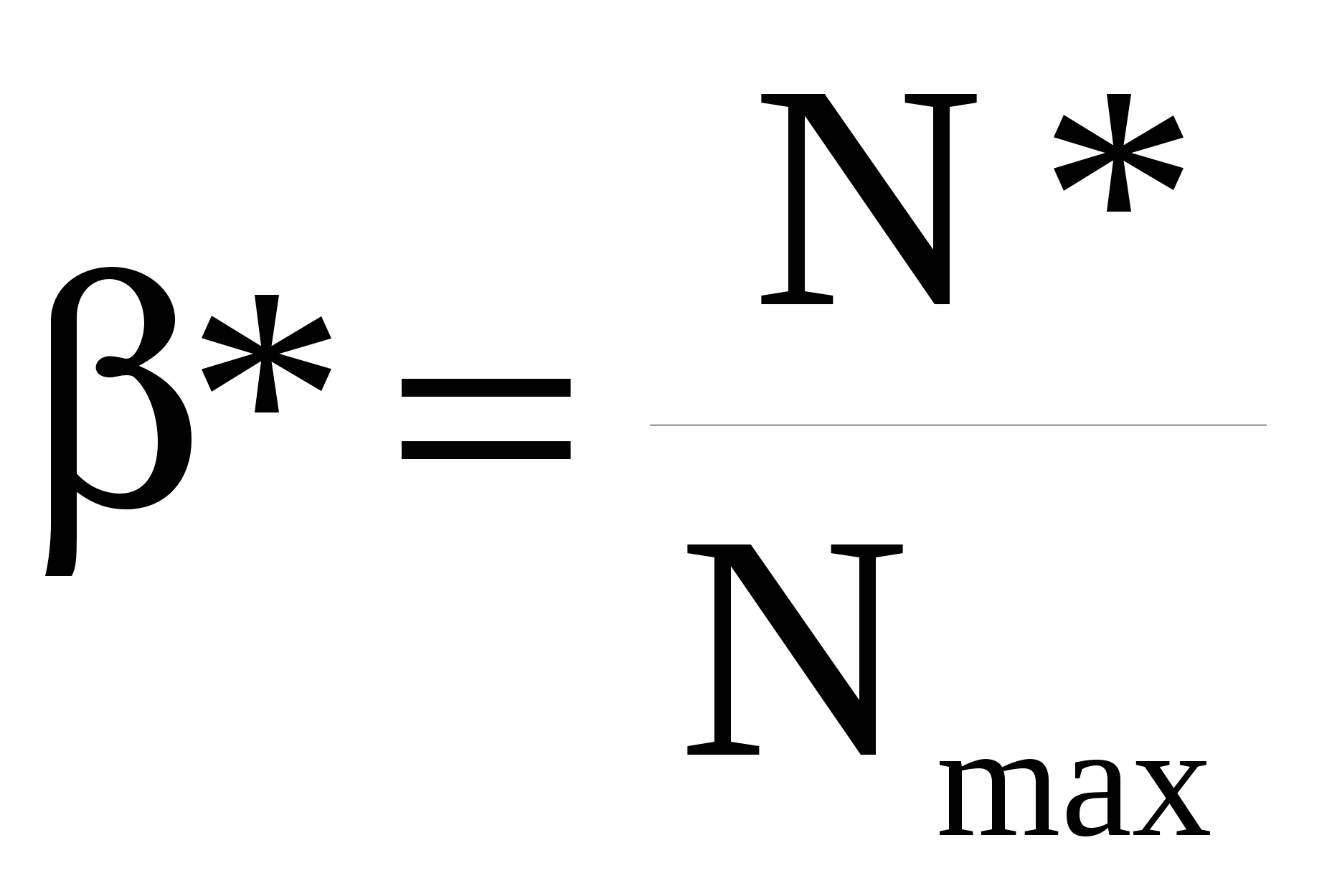 , (12) , (12)где N* - количество продукта, образовавшегося к моменту достижения химического равновесия; Nmax – максимальное количество продукта, которое может образоваться по данной реакции при условии, что поданный реагент полностью превращается в целевой продукт. Равновесный выход характеризует степень смещения равновесия в сторону образования целевого продукта. Отношение 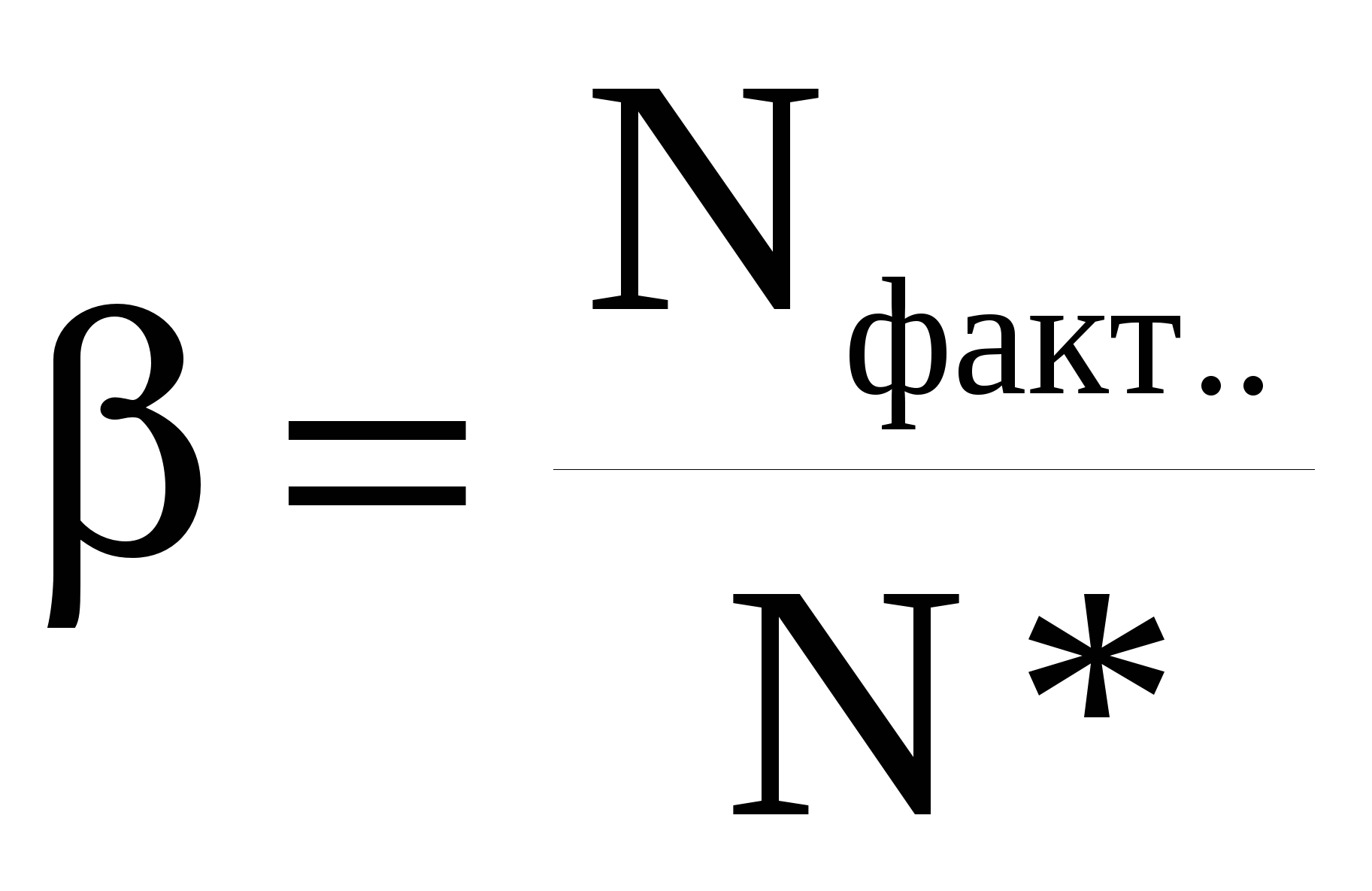 (13), где Nфакт. – фактически полученное количество продукта, показывает степень достижения равновесия. (13), где Nфакт. – фактически полученное количество продукта, показывает степень достижения равновесия.Расчет селективности и выхода продукта можно проводить по любому из реагентов; обычно выбирают тот реагент, который взят в недостатке, или наиболее дорогостоящий реагент. Производительность – количество целевого продукта, производимое в единицу времени. Интенсивность – количество целевого продукта, производимое в единицу времени с единицы объема реактора или с единицы поверхности катализатора. Пропускная способность установки – количество сырья, пропускаемое через установку в единицу времени. Расходный коэффициент по сырью - это масса сырья, которая расходуется на получение единицы массы целевого продукта. Расходный коэффициент рассчитывается по таблице материального баланса; он всегда больше теоретического расходного коэффициента, который рассчитывают по уравнению реакции: Качество продукции – совокупность свойств целевого продукта, обуславливающих его пригодность удовлетворять определенные потребности в соответствии с его назначением. Качество химического продукта зависит от качества исходного сырья и материалов, уровня развития науки и техники, прогрессивности применяемой технологии, организации труда и производства, квалификации кадров и регулируется различными нормативными документами: ГОСТ – государственный стандарт, ОСТ – отраслевой стандарт, РСТ – республиканский стандарт, СТП – стандарт предприятия, ТУ – технические условия. | |||||||||||||||||||||||||||||||||||||||
