Лекции ОХТ для заочников. Лекция 1 Предмет и содержание курса охт
 Скачать 1.88 Mb. Скачать 1.88 Mb.
|
|
Лекция № 5 Закономерности управления химико-технологическими процессами Управлять ХТП – это означает, меняя технологические параметры процесса (температуру, давление, состав сырья, катализатор, скорость перемешивания, конструкцию реактора, схему соединению реакторов и т.д.) добиваться максимальной эффективности процесса. Для этого нужно знать функциональную зависимость выбранного критерия эффективности от величины технологических параметров. Изучением этих зависимостей и занимается наука ОХТ. При изучении общих закономерностей мы используем метод декомпозиции, то есть рассмотрим особенности функционирования отдельных подсистем ХТС. Главной подсистемой ХТС является подсистема химического превращения. В подсистеме химического превращения происходит превращение исходных реагентов в продукты в специальных аппаратах, которые называют реакторами. При этом протекают следующие процессы:
Три последние группы процессов являются физическими, они сопровождают химический процесс, оказывая в той или иной степени влияние на эффективность протекания всего ХТП в целом. Упрощая задачу, рассмотрим сначала только химические процессы, то есть непосредственно химические реакции, лежащие в основе ХТП, и найдем закономерности управления ими. В основе ХТП могут лежать разные реакции. Используем метод моделирования и сведем все многообразие химических реакций к нескольким достаточно простым моделям и для каждой модели определим критерий эффективности протекания этой реакции и зависимость этого критерия от технологических параметров. 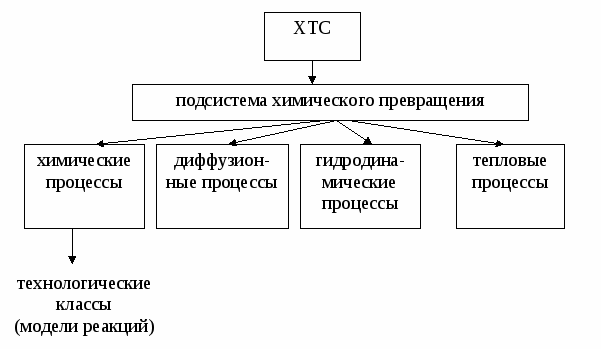 Технологическая классификация химических процессов (модели реакций) Разработка любой химической технологии начинается с технологической классификации химического процесса, то есть с определения основных признаков, определяющих выбор объектов и инструментов его управления, конструкции реактора и т.д. Существует ряд признаков, по которым можно классифицировать химические процессы.
Простые процессы описываются одним стехиометрическим уравнением. А → С или А + В → С + D В сложных процессах наряду с целевой реакцией протекают побочные реакции, и для описания процесса требуется несколько уравнений. Сложные процессы могут быть: - последовательные (консекутивные) А + В → R R → S - параллельные А + В → R А + C → S - смешанные А + В → R А + R→ S 2) Процессы могут быть необратимые и обратимые. Обратимые процессы в отличие от необратимых протекают одновременно в прямом и обратном направлении. 3) Процессы могут быть экзо- и эндотермические, то есть протекать соответственно, с выделением или поглощением тепла. Различают также процессы с большим тепловым эффектом и процессы с малым тепловым эффектом. 4) Процессы могут быть гомогенные и гетерогенные. В первом случае все участники реакции находятся в одной фазе; во втором - одной из стадий процесса является переход через границу раздела фаз. 5) Процессы бывают каталитические и некаталитические. Совершенно очевидно, что каждая конкретный процесс обладает признаками разных классов. Например, процесс синтеза аммиака N2 (г) + 3 H2 (г) ↔ NH3 (г), ∆Н < 0 является простым, обратимым, экзотермическим, каталитическим (катализатор – металлическое железо), гомофазным, но гетерогенным, так как газообразные реагенты взаимодействуют между собой на поверхности твердого катализатора. Закономерности управления простым необратимым гомогенным процессом Характеристика модели: 1) Процесс простой – можно описать одним стехиометрическим уравнением аА + bВ → cС + dD, где С – целевой продукт; β = α, так как весь реагент превращается только в целевой продукт. 2) Процесс необратимый – αmax = 100%. Величина конверсии реагента изменяется во времени α = f (τ), стремясь к максимальной величине 100%, так как текущая концентрация реагента «С» уменьшается во времени, стремясь к нулю. 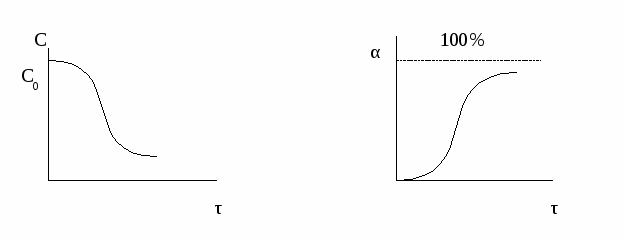 Чем меньше время достижения 100%-ной конверсии, тем эффективнее протекает реакция. То есть эффективность зависит от скорости химической реакции r .
На основе приведенной характеристики модели видно, что эффективность проведения простого необратимого гомогенного процесса определяется величиной скорости химической реакции, то есть единственным объектом управления является скорость химической реакции. Инструментами управления простым необратимым гомогенным процессом являются те технологические параметры, которые влияют на скорость химической реакции, то есть температура, давление, концентрация реагента, природа и концентрация катализатора. r = f (t, p, C, kat) 1) Влияние концентрации Зависимость скорости химической реакции от концентрации реагентов выражается законом действующих масс: где k – константа скорости, СА и СВ – текущие концентрации реагентов, nA и nB - порядок реакции по реагенту А и В соответственно. Анализ уравнения закона действующих масс приводит к выводу, что: 1) скорость химической реакции увеличивается при увеличении концентрации реагентов; 2) скорость реакции в большей степени зависит от концентрации того реагента, порядок по которому выше; 3) скорость химической реакции уменьшается во времени, так как уменьшаются текущие концентрации реагирующих веществ. 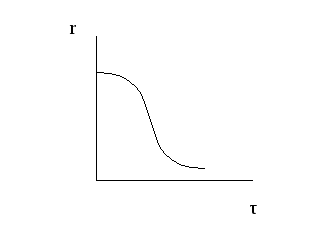 Из уравнения закона действующих масс вытекает возможность использования двух технологических приемов, позволяющих увеличить скорость химической реакции:
В избытке берется тот реагент: - порядок по которому выше; - стоимость которого ниже; - отделение которого от продуктов проще. Избыток не должен сильно разбавлять реакционную смесь, нарушать теплофизические свойства реакционной смеси и тепловое регулирование реактора. Кроме того, слишком большой избыток реагента приводит к лишним экономическим затратам. Величину избытка определяют экспериментально; обычно берут избыток реагента 1,7 – 1,8 по сравнению со стехиометрией. Вполне очевидно, что, чем выше скорость химической реакции, тем меньше время достижения одной и той же величины конверсии. 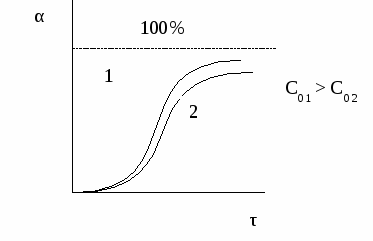 Поэтому при больших начальных, а, следовательно, и текущих концентрациях реагента время проведения химической реакции уменьшается. Анализ кривой α = f (τ) также показывает, что скорость изменения конверсии уменьшается во времени, и при значениях α, близких к 100%, изменение конверсии очень незначительно. Поэтому всегда существует некоторое оптимальное значение конверсии (обычно 80-90%), при достижении которого вести процесс дальше экономически нецелесообразно. Время достижения этой величины конверсии называют оптимальным временем реакции τопт..
Скорость реакции зависит от числа столкновений реагирующих веществ, а число столкновений зависит в свою очередь от числа молекул в единице объема, то есть от концентрации. С увеличением давления объем вещества уменьшается, и молекулы теснее располагаются в единице объема, то есть увеличение давление равнозначно увеличению концентрации. Особенно значителен этот эффект у газов. Жидкости и тем более твердые вещества малосжимаемы и эффект давления проявляется только в области сверхдавлений (1000 атм и выше). В случае газофазных реакций концентрации реагентов в кинетическом уравнении можно заменить их парциальными давлениями. Известно, что парциальные давления компонентов смеси пропорциональны их мольным долям. где р – общее давление, NA и NB – мольные доли компонентов А и В. Тогда То есть скорость газофазной реакции пропорциональна давлению в степени, равной порядку реакции. Изменение давления наиболее сильно влияет на реакции высокого порядка. Зависимость конверсии от давления при τ = const имеет следующий вид: 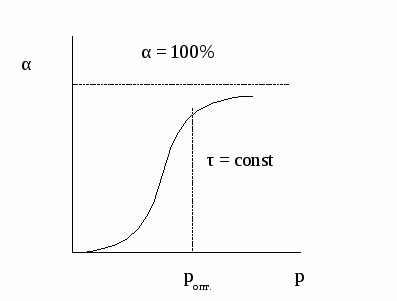 При увеличении давления конверсия увеличивается. Однако повышение давления имеет предел; выше некоторого оптимального значения давления ропт. увеличение его приводит к незначительному увеличению конверсии и выхода целевого продукта и поэтому становится нецелесообразным. На практике использование давления в качестве фактора управления химической реакцией ограничено большими затратами на его реализацию и возможностями техники высокого давления.
Скорость реакции зависит не только от числа столкновений реагирующих молекул, но и от их энергии. Появление активных молекул, обладающих повышенной реакционной способностью, является результатом различных физических воздействий на вещество. При активации реагентов тем или иным способом передачи энергии увеличивается константа скорости реакции. Способы активации могут быть разные: фотохимическая, плазмохимическая, ультразвуковая и др. Наиболее часто используется термоактивация, то есть увеличение скорости реакции под воздействием температуры. Скорость химической реакции возрастает при увеличении температуры на 100 в 2 - 4 раза. Это эмпирическое правило называется правилом Вант-Гоффа. Оно справедливо в области средних температур (до 4000С). Более точно влияние температуры можно описать уравнением Аррениуса: где Еа – энергия активации, Т – температура, R – газовая постоянная, k0 – предэкспоненциальный множитель, зависящий только от природы реагирующих частиц. Подставим это уравнение в уравнение закона действующих масс и увидим, что скорость химической реакции при увеличении температуры возрастает по экспоненте. Степень влияния температуры зависит от величины энергии активации. Реакции с большей энергией активации более чувствительны к изменению температуры, реакции с малой энергией активации нечувствительны. Каждая реакция значительно более чувствительна к изменению температуры при низких температурах, чем при высоких. Установим зависимость конверсии от температуры. Эта зависимость носит S-образный характер. 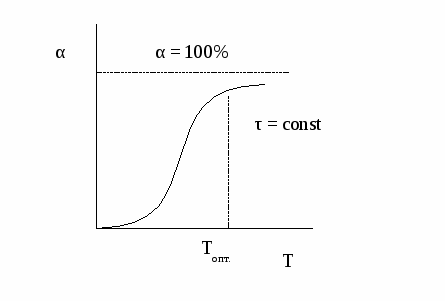 При низких температурах мала скорость процесса, поэтому невелик подъем кривой α = f (T). По мере повышения температуры скорость реакции увеличивается по экспоненте, что приводит к резкому подъему кривой. Но с увеличением степени превращения реагентов снижается их концентрация, а, следовательно, и скорость процесса, поэтому функциональная зависимость α = f (T) асимптотически приближается к единице. Анализ кривой на графике приводит к выводу, что в данном случае тоже существует некоторое оптимальное значение задаваемого параметра – температуры, выше которого вести процесс экономически нецелесообразно из-за незначительного увеличения конверсии при высоких энергетических затратах. Термический способ активации химической реакции очень часто используется в технологии (до 95% от общего числа промышленных синтезов). Недостатком этого способа является высокие энергетические затраты и низкая селективность (при повышении температуры ускоряются не только целевые реакции, но и побочные). Обобщая вышесказанное, можно сделать вывод, что в случае простого необратимого гомогенного процесса конверсия реагентов и выход целевого продукта изменяются синхронно и стремятся к 100% с увеличением времени нахождения реагентов в зоне реакции. Время достижения нужного значения конверсии можно сократить, увеличивая скорость химической реакции. Таким образом, эффективность такого процесса определяется только величиной скорости химической реакции. Для увеличения скорости реакции используют следующие технологические приемы:
Однако следует помнить, что в технологической практике иногда избегают излишнего повышения скорости реакции. Обычно это связано с трудностями быстрого теплоотвода в случае сильноэкзотермических реакций. В таких процессах используют малоконцентрированное сырье или даже разбавляют реакционную массу, например, введением растворителя или инертного газа. Лекция № 6 Закономерности управления простым необратимым гетерогенным процессом Характеристика модели: 1) Процесс простой – можно описать одним стехиометрическим уравнением а + bВ → cС + dD, где С – целевой продукт; β = α, так как весь реагент превращается только в целевой продукт. 2) Процесс необратимый – αmax = 100%. Поэтому, как и в рассмотренной ранее модели простого необратимого гомогенного процесса единственным объектом управления является скорость процесса. 3) Однако процесс гетерогенный – скорость процесса не всегда равна скорости химической реакции. Вполне очевидно, что любой химической реакции (т.е. акту разрушения одних связей и образования других) предшествует стадия диффузии, то есть движение молекул реагентов друг к другу. Эти две стадии являются последовательными, и общая скорость процесса равна скорости самой медленной стадии, которую называют лимитирующей. Лимитирующей может быть как химическая, так и диффузионная стадия. В гомогенном процессе движение молекул реагентов осуществляется внутри одной фазы, скорость диффузии достаточно легко увеличить. Поэтому в гомогенном процессе практически всегда лимитирующей является сама химическая реакция, и скорость процесса равна скорости химической реакции. Местом протекания реакции в этом случае является весь объем реактора.  В гетерогенном процессе молекулы реагентов находятся в разных фазах или, находясь в одной фазе, они эффективно контактируют лишь на поверхности твердого катализатора. В первом случае процесс будет гетерофазным и гетерогенным, во втором – гомофазным, но гетерогенным. В гетерогенном процессе стадии химического превращения предшествует диффузионная стадия переноса молекул реагента через границу раздела фаз. Место протекания реакции локализовано, это граница раздела фаз или более плотная фаза вблизи границы раздела фаз.  Поскольку перенос через границу раздела фаз обычно затруднен, диффузионная стадия в гетерогенном процессе очень часто является лимитирующей, то есть определяет скорость всего процесса в целом. В зависимости от природы лимитирующей стадии различают три области протекания гетерогенного процесса: кинетическую, диффузионную и переходную. Область протекания определяет выбор инструментов управления гетерогенным процессом.
Один и тот же процесс в зависимости от условий проведения может протекать в разных областях. Если изобразить на графике зависимость скорости процесса от гидродинамических факторов, то та область, где скорость сильно возрастает при увеличении ω, W, f, является диффузионной. При дальнейшем увеличении этих величин зависимость становится менее выраженной – это переходная область. В кинетической области гидродинамические факторы перестают оказывать влияние на скорость процесса. Увеличение скорости в этой области требует использования кинетических факторов управления процессом (t, p, C, kat). Однако и здесь постепенно степень влияния выбранных инструментов управления снижается, процесс переходит опять в диффузионную область. 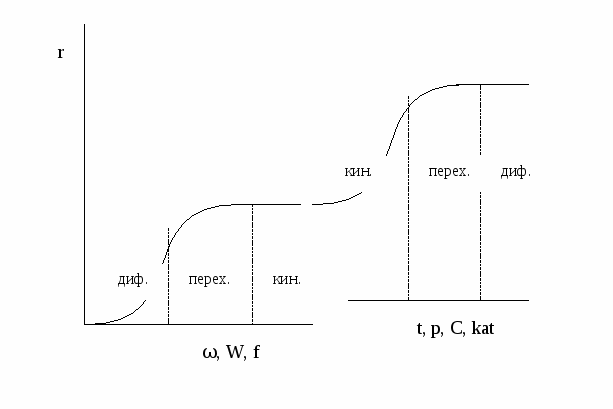 Методы интенсификации гетерогенного процесса, протекающего в диффузионной области Если гетерогенный процесс протекает в кинетической области, его скорость определяется скоростью химической реакции. Управлять таким процессом означает регулировать скорость химической реакции с помощью кинетических факторов (t, p, C, kat и др.). Если процесс протекает в диффузионной области, объектом управления становится скорость массопередачи; и появляются новые инструменты управления, такие как скорость перемешивания, поверхность контакта фаз и др. (гидродинамические факторы). Концентрация реагентов и температура оказывают уже меньшее влияние на процесс. Анализ влияния различных факторов на интенсивность процесса должен быть основан на законах массопередачи. Основное уравнение массопередачи отражает зависимость скорости массопередачи от движущей силы процесса, в качестве которой выступает разность концентраций вещества в разных точках системы. R = Kм f ∆C , где Км – коэффициент массопередачи, f – удельная поверхность контакта фаз, ∆C – движущая сила процесса. Движущей силой любого массообменного процесса является разность (градиент) концентраций. Если в разных точках объема фазы концентрация вещества различна, молекулы вещества начнут самопроизвольно перемещаться в направлении, в котором концентрация его меньше. 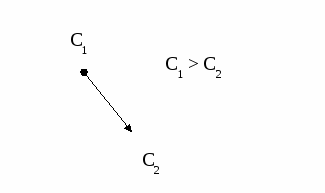 Движущая сила процесса ∆C = С1 – С2. Скорость процесса тем больше, чем больше разность концентраций. Пределом протекания процесса является равенство концентраций во всем объеме фазы С1 = С2. В этот момент ∆C = 0 и скорость процесса массопереноса равна нулю. Таким образом, движущая сила процесса массопередачи и скорость уменьшаются во времени.  τопт. В случае гетерогенного процесса массоперенос осуществляется не только внутри фазы, но и через границу раздела фаз. Рассмотрим последовательность и предел протекания этих процессов, используя так называемую двухпленочную модель массопереноса. 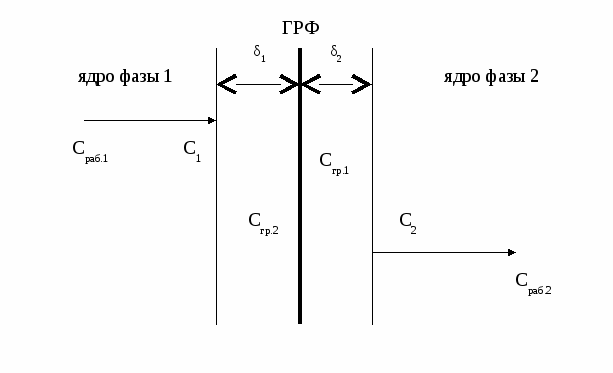 Согласно этой модели, в каждой фазе можно выделить ядро фазы, в котором перенос вещества осуществляется как молекулярной, так и конвективной диффузией, и пограничные слои толщиной δ1 и δ2, расположенные у границы раздела фаз. В этих слоях, независимо от гидродинамики внешнего потока, течение будет ламинарным, массоперенос происходит только за счет молекулярной диффузии. Очевидно, что медленной стадией является перенос вещества через пограничные слои, так как скорость молекулярной диффузии намного ниже скорости конвективной диффузии. Пусть вещество переходит А из фазы 1 в фазу 2. Выделим основные стадии процесса. 1 стадия – перенос из ядра фазы 1 к пограничному слою этой фазы. ∆С1 = Сраб.1 – С1 При правильной организации конвективного переноса внутри фазы концентрация выравнивается очень быстро. Сраб.1 = С1. 2 стадия – перенос через пограничный слой 1 фазы (медленная стадия). ∆С2 = С1 – Сгр.1 3 стадия – перенос через границу раздела фаз. Процесс перехода вещества через границу раздела фаз возникает самопроизвольно и протекает до тех пор, пока между фазами при данных внешних условиях (t и р) не установится подвижное фазовое равновесие, при котором скорость перехода вещества А из первой фазы во вторую будет равна скорости перехода этого вещества из фазы 2 в фазу 1. Связь между равновесными концентрациями вещества А в первой и второй фазе зависит от вида двухфазной системы. Например, для системы «г-ж» эта связь определяется законом Генри, для систем «г-т» и «ж-т» - изотермами адсорбции и т.д. В общем случае можно записать 4 стадия – перенос через пограничный слой 2 фазы (медленная стадия). ∆С3 = Сгр.2 – С2 5 стадия – перенос от пограничного слоя в ядро фазы 2. ∆С4 = С2 – Сраб.2 Таким образом, мы получили систему взаимосвязанных процессов с включенной стадией подвижного равновесия. Сраб.1 → С1 → Сгр.1 ↔ Сгр.2 → С2 → Сраб.2 Когда начинается процесс массопередачи? При организации конвективного переноса в ядре фазы 1 движущей силой процесса является разница концентраций вещества А в ядре фазы 1 и на границе раздела фаз. ∆С = Сраб.1 – Сгр.1 В момент соприкосновения фаз Сгр.1 =0, ∆С –max. Когда процесс массопередачи закончится? Когда Сраб.1 станет равной Сгр.1. Это равенство может быть достигнуто только при установлении динамического равновесия, когда Сгр.1 и Сгр.2 достигают своих равновесных значений и не изменяются во времени. А это, в свою очередь, возможно, когда Сраб.2 = С2, а С2 = Сгр.2. То есть, в конечном счете, величина движущей силы процесса массопередачи равна разности между рабочей и равновесной концентрацией переходящего вещества в передающей фазе. Как можно увеличить движущую силу, а, следовательно, и скорость процесса?
Для этого нужно, изменяя внешние условия, сместить равновесие вправо. Выбор способа смещения равновесия зависит от конкретного типа равновесной системы. Например, для системы «г-ж» сместить равновесие процесса растворения газа в жидкости можно, увеличивая давление и уменьшая температуру. Для систем «г-т» и «ж-т» необходимо найти условия смещения равновесия процесса адсорбции. Обычно для этого тоже понижают температуру и повышают давление. Для систем «ж-ж», а также «т-ж» (когда твердое вещество растворяется в жидкости) обычно повышают температуру. Принципы смещения равновесия в процессах массопереноса те же, что для химических равновесий. Если процесс протекает с выделением тепла (растворение газа в жидкости, адсорбция) смещать равновесие вправо будет понижение температуры; в случае эндотермического процесса (растворение жидкости и твердого тела) – повышение температуры. В химических гетерогенных процессах мощным фактором, смещающим фазовое равновесие, является химическая реакция. Если скорость химической реакции намного больше скорости массопередачи (то есть процесс протекает в диффузионной области), движущая сила процесса равна разнице между рабочей концентрацией вещества в передающей фазе и концентрацией его в зоне реакции. ∆С = Сраб.1 – Сз.р., так как фазовое равновесие практически не устанавливается до тех пор, пока осуществляется химическая реакция. В этом случае скорость процесса можно увеличить только путем повышения Сраб.1. Если скорость химической реакции намного меньше скорости массопередачи (процесс протекает в кинетической области), скорость можно увеличить, используя кинетические факторы. Скорость процесса в этом случае, как правило, и так высока. В переходной области, при соизмеримых скоростях процесса массопередачи и химической реакции, изменяя технологические параметры, следует ожидать, что это окажет влияние и на скорость химической реакции, и на состояние фазового равновесия. Например, А(т) ↔ А(раств.) А(раств.) + В → С Повышение температуры в этом случае приводит к повышению константы скорости химической реакции и к увеличению концентрации растворенного вещества А в результате смещения фазового равновесия. Скорость процесса однозначно будет возрастать. А(г) ↔ А(раств.) А(раств.) + В → С Во втором случае повышение температуры увеличит константу скорости химической реакции, но уменьшит концентрацию растворенного вещества А. Предсказать, как изменится скорость процесса, трудно. Другим инструментом управления гетерогенным процессом, протекающим в диффузионной области, является коэффициент массопередачи Км. Коэффициент массопередачи характеризует количество вещества, переданного из фазы в фазу через единицу поверхности в единицу времени при движущей силе, равной единице. Коэффициент массопередачи тем выше, чем больше коэффициент молекулярной диффузии диффундирующего вещества в данной фазе, чем интенсивнее организована конвективная диффузия и чем меньше толщина пограничного слоя δ. Для повышения коэффициента конвективной диффузии и уменьшения толщины пограничного слоя используют различные методы турбулизации внешнего потока (ядра фазы): повышение скорости движения потока, интенсификацию перемешивания, вибрацию поверхности или увеличение ее шероховатости в случае систем «ж - т» или «г – т», импульсный ввод энергии, воздействие электрических и магнитных полей и др. Наиболее эффективным способом интенсификации гетерогенных процессов, протекающих в диффузионной области, является увеличение поверхности раздела фаз. В основное уравнение массопередачи входит не действительная поверхность контакта фаз, а условная величина, называемая удельной поверхностью контакта фаз и имеющая размерность м2/м3. где F – поверхность контакта фаз, Vр – рабочий объем реактора. Чем больше f, тем больше скорость массопередачи. Для увеличения удельной поверхности контакта фаз одну из фаз (наиболее плотную) измельчают и распределяют в объеме другой фазы. В случае систем «г - т» и «ж – т» измельчают твердую фазу и распределяют ее в объеме газа или жидкости, то есть работают с взвешенными твердыми частицами или с суспензиями. В системе «ж – ж» одна жидкость диспергируется в другой, получают эмульсии. Для систем «г – ж» применяют два режима: - барботажный – диспергирование газа в жидкости; - скрубберный – диспергирование жидкости в газе. От способа создания поверхности контакта фаз зависит конструкция реактора. Не следует стремиться к максимально возможной величине межфазной поверхности. Она должна быть оптимальной, так как слишком сильное диспергирование одной из фаз приводит, обычно к уносу ее из аппарата и другим нежелательным эффектам. Например, пылевидное состояние твердой фазы увеличивает ее гидравлическое сопротивление и приводит к значительным потерям в результате уноса при больших скоростях потока газа или жидкости; чрезмерное увеличение кратности вспенивания при организации пенного режима снижает эффективность использования объема реактора и т.д. Следует отметить, что наличие высокоразвитой поверхности не гарантирует высокой скорости процесса. Эта поверхность должна обладать работоспособностью. Накопление продуктов реакции на поверхности контакта фаз часто является причиной уменьшения скорости процесса, а иногда и полного его ингибирования, то есть лимитирующей стадией может стать стадия диффузионного отвода продуктов реакции с поверхности. В таком случае для поддержания работоспособности поверхности на протяжении всего процесса необходима организация ее постоянного обновления. Процессы массопередачи в гомогенных средах Вполне очевидно, что в гомогенном процессе химической стадии тоже предшествует стадия диффузии, причем молекулы реагентов должны равномерно распределиться по всему объему реактора. В жидкофазных процессах диффузию интенсифицируют, используя различные способы перемешивания. Различают два вида смешения, обеспечивающие различную степень гомогенизации среды. Состояние жидкости, при котором молекулы совершенно свободно перемещаются по объему реактора, называется несегрегированным. При таком перемешивании происходит равномерное распределение веществ по объему реактора; скорость перемешивания и другие гидродинамические факторы не оказывают влияния на скорость процесса. В сегрегированном состоянии жидкость представляет собой совокупность большого числа глобул, каждая из которых содержит порядка 1012 молекул. Считают, что внешняя оболочка глобулы химически инертна, ее единственное назначение – сохранение глобулы. Сегрегированное состояние жидкости способствует возникновению локальных высоких концентраций реагентов, особенно в местах их подачи. Реальные жидкофазные системы чаще всего являются сегрегированными. Сегрегация нарушает нормальное распределение реагентов и может влиять на селективность сложных реакций. Например, А + В → С (целевой продукт) С + B → D Если молекула целевого продукта окажется в одной глобуле с молекулами реагента А, селективность будет высокая, если с молекулами реагента В – низкая. |
