Лекции ОХТ для заочников. Лекция 1 Предмет и содержание курса охт
 Скачать 1.88 Mb. Скачать 1.88 Mb.
|
|
Лекция № 8 Закономерности управления сложными процессами Сложными называются процессы, в которых наряду с реакцией, приводящей к образованию целевого продукта (целевой реакцией), протекают побочные реакции. Характеристика модели:
Объекты управления: Наряду со скоростью процесса, положением равновесия (если реакция обратима) объектом управления в сложных процессах становится селективность. r = f (С, р, t, kat) или r = f (W, ω, f) в зависимости от лимитирующей стадии α* = f (C, p, t) S = f (C, p, t, kat) Инструменты управления: кинетические параметры. Рассмотрим, как влияют основные технологические параметры на скорость и селективность сложного необратимого гомогенного процесса. Пусть протекают две параллельные реакции, в которых расходуется реагент А. Кинетические кривые для сложно-параллельного процесса имеют вид, представленный на рисунке. Концентрация исходного реагента А уменьшается во времени, а концентрация продуктов C и D увеличивается, причем скорость увеличения зависит от порядка реакции. При n1 > n2 быстрее увеличивается концентрация целевого продукта. 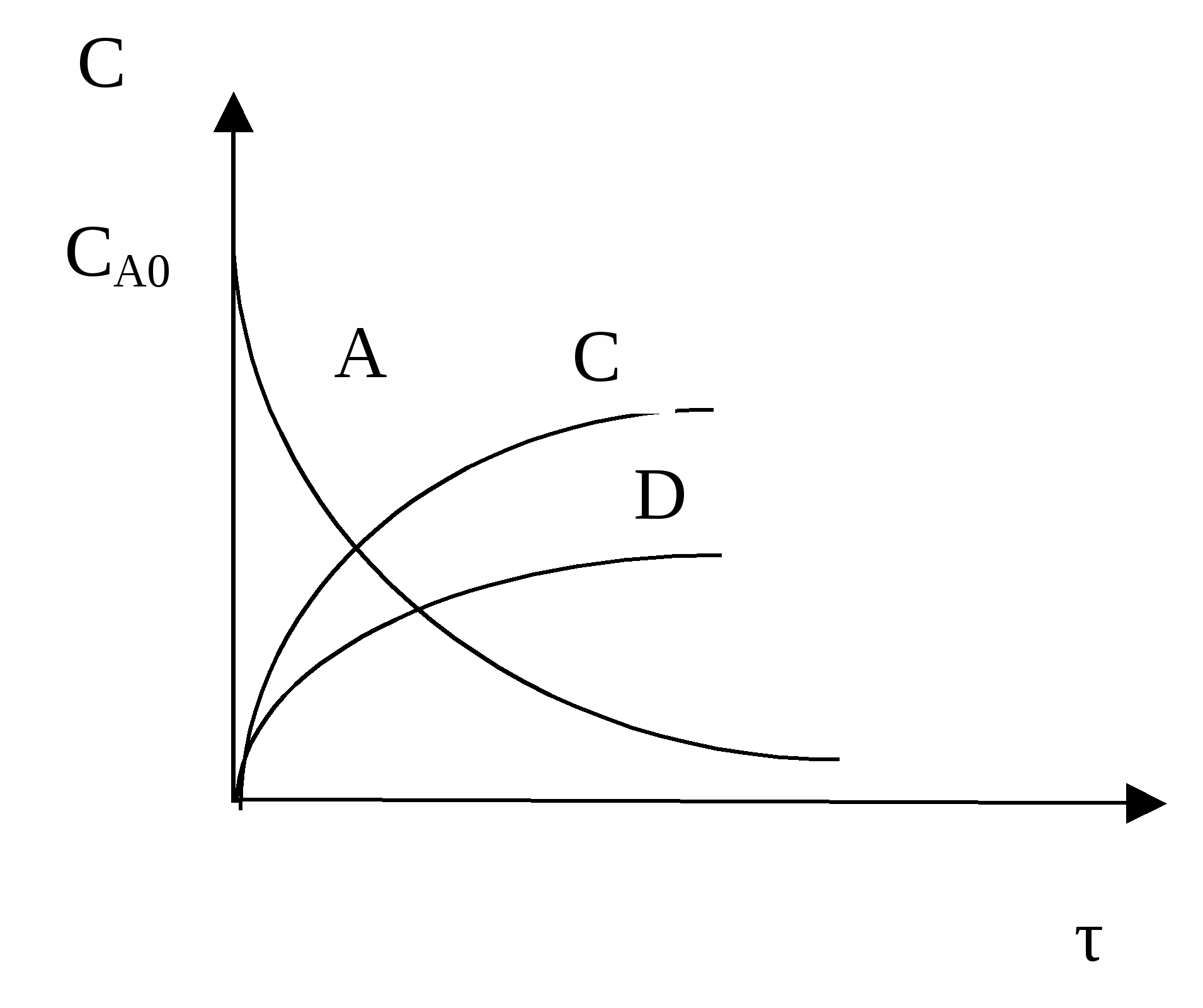 Для анализа воспользуемся понятием дифференциальной селективности, под которой понимают отношение скорости целевой реакции (скорости образования целевого продукта) к общей скорости процесса (скорости расходования реагента). 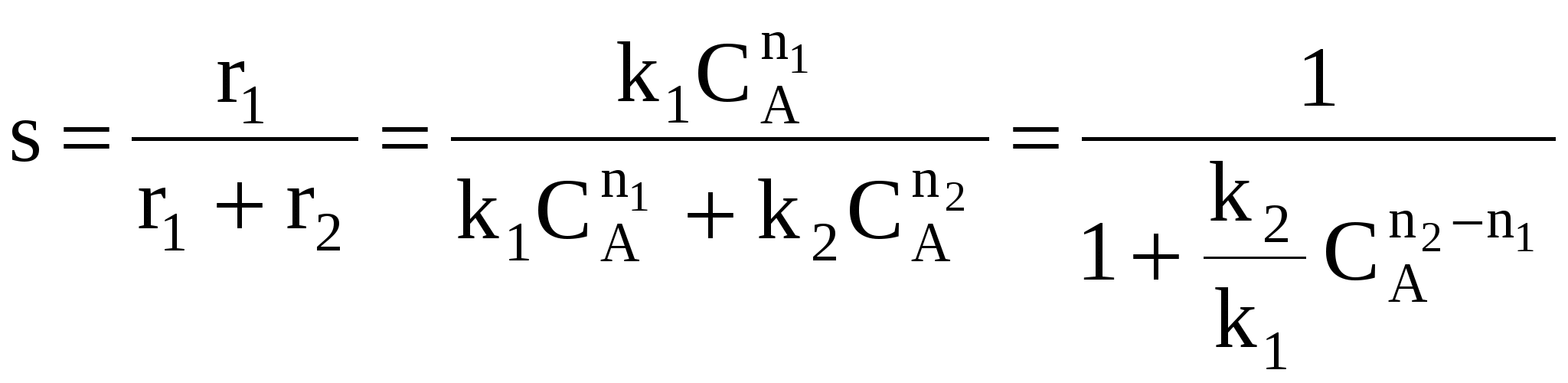 При условии, что 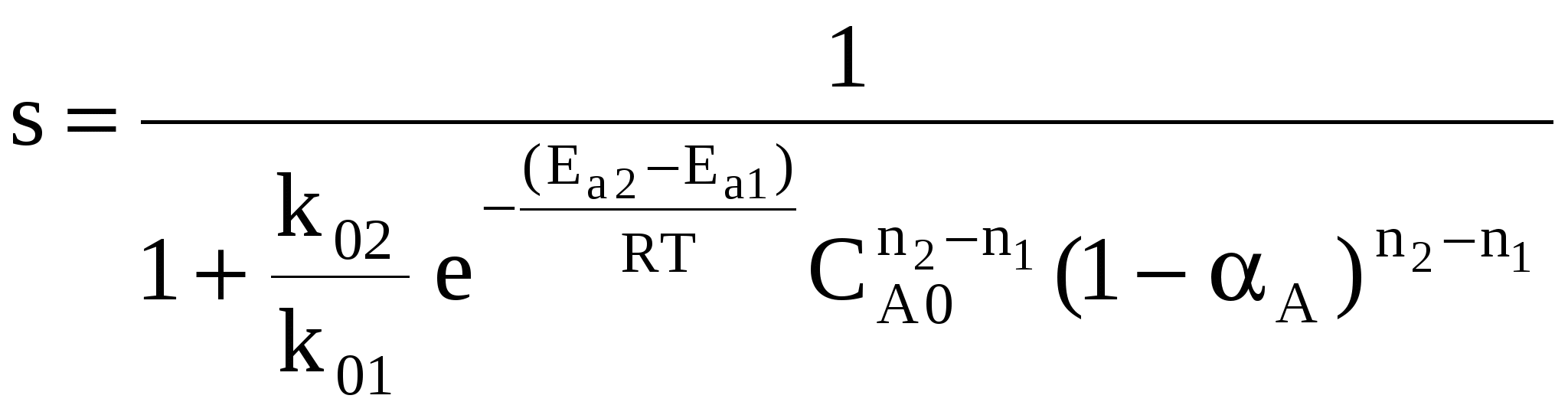 Используя полученную формулу, проведем анализ влияния начальной концентрация реагента, степени его превращения, давления и температуры на селективность процесса. Характер влияния концентрации, давления и конверсии зависит от соотношения порядков целевой и побочной реакции. Если порядки равны, начальная концентрация, давление и конверсия не влияют на селективность процесса. Если порядок целевой реакции выше, селективность увеличивается при повышении концентрации реагента и давления и уменьшается при достижении высоких конверсий. Если порядок целевой реакции ниже, чем порядок побочной реакции, при увеличении концентрации реагента и давления селективность должна понижаться, а увеличение времени реакции (конверсии реагента) приводит к повышению селективности. При СА0 ↑ rхим. р. ↑ если n1 = n2 s = const если n1 > n2 s↑ если n1 < n2 s↓ При αА↑ rхим. р.↓ если n1 = n2 s = const если n1 > n2 s↓ если n1 < n2 s↑ Для газофазных реакций 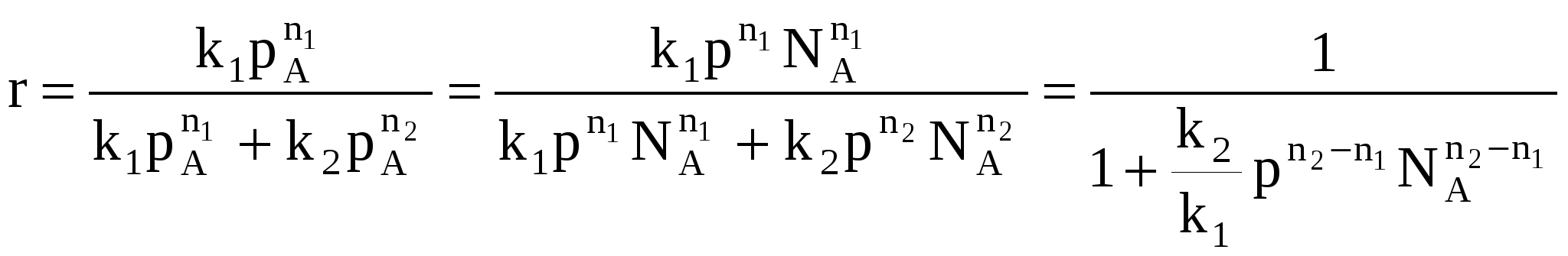 При р↑ rхим. р. ↑ если n1 = n2 s = const если n1 > n2 s↑ если n1 < n2 s↓ Влияние температуры зависит от соотношения энергий активации целевой и побочной реакции. При t ↑ rхим. р. ↑ если Еа1 = Еа2 s = const если Еа1 > Еа2 s↑ если Еа1 < Еа2 s↓ Рассмотрим другой тип сложных процессов – сложно-последовательный необратимый гомогенный процесс (консекутивный). С течением времени концентрация реагента А снижается. Концентрация промежуточного продукта С вначале увеличивается, достигает своего максимального значения, затем убывает. Концентрация продукта D увеличивается по мере протекания реакции. Величина максимальной концентрации продукта С зависит от соотношения скоростей каждой из последовательных стадий. 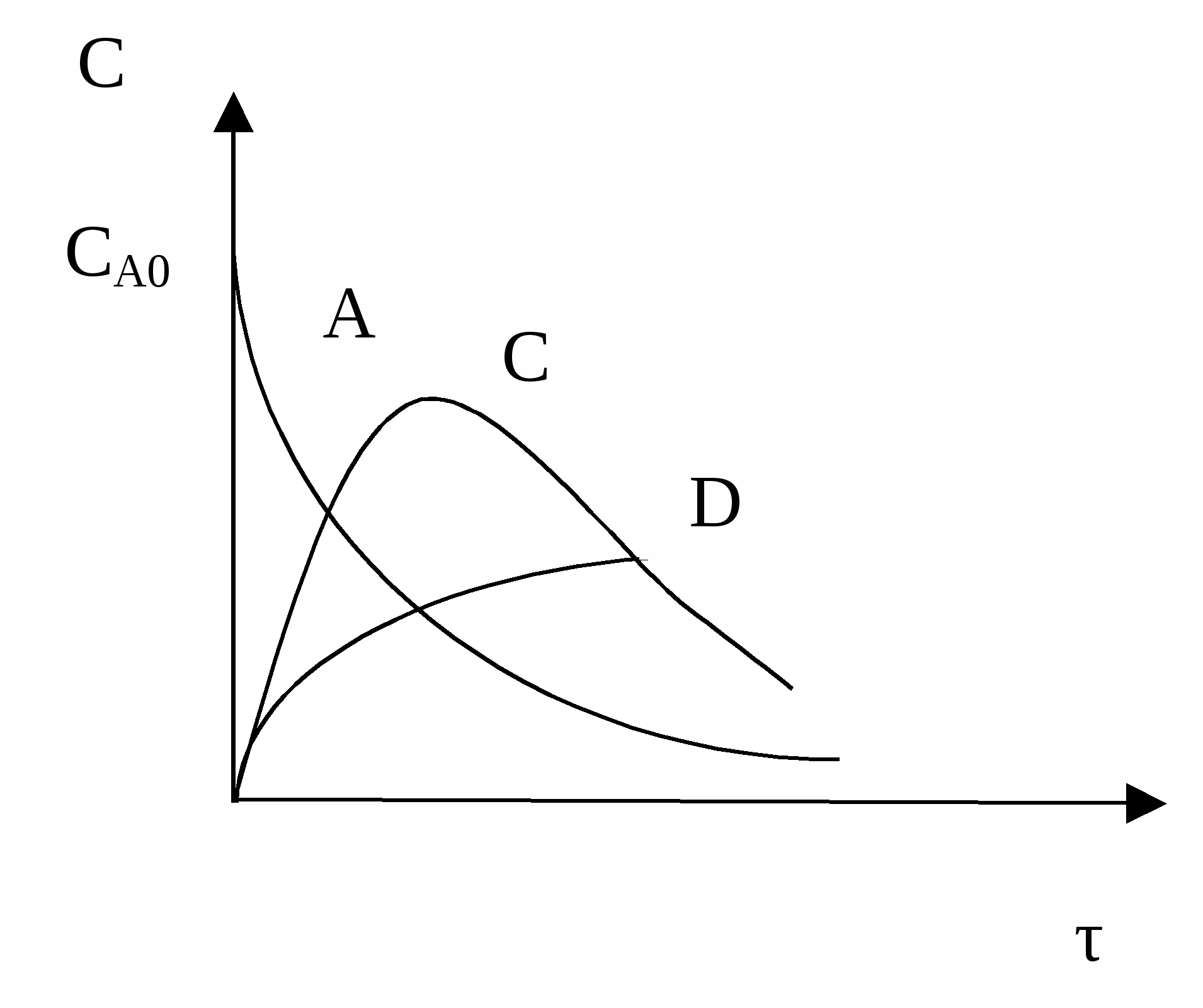 Если целевым продуктом является продукт С, то селективность процесса равна 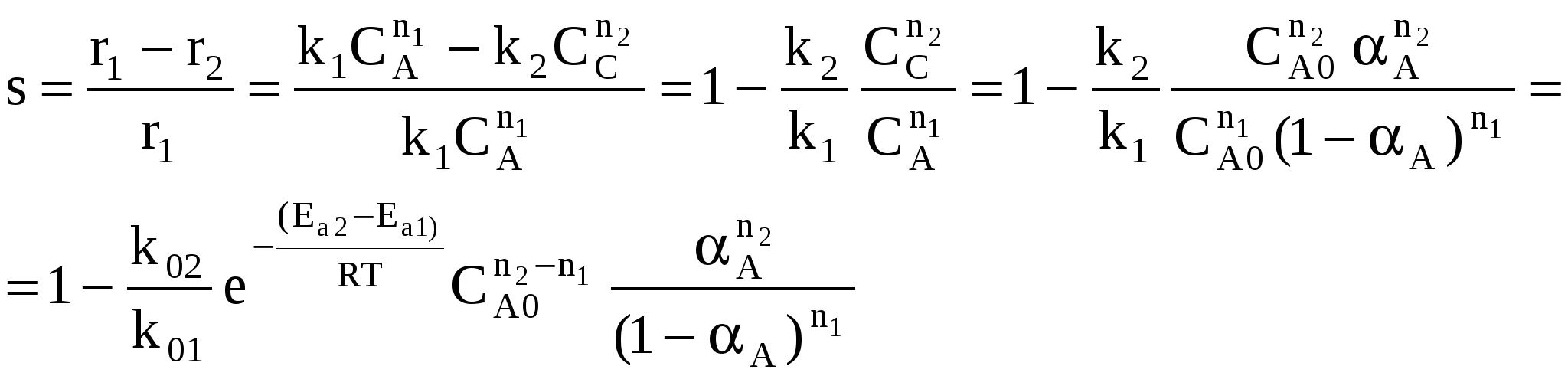 При увеличении начальной концентрации реагента СА0 ↑ rхим. р. ↑ если n1 = n2 s = const если n1 > n2 s↑ если n1 < n2 s↓ При увеличении степени превращения реагента αА↑ rхим. р , s↓ При увеличении температуры t ↑ rхим. р. ↑ если Еа1 = Еа2 s = const если Еа1 > Еа2 s↑ если Еа1 < Еа2 s↓ На селективность газофазных процессов будет оказывать влияние давление. 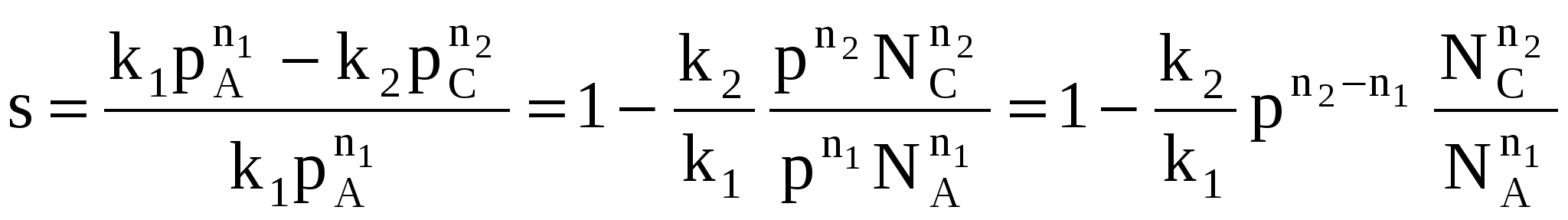 При р↑ rхим. р. ↑ если n1 = n2 s = const если n1 > n2 s↑ если n1 < n2 s↓ Анализ показал, что в некоторых случаях изменение технологического параметра может привести к увеличению скорости процесса, а селективность при этом уменьшится или к увеличению селективности при снижении скорости процесса. Выбор оптимального значения этого технологического параметра производится путем технологических и экономических расчетов. Очень часто предпочитают получить высокую селективность, особенно если сырье имеет высокую стоимость, высока стоимость отделения и очистки целевого продукта от побочных продуктов, а скорость процесса невелика. Обобщая вышесказанное, можно сделать следующие выводы:
Лекция № 9 Закономерности управления каталитическими процессами Катализ – это явление изменения скорости химической реакции под воздействием малых количеств веществ – катализаторов, которые, участвуя в процессе, восстанавливают свой состав в конце каталитического цикла. Катализ является наиболее эффективным и рациональным средством регулирования скорости химической реакции. Более 80% промышленных процессов являются каталитическими. Катализатор может увеличивать скорость химической реакции (положительный катализ) или уменьшать ее (отрицательный катализ). В последнем случае катализатор называют ингибитором. Торможение (ингибирование) нежелательных процессов играет в химической технологии не менее важную роль, чем каталитическое ускорение реакции. Ускоряющее действие катализаторов принципиально отличается от действия других факторов, интенсифицирующих процесс. Концентрация реагирующих веществ и давление увеличивают общее число столкновений молекул, температура, различные виды облучения увеличивают энергию сталкивающихся молекул. Катализатор снижает энергию активации процесса в результате изменения реакционного пути. Пусть протекает реакция аА + вВ → сС + dD. Чтобы вещества А и В образовали продукты С и D, они должны преодолеть некоторый энергетический барьер. На это затрачивается энергия активации Еа. Молекулы, обладающие этой избыточной энергией. Образуют неустойчивую группировку, называемую активированным комплексом АВ#. Скорость реакции непосредственно зависит от значения энергии активации; если она мала, то в единицу времени большее количество молекул преодолеют энергетический барьер, и скорость реакции будет высокой. Если энергия активации велика, то реакция идет медленно. Катализатор тем или иным способом изменяет реакционный путь. Например, он взаимодействует с молекулой А, образуя некоторый активированный комплекс АК#. Этот комплекс взаимодействует с молекулой вещества В, образуя новое неустойчивое соединение АВК#, которое, разрушаясь, дает продукты С и D и катализатор в первоначальном виде. А + К → АК# АК# + В → АВК# АВК# → С + D + К 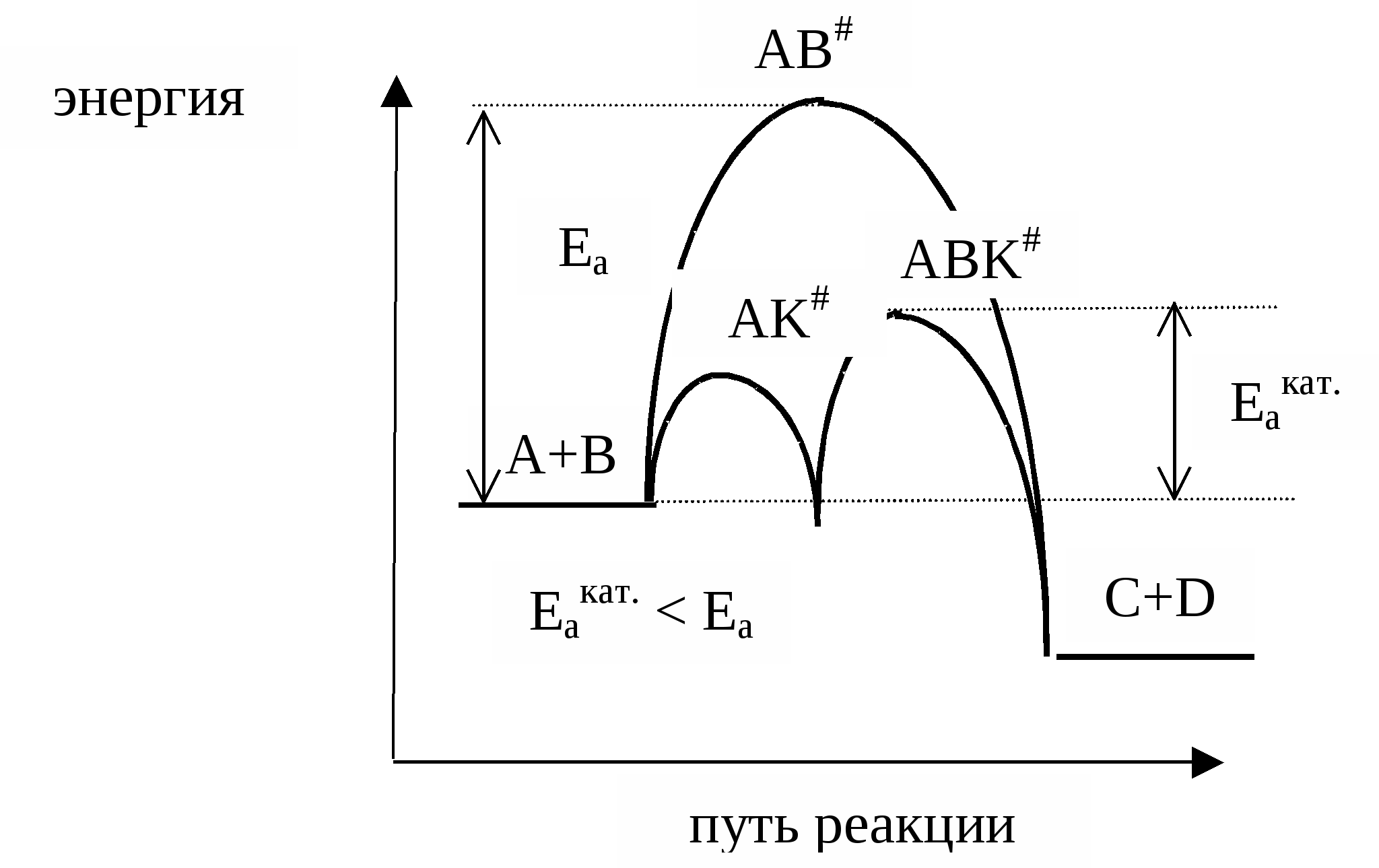 Таким образом, процесс разбивается на ряд стадий, каждая из которых требует преодоления меньшего энергетического барьера, чем в случае некаталитической реакции. Мерой ускоряющего действия катализатора является величина относительной активности катализатора. Относительная активность рассчитывается как отношение константы скорости каталитической реакции к константе скорости некаталитической реакции. 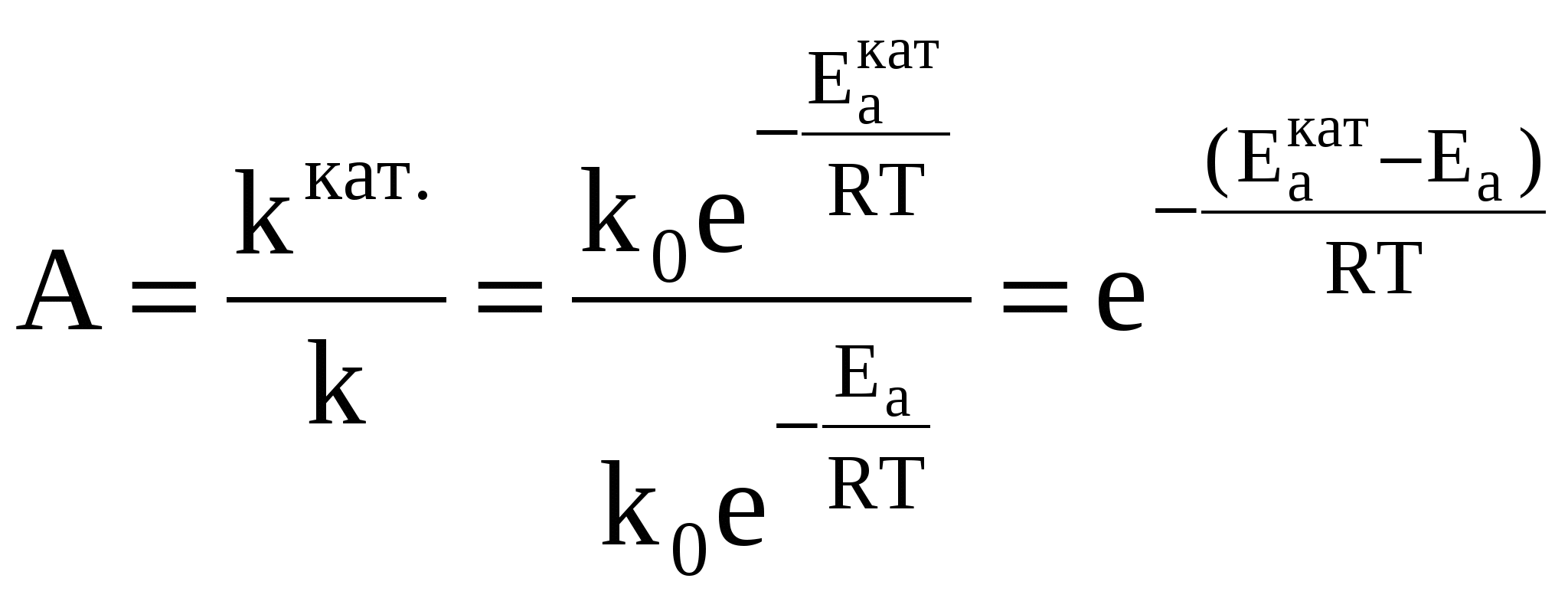 Видно, что даже незначительное уменьшение энергии активации может увеличить скорость реакции в десятки, сотни и более раз. В качестве примера можно привести реакцию окисления сернистого ангидрида, осуществляемую при температуре 693 К в присутствии катализатора V2O5. Еа =420000 Дж/моль, Еакат. = 268000 дж/моль Скорость окисления SO2 в присутствии катализатора V2O5 возрастает в 3 . 1011 раз. Даже, если реакция из-за своей малой скорости практически совсем не протекает. Использование подходящего катализатора приводит к полному и быстрому химическому превращению. Однако следует помнить, что:
В зависимости от фазового состояния катализатора и реагентов различают катализ гомогенный и гетерогенный. Оценим преимущества и недостатки этих двух видов катализа.
Основным недостатком гомогенного катализа является сложность его выделения из реакционной среды. Часть катализатора, а иногда и весь катализатор теряется безвозвратно. Это увеличивает экономические затраты на производство, ухудшает качество продукта, увеличивает количество сточных вод и отходов. Основными проблемами при использовании гетерогенного катализатора является необходимость решения вопросов, связанных с интенсификацией массо- и теплообменных процессов. Методы управления гомогенно-каталитическими процессами мало чем отличаются от приемов интенсификации гомогенных некаталитических процессов, хотя участие катализатора в процессе вносит свою специфику. Например, известно, что согласно закону действующих масс, скорость реакции должна возрастать пропорционально концентрации реагирующих веществ. Однако в гомогенно-каталитическом процессе А → С возможен случай, когда скорость реакции, увеличиваясь по мере увеличения концентрации реагента, достигает некоторой величины и перестает изменяться. Причиной этого является то, что общая скорость процесса 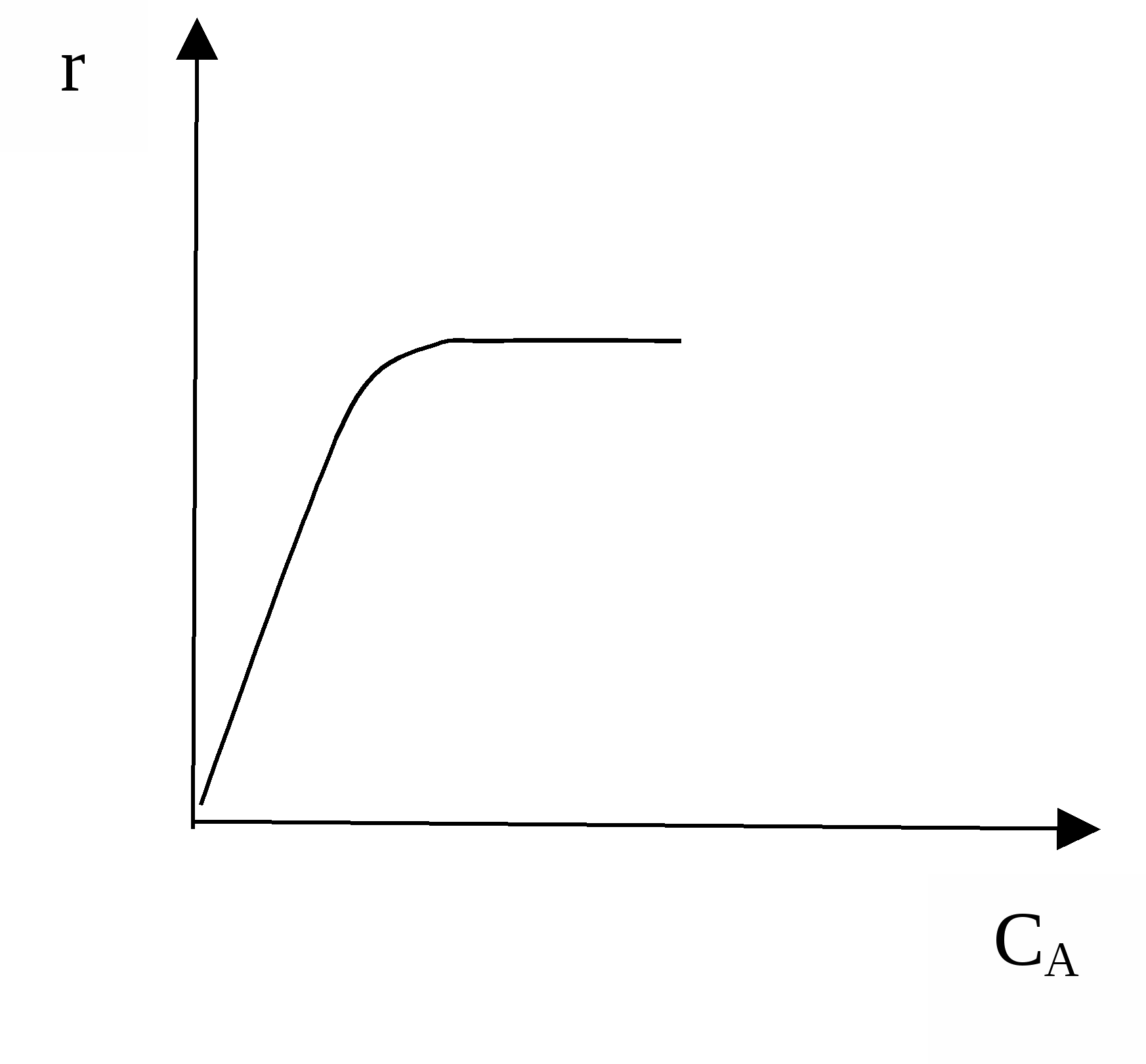 лимитируется стадией разрушения промежуточного комплекса катализатора с реагентом А. А + К → АК# АК# → C + К Скорость разрушения этого комплекса зависит от его концентрации, которая, в свою очередь, зависит от концентрации катализатора. Если концентрация катализатора мала, он весь связан в комплекс, и увеличение концентрации реагента А бесполезно. Таким образом, следует помнить, что катализатор активно участвует в процессе; его концентрация может оказаться эффективным инструментом управления процессом. Основные стадии и кинетические особенности гетерогенно-каталитических процессов 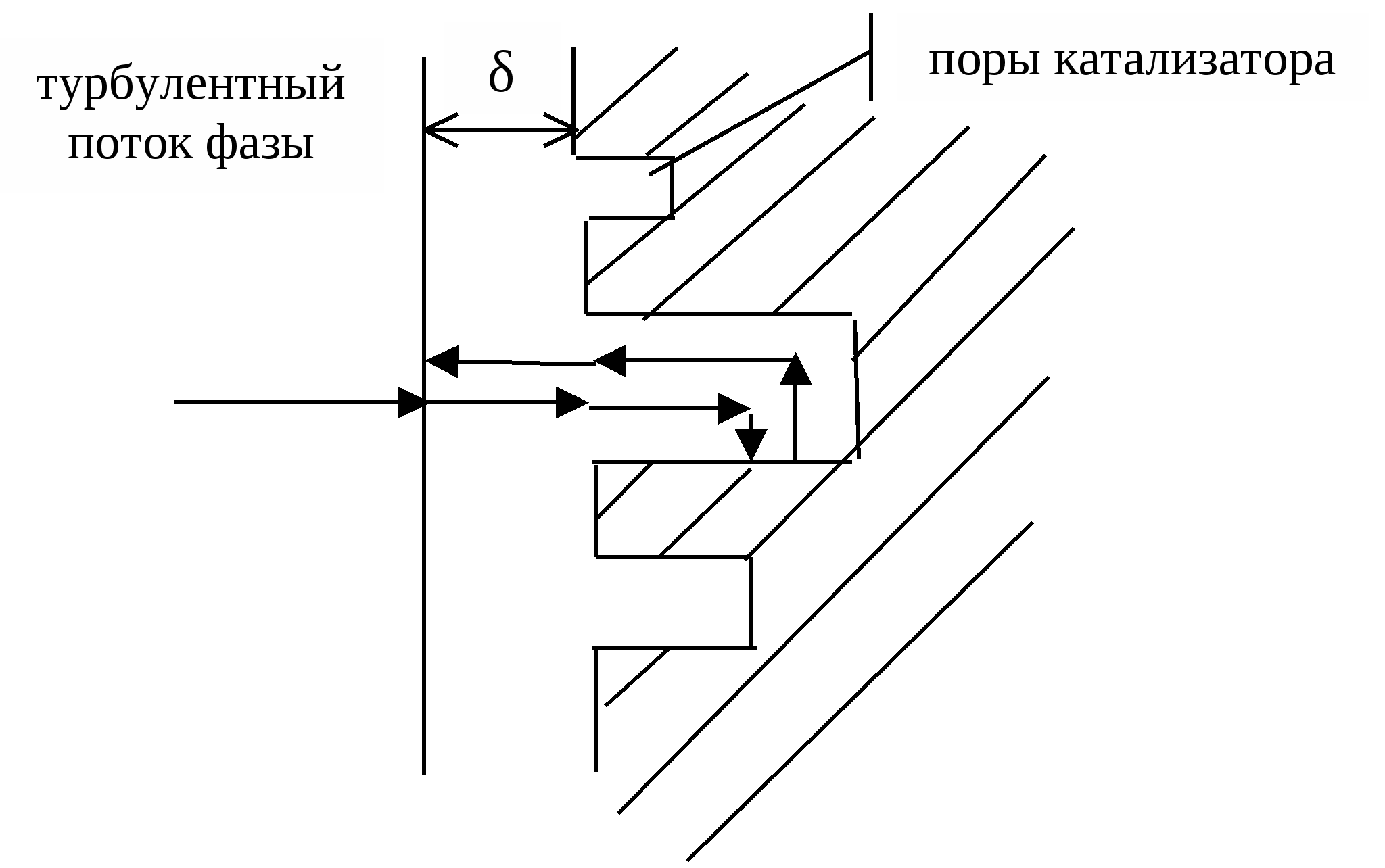 В общем случае процесс гетерогенного катализа складывается из следующих стадий: 1 – внешняя диффузия молекул реагентов из ядра потока к поверхности катализатора через пограничный слой δ; 2 – внутренняя диффузия молекул в порах катализатора; 3 – активированная адсорбция молекул на поверхности катализатора с образованием поверхностных непрочных химических соединений – активированных комплексов; 4 – перегруппировка атомов с образованием поверхностных комплексов «продукт-катализатор» (химическая реакция); 5 – десорбция молекул продуктов с поверхности; 6 – внутренняя диффузия молекул продуктов в порах катализатора; 7 – внешняя диффузия молекул продуктов от поверхности катализатора в ядро потока через пограничный слой. Стадии 3, 4, 5 являются химическими, 1, 2, 6, 7 – массообменные (диффузионные). В зависимости от того, какая из этих стадий является лимитирующей, различают три области протекания гетерогенно-каталитического процесса: внешнедиффузионную, внутридиффузионную и кинетическую. Область протекания определяется экспериментально. 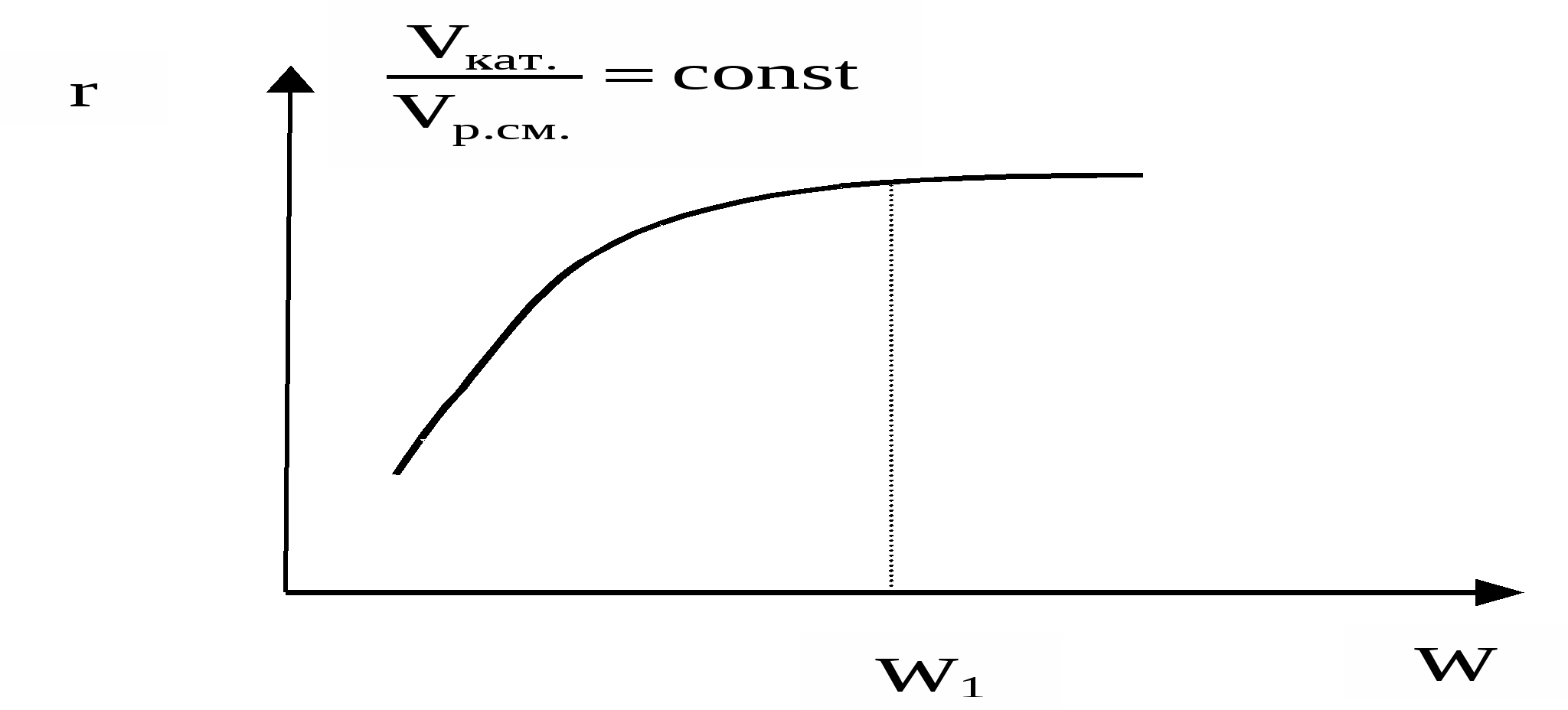 Если скорость процесса зависит от линейной скорости потока W при постоянном отношении объема катализатора и объема реакционной смеси, процесс протекает во внешнедиффузионной области, то есть лимитируется стадией внешней диффузии веществ через пограничный слой. Эта область является самой неблагоприятной для проведения процесса:
Для интенсификации процесса, протекающего во внешнедиффузионной области, используются такие инструменты управления, которые увеличивают скорость массопередачи в пограничном слое: повышение линейной скорости подачи реагентов, увеличение удельной поверхности контакта фаз (например, использование движущегося и «кипящего» слоя катализатора и др.). В случае внутридиффузионной области лимитирующей является стадия движения молекул внутри пор. Это движение зависит от размера пор. В широких порах перенос вещества описывается законами молекулярной диффузии. В узких порах увеличивается вероятность ударов молекул о стенки канала, скорость движения зависит от диаметра этого канала, то есть описывается другими законами. Во внутридиффузионной области химическая реакция и диффузия протекают одновременно, поэтому эту область можно назвать переходной между кинетической и внешнедиффузионной; на скорость процесса оказывают влияние как кинетические, так и диффузионные факторы. В зависимости от соотношения скоростей внутренней диффузии и химической реакции внутренняя поверхность пор может использоваться полностью (если скорость химической реакции меньше) или частично (если протекает очень быстрая реакция). Внутридиффузионное торможение можно снять путем увеличения диаметра пор и уменьшения их длины. Кинетическая область является наиболее благоприятной для ведения гетерогенно-каталитического процесса: работает вся поверхность катализатора, выделяющееся тепло легко отводится, достигается высокая селективность процесса. Скорость процесса равна скорости химической реакции, изменение которой подчиняется в этом случае законам хемосорбции. Для ускорения процесса, протекающего в кинетической области, используют кинетические факторы. Требования к гетерогенным катализаторам:
Эффективность применения того или иного вещества в качестве катализатора определяется всей совокупностью его химических и физических свойств. Химические свойства катализатора Основными характеристиками катализатора, зависящими от его химического состава и свойств. Является каталитическая активвность и селективность. Каталитическая активность измеряется скоростью превращения реагента, отнесенной к единице объема, поверхности или массы катализатора. Активность катализатора изменяется в процессе работы, и характер этого изменения зависит от природы катализатора и условий его работы. Кривая изменения активности во времени показана на рисунке. 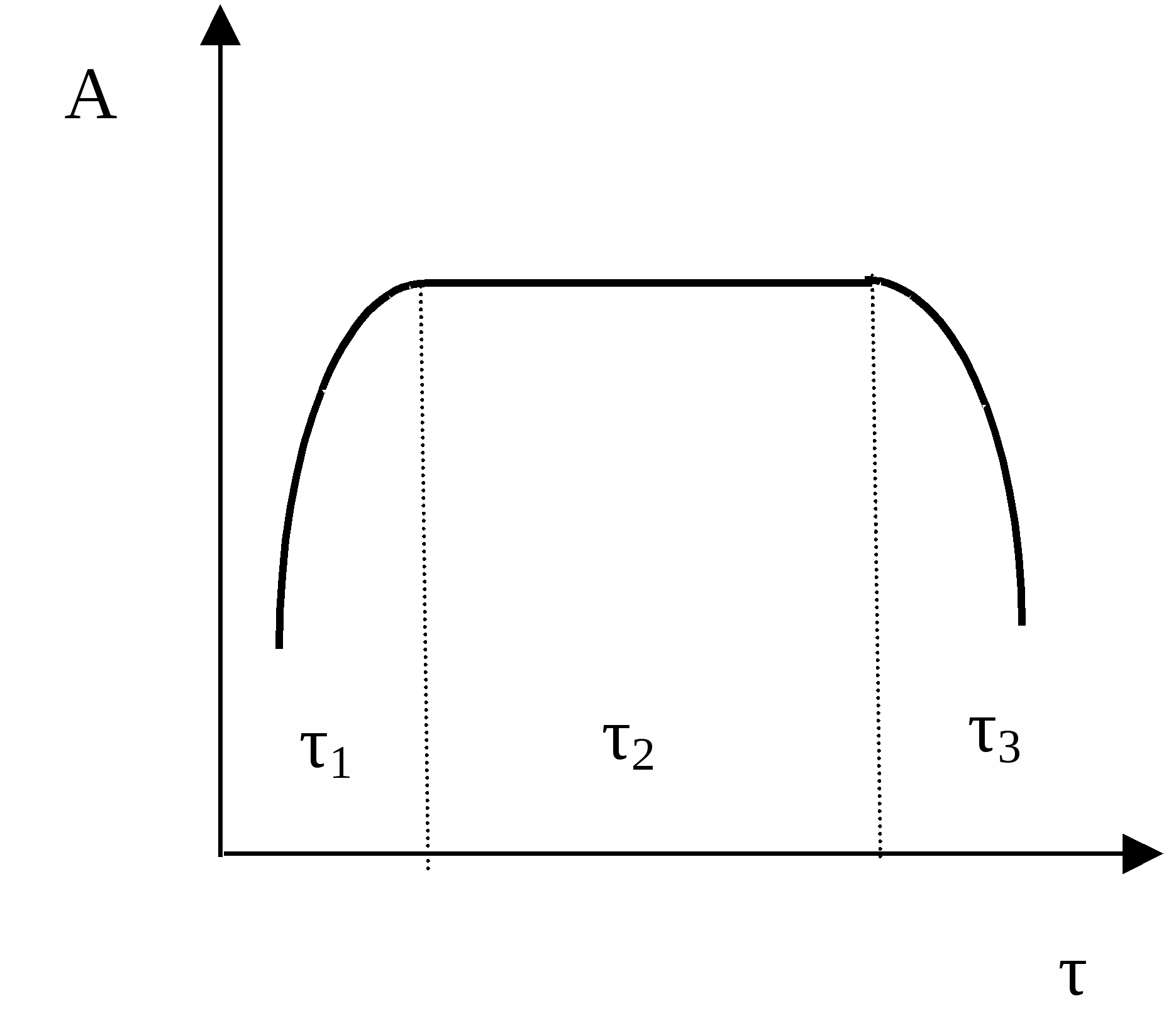 τ1 – период созревания катализатора; в это время под воздействием молекул реагента на поверхности происходят изменения, приводящие к повышению активности катализатора; τ2 – период постоянной активности (срок службы катализатора); τ3 – период дезактивации катализатора (потеря активности). Причины дезактивации катализатора
В качестве контактных ядов чаще всего выступают соединения элементов 5 и 6 групп (соединения мышьяка, сурьмы, кислорода, серы, селена, теллура), окись углерода СО, синильная кислота и ее соли, тяжелые металлы (медь, свинец, олово, висмут, ртуть, кобальт, никель, железо, марганец), галогены, хлорсодержащие углеводородов и др. Контактные яды часто обнаруживают некоторую специфичность. Так например, О2 является ядом для многих металлических катализаторов, а в случае платинового катализатора он даже увеличивает его активность. Никель, отравленный тиофеном, не гидрирует ароматические углеводороды, но сохраняет свою активность при гидрировании олефинов. Действие контактных ядов зависит от их концентрации. Иногда для отравления катализатора достаточно очень малого количества яда. Например, присутствие 3 . 10-10 моль/л Н2S в сырье приводит к полной и необратимой дезактивации никелевого катализатора в процессе гидрирования. В других случаях отравление происходит при сравнительно больших концентрациях яда, а в малых количествах он повышает активность катализатора, промотирует его. (Промотирование – повышение активности катализатора путем введения различных добавок). Отравление катализатора может быть обратимым и необратимым, прогрессирующим (постоянно возрастающим по мере накопления яда) и внезапным, быстрым. Отравление может быть селективным, т.е. включающим лишь часть функций катализатора, или полным. Наиболее чувствительными к контактным ядам являются металлические катализаторы, особенно металлы 8 группы и металлы подгруппы меди. Из неметаллических катализаторов чувствительными к контактным ядам являются алюмосиликатные катализаторы. Селективность катализатора – это способность катализатора ускорять только целевую реакцию. Селективность рассчитывается как отношение скорости образования целевого продукта к величине активности катализатора. В качестве примера использования селективного катализатора можно привести процесс селективного окисления аммиака до оксида азота (II) на платине (см. лекцию № 8). Использование высокоселективных катализаторов позволяет уменьшить непроизводительные затраты сырья на побочные реакции, облегчает разделение реакционной смеси, то есть в целом улучшает экономику процесса. Физические свойства катализатора Физические свойства катализатора, такие как его поверхность, кристалличность, теплопроводность, механическая и термическая стабильность и др., оказывают очень сильное влияние на эффективность его работы, кинетику реакций, гидродинамику потоков. Скорость гетерогенно-каталитической реакции, как скорость любого гетерогенного процесса, возрастает с увеличением поверхности контакта фаз, в данном случае – с увеличением поверхности катализатора, так как именно на его поверхности протекает реакция. Увеличить поверхность катализатора можно двумя способами:
При измельчении катализатора увеличивается его внешняя поверхность. Однако при уменьшении размера гранул катализатора возрастает гидравлическое сопротивление каталитического слоя, а, следовательно, и затраты на транспортировку реагентов через реактор. Кроме того, при высокой степени измельчения катализатора резко увеличивается его унос из реактора. Поэтому размер зерен катализатора должен иметь оптимальную величину. При неподвижном слое катализатора используют гранулы размером 2-5 мм, (редко до 20 мм); в «кипящем» слое катализатора размер гранул меньше 20 микрон. Поверхность гранул катализатора можно увеличить также, усложняя их форму. Однако это сопровождается, обычно, увеличением затрат на производство катализатора. Промышленные катализаторы имеют форму шаров, цилиндров, таблеток, колец Рашига и др. Создание пористой структуры катализатора увеличивает внутреннюю поверхность, которая при развитой системе пор может составить более 75% от общей поверхности катализатора. Доступность внутренней поверхности определяется размером пор. Различают:
Чем меньше размер пор, тем больше внутренняя поверхность. Однако размер пор должен быть таким, чтобы обеспечить наиболее благоприятные условия диффузии молекул реагентов внутри поры. Важное значение имеет также длина поры. Для каждого катализатора экспериментально подбирается оптимальная пористая структура, которая определяется соотношением скорости диффузии и скорости химической реакции. На эффективность работы катализатора часто оказывает большое влияние его кристалличность. Так например, каталитическая активность γ-Al2O3 в реакциях дегидрирования и дегидратации в десятки раз больше, чем активность α- формы оксида алюминия, которая отличается от γ-формы температурным режимом приготовления. Вполне очевидно, что срок службы катализатора и его активность в процессе работы очень сильно зависят от его механической прочности, теплопроводности, термостабильности. Поэтому в процессе приготовления катализатора особое внимание уделяют оптимизации этих физических свойств. Лекция № 11 Теория химического реактора Химический реактор – это основной аппарат технологической схемы, в котором осуществляется химическая реакция и сопутствующие ей физические процессы. Современный химический реактор – сложный аппарат, имеющий множество устройств и механизмов, которые выполняют различные операции по проведению, ускорению и контролю протекающих химических и физических процессов. Любой химический реактор имеет загрузочно-разгрузочное устройство, теплообменные устройства для поддержания теплового режима процесса, перемешивающее или иное устройство для обеспечения массообмена. Систему контрольно-измерительных приборов и другие приспособления. Реактор характеризуют набором габаритных и технологических параметров. Габаритные параметры – это объем, диаметр, высота реактора, число трубок, тарелок и т.п. Технологические параметры – это состав, температура, скорость потока и т.п. реагентов (параметры входа) и продуктов (параметры выхода), а также параметры тепло- и хладоагентов. Различают стационарный (установившийся) и нестационарный режимы работы реактора. При стационарном режиме в реакторе не происходит накопления вещества или тепла, то есть производные концентрации реагентов и температуры во времени равны нулю. При нестационарном режиме в реакторе накапливается вещество или тепло. Стационарный режим характерен для реакторов, работающих в непрерывном режиме; нестационарный – для периодических реакторов или для непрерывных реакторов в стадии пуска или остановки. Каждый работающий реактор имеет определенный концентрационный и температурный режим. Концентрационный режим – поддержание оптимальной концентрации реагентов по объему (длине) реактора или во времени. Температурный режим - это поддержание оптимальной температуры по объему (длине) реактора или во времени. Основные требования к промышленным реакторам:
Эффективность работы реактора зависит от его конструкции и режима осуществления в нем процесса. Работу реактора оценивают по следующим показателям:
|
