лекции токсикхим. Лекция Предмет, разделы и задачи токсикологической химии. Пищеварение и метаболизм посторонних веществ ядов. Вещества, которые изолируются минерализацией биологического материала (металлические яды)
 Скачать 1.52 Mb. Скачать 1.52 Mb.
|
|
КОЛОРИМЕТРИЧЕСКИЕ МЕТОДЫ. 1. Дитизоновый метод. Это очень чувствительный и достаточно точный метод. Дитизонат цинка, красного цвета, извлеккают четыреххлористым углеродом при рН 6,5-7,5, т.к. в хлороформе эта реакция протекает медленнее и дитизонат цинка в четыреххлористом углероде со временем не претерпевает заметного разложения. Оптическую плотность определяют при 535 нм. Zn2++2HDz → Zn(HDz)2 2. количественное определение цинка по реакции с дифенилкарбазоном. Дифенилккарбазон с ионами цинка образует соединение при соотношении Ме:Re=1:2:  Оптическую плотность раствора определяют при 530 нм. Оптическую плотность раствора определяют при 530 нм.Количественное определение ионов цинка в сыворотке крови и моче обычно выполняется методом атомной абсорбционной спектроскопии. Эмиссионный спектральный метод может быть выполнен без предварительного концентрирования минерализата при концентрации цинка 10-3-10-5%. Лекция 2. Вещества, которые изолируются из биологического материала перегонкой с водяным паром (летучие яды). Схема анализа дистиллята химическим методом. Анализ дистиллята и биологических жидкостей на летучие яды методом газо– жидкостной хроматографии. Группа веществ, изолируемых дистилляцией с водяным паром Из ядовитых веществ, имеющих токсикологическое значение из объектов биологического происхождения перегонкой с водяным паром изолируются следующие вещества: 1. Кислота циановодородная (синильная) – НСN; 2. Галогенопроизводные алифатического ряда (CHCl3, хлоралгидрат дихлорэтан, ССl4); 3. Альдегиды и кетоны – СН2О и ацетон; 4. Спирты алифатического ряда – СН3ОН, С2Н5ОН, изоамиловый спирт, этиленгликоль; 5. Органические карбоновые кислоты – СН3СООН; 6. Одноатомные фенолы – карболовая кислота, крезол, лизол. Бытовые отравления чаще всего происходят этиловым спиртом и другими спиртами, уксусной кислотой, дихлорэтаном. Методом дистилляции с водяным паром изолируются из биологического материала вещества, хорошо растворимые в воде (HCN, СН3СООН, С2Н5ОН и др.) и вещества, трудно растворимые или практически нерастворимые в воде (CHCl3, CCl4, дихлорэтан). При этом, и для первой и для второй группы веществ, существуют свои закономерности. При нагревании двукомпонентной смеси, состоящей из практически нерастворимых друг в друге веществ, каждое из них увеличивает упругость своих паров независимо от другого. Когда упругость паров смеси достигает атмосферного давления – жидкость закипает и оба вещества начинают перегоняться с водяным паром. Так как сумма упругостей паров обоих веществ равна атмосферному давлению, температура перегонки каждого вещества в смеси будет ниже температуры кипения каждого компонента в чистом виде. Пример: Температура кипения хлороформа – 61,2 °С, а при перегонке с водяным паром – 56,1 °С; изоамиловый спирт соответственно – 132 °С и 95 °С. Изолирование веществ дистилляцией с водяным паром удобно в тех случаях, когда изолируемое вещество разлагается при температуре кипения. Например: Тетраэтил свинец разлагается при температуре 200 °C. Поэтому его удобно изолировать перегонкой с водяным паром. Связь между летучестью вещества и молекулярной массой для веществ, нерастворимых друг в друге, выражается уравнением:  = =  , где , гдеWo и Wn – вес органического вещества и воды в дистилляте; Мо и Мn – соответствующие молекулярные массы; Ро и Рn – соответствующие давления паров компонентов. В основе дистилляции с водяным паром лежит закон Рауля: Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества в растворе. Для веществ, растворимых в воде, также имеются свои закономерности при перегонке их с водяным паром. 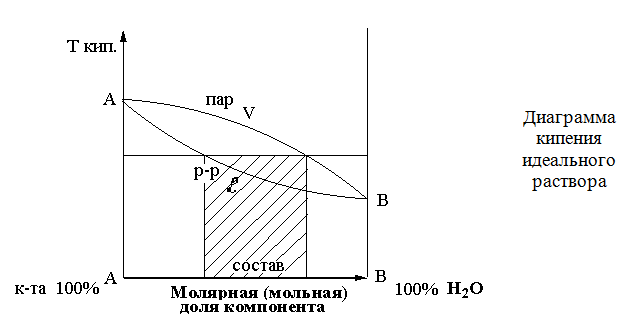 Методика перегонки с водяным паром Измельченный биоматериал помещают в колбу и смешивают с водой до однородной массы. Подкисляют винной или щавелевой кислотой. Через присоединенный парообразователь насыщают паром. После этого пар поступает через водяной холодильник в приемник. Этим методом перегоняются как вещества растворимые в воде: - синильная кислота, метанол, этанол, уксусная кислота и т.д. так и труднорастворимые: - хлороформ, четыреххлористый углерод, дихлорэтан, изоамиловый спирт и др. В первых порциях дистиллята, при их наличии будут присутствовать: - синильная кислота, метанол, этанол Синильная кислота  1. При исследовании свежего трупного материала применяют объемное определение НСN по избытку 0,1 н. раствора AgNO3, избыток которого оттитровывают аммония роданидом – NH4SCN. Индикатором является – железо аммонийные квасцы. 2. При исследовании несвежего трупного материала – весовой метод (описан в учебнике М.Д. Швайковой "Токсикологическая химия"): При исследовании не вполне свежего трупного материала титриметрический метод анализа неприемлем, т.к. Н2S, содержащийся в объекте исследования, будет реагировать с серебра нитратом с образованием сульфида серебра, который будет искажать результаты анализа. В таких случаях обычно применяют гравиметрический (весовой) метод определения цианидов – CN. Весовое (гравиметрическое) определение синильной кислоты сводится к отгонке синильной кислоты из навески объекта исследования, собиранию дистиллятов в 2-3 приемника, содержащие 0,2% раствор серебра нитрата, отделению после подкисления азотной кислотой (не содержащей цианидов – СN) осадка АgСN с возможной примесью Ag2S, обработке полученного осадка избытком раствора аммиака в целях отделения растворимого в нем цианида серебра от нерастворимого сульфида серебра, выделению из раствора с помощью азотной кислоты цианида серебра и определению металлического серебра после высушивания, сжигания и прокаливания фильтра с осадком. Токсикологическое значение Токсикологическое значение НСN объясняется ее сильной ядовитостью; тем, что она связывается с Fe2+ гемоглобина крови и дыхательными ферментами (Fe3+), а также ее широком применении в народном хозяйстве. Соли HCN применяются для получения Au и Ag из руд – цианамидный способ: 4Au + 8KCN + O2 + 2H2O  4K[Au(CN)2] + 4КОН 4K[Au(CN)2] + 4КОНзатем действуют металлическим цинком и получают чистые металлы. Этот метод был предложен в 1843 году Багратионом Петром Романовичем для извлечения золота – Аu из руд методом цианирования. Цианиды применяют в фотографии, в производстве фармацевтических препаратов, в сельском хозяйстве для борьбы с грызунами. В период второй мировой войны фашисты травили людей в газовых камерах ЦИКЛОНОМ (пористый материал, пропитанный HCN). Источником отравления в быту являются ядра горького миндаля, абрикоса, вишни и других плодов семейства розоцветных содержащих гликозид АМИГДАЛИН: который в кислом растворе расщепляется на виноградный сахар , бензальдегид и HСN. В организме, в тканях трупа, во внешней среде цианиды подвергаются биотрансформации: 1. Гидролиз : НСN + 2Н2О  HCOONH4 HCOONH42. Превращением в роданиды под влиянием ронидазы (фермент): KCN + S  KSCN KSCN3. Соединяется с гемоглобином крови, образуя циангемоглобин. 4. Связывается с цистеином. 5. Присоединяется к альдегидной группе сахаров: Галогенводороды Галогенводороды нашли применение в промышленности, медицине, быту. Поэтому мы изучили наиболее характерные представители этой группы: хлороформ, четыреххлористый углерод, дихлорэтан, хлоралгидрат. Общей качественной реакцией для всех перечисленных галогенуглеводородов является реакция отщепления органически связанного хлора и определения ионов хлора нитратом серебра. ХлороформКачественное определение 1. Отщепление хлора и определение ионов хлора нитратом серебра: CHCl3 + 4NaOH= 2NaCl + HCOONa + 2H2O NaCl + AgNO3= AgCl↓ + NaNO3 2. Как видно из предыдущей реакции, при отщеплении органически связанного хлора, одним из продуктов реакции является формиат натрия, который определяют с реактивом Фелинга: 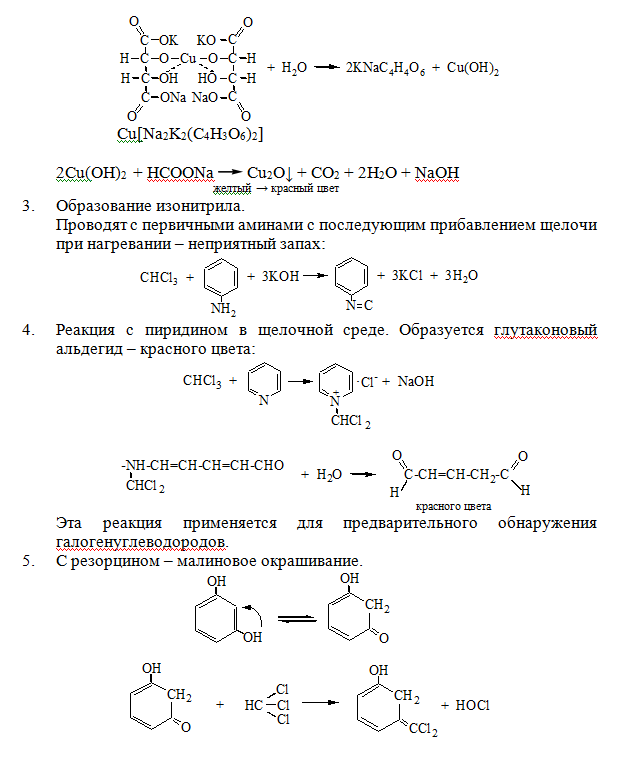 Количественное определение Все галогенуглеводороды количественно определяют аргентометрически по хлорид-иону. Токсикологическое значение Применяется в промышленности как растворитель и экстрагент. Отравления – при вдыхании через пищеварительный тракт. Легкая степень – сознание затемнено, понижение слуха, косоглазие с диплопией. Средняя тяжесть – тоже, что и при легкой, только с тошнотой, рвотой, болями головы, поносом. Тяжелая – судороги, кома, нефропатия, перерождение печени. Смерть наступает от оттека легких. Антидотов нет. Метаболизм – СО2 и НCl. Выделяют в неизменном виде из легких – 9%. галогенводороды CCl4 Качественное определение 1. Отщепление органически связанного хлора c последующим определением хлорид-ионов. CCl4 + 4NaOH 4NaCl + CO2 + 2H2O 2. Реакция Фудживара – аналогично CHCl3. 3. Образование изонитрила – аналогично CHCl3. 4. С 2,7-диоксинафталином: Светло-бурое → зелено-желтое окрашивание. Отличительные реакции представлены в таблице (Крамаренко). Токсикологическое значение CCl4 – растворитель, экстрагент. Попадает – на кожу, ЖКТ, легкие. Накапливается – жировая ткань, печень, мозг, костный мозг, почки. Выделяется – через легкие, с мочой. Далее перерождение клеток печени, почек. Легкая степень отравления: раздражение глазных яблок, головокружение, головная боль. Массивное отравление: тошнота, рвота, понос, боли в животе, желудочно-кишечные кровотечения, головная боль, головокружение, спутанное сознание, сонливость, расстройство зрения, судороги, кома – смерть за счет остановки дыхания, сердца. Антидотов нет. Хлоралгидрат Качественное определение 1. Отщепление хлора. CCl3СОH + NaOH НСCl3 + HCOONa Как видно из этой реакции хлоралгидрат при отщеплении атома хлора образует хлороформ, поэтому он дает все те же реакции, что и хлороформ. 2. С реактивом Несслера. Эта реакция позволяет отличить хлоралгидрат от остальных галогенуглеводородов. CCl3СОH + K2[HgI4] + 3KOH Hg↓ + СCl3COOK + 4KI + 2H2O Обличить его можно экстракцией из дистиллята диэтиловым эфиром. При его присутствии в дистилляте в выпарительной чашке характерное кристаллическое вещество – сухой остаток хлоралгидрата. Токсикологическое значение Применяется в медицине – успокаивающее, снотворное, противосудорожное. Накопление, симптомы – похожи на действие хлороформа. Метаболизм – трихлорэтанол, трихлоруксусная кислота. Выводится – с мочой в виде глюкуронида. Антидотов нет. Дихлорэтан Качественное определение 1. Реакция отщепление органически связанного хлора. В зависимости от условий проведения этой реакции образуется разные продукты, на которые проводят соответствующие реакции. 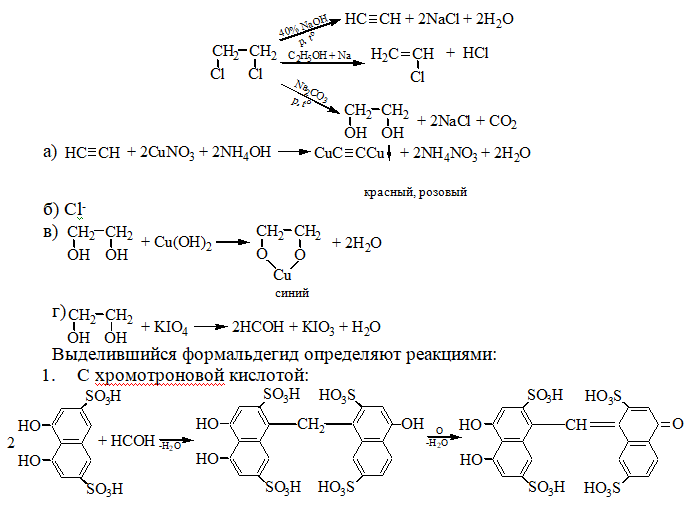 Токсикологическое значение С2Н4Cl2 – применяется – как растворитель, экстрагент, в кожевенной промышленности. Системный яд. Попадает через легкие, кожу, ЖКТ. Поражает: ЦНС, печень, почки, сердечную мышцу. Расстройства: нервные, кишечные. Метаболиты – неизвестны. Антидотов нет. Обнаружение и определение спиртом имеющих токсикологическое значение К спиртам, которые имеют значение при отравлениях, относятся – метанол, этанол, изоамиловый, этиленгликоль (двухатомный спирт). Спирты Спирты. Этиловый спирт – этанол (С2Н5ОН) – бесцветная жидкость с характерным запахом, t° кип. 78°С. Широкое применение этилового спирта в качестве вкусового вещества, его доступность, делают этиловый спирт особенно важным в токсикологическом отношении. Этанол относится к наркотикам. При приемах его во внутрь, он сначала вызывает возбуждение, а затем угнетение и паралич центральной нервной системы. Пристрастие к этиловому спирту общеизвестно. По серьезности последствий интоксикации этиловый спирт занимает одно из первых мест и нередко он является косвенной причиной большого количества смертельных исходов, нетрудоспособности и других серьезных повреждений. При патологическом опьянении человек теряет способность контролировать свои действия. Также лица способны совершать тяжелые антисоциальные поступки. Клиническая картина отравления определяет 4 стадии острого алкогольного отравления: возбуждение, гипноз, наркоз и асфиксия. Первые две стадии характеризуются признаками отравления: психическое возбуждение, чрезмерная болтливость, экспансивность, подвижность с потерей чувства меры, покраснение лица, шатающаяся походка. Дальше наступает вялость, рвота, сонливость, нарушение сознания до комы. Возможны судороги (особенно у детей). Смерть наступает от паралича жизненно важных центров. Вскрытие трупа при смертельном отравлении этиловым спиртом не дает характерных изменений. Важным диагностическим признаком при вскрытии является запах спирта от всех органов и тканей, особенно от мозга и легких. Наибольшие количества спирта обычно содержатся в крови, головном мозгу и тканях богатых кровью. Однако, следует отметить, что после всасывания в кровь этиловый спирт довольно быстро окисляется в живом организме через ацетальдегид и СН3СООН до CO2 и H2O. В неизменном виде выводится из организма с мочой, выдыхаемым воздухом, потом, слюной, калом и т.д. (2-10%). В связи с этим суд.-хим. эксперту удается обнаружить лишь незначительную часть этилового спирта. Таблица 1.
Поэтому, в случаях тяжелых отравлений, для более достоверной характеристики, на анализ берется кровь, где методом газо-жидкостной хроматографии определяется количественное содержание алкоголя. Изолирование этанола из биологического материала – дистилляцией с водяным паром, отгоняется в первые порции дистиллята. Качественное обнаружение в дистилляте: 1) Реакция образования йодоформа. Реакция протекает в присутствии раствора йода в йодиде калия в щелочной среде при нагревании. Реакция позволяет определить 0,04 мг этанола в 1 мл раствора. С2Н5ОН + 4I2 + 6NaOH  СН3I↓ + 5NaI + 5Н2О + НСOONa СН3I↓ + 5NaI + 5Н2О + НСOONaОднако, следует отметить, что данная реакция неспецифична. Ее дают ацетальдегид, ацетон, молочная кислота и др. 2) Реакция образования уксусно-этилового эфира. Этиловый спирт с ацетатом натрия в присутствии H2SО4 образует уксусно-этиловый эфир, имеющий характерный запах: 2СН3СOONa + С2Н5ОН + H2SО4  2СН3СOOС2Н5 + Na2SО4 + 2Н2О 2СН3СOOС2Н5 + Na2SО4 + 2Н2О3) Реакция образования этилбензоата. (чувствительность – 2 мг/1 мл раствора). При взаимодействии этилового спирта с бензоилхлоридом (хлористым бензоилом) образуется этилбензоат, имеющий характерный запах: Распознаванию запаха этилбензоата мешает избыток бензоилхлорида, имеющего неприятный запах, а также СН3ОН, образующий подобный по запаху бензойнометиловый эфир. Поэтому избыток бензоилхлорида разрушают щелочью: 4) Реакция окисления этанола до ацетальдегида. Этиловый спирт окисляется К2Сг2О7, КМnO4 и некоторыми другими окислителями. Эта реакция, в некоторых случаях используется для количественного определения этанола. 3С2Н5ОН + К2Сг2О7 + 4H2SО4  2СН3СOН + Сг2(SО4)3 + К2SО4 + 7Н2О 2СН3СOН + Сг2(SО4)3 + К2SО4 + 7Н2О1| Сг2О72- + 14H+ + 6e  2Сг3+ + 7Н2О 2Сг3+ + 7Н2О3| С2Н5ОН – 2e  СН3СOН + 2H+ СН3СOН + 2H+Сг2О72- + 14H+ + 3С2Н5ОН  2Сг3+ + 3СН3СOН + 6H+ + 7Н2О 2Сг3+ + 3СН3СOН + 6H+ + 7Н2О8H+ Эффектом реакции является запах ацетальдегида и изменение окраски. Данная реакция лежит и в основе метода микродиффузии для обнаружения этилового спирта в крови, моче и гомогенатах ткани. Этот метод широко используется в судебно-химических лабораториях зарубежных стран, и все чаще этим методом пользуются судебные химики нашей страны. (Метод хорошо описан в учебнике). Эта реакция может быть использована и для количественного фотометрического метода определения этанола в жидкостях. Он основан на изменении окраски реагирующей смеси от оранжевой (К2Сг2О7) до синей (Сг3+), которую фотометрируют. Эта же реакция лежит в основе функционирования трубки Мохова-Шинкаренко, используемой для определения этанола в выдыхаемом воздухе. Однако, наиболее современным методом обнаружения и количественного определения этилового спирта в напитках, растворах, крови и моче является метод газожидкостной хроматографии (чувствительность 0,01%). В качестве эталонного вещества применяют 95%-этиловый спирт. Перед введением в дозатор газового хроматографа этот спирт переводят в более летучее, чем этиловый спирт, соединение – этилнитрит (t° кип. – 17°С). С2Н5ОН + СН3СOOН + KNO2  С2Н5ОNO + СН3СOOK + Н2О С2Н5ОNO + СН3СOOK + Н2ООбразовавшийся этилнитрит, который находится в газообразном состоянии над жидкостью, вводят в газовый хроматограф и производят хроматографирование. При этом записывают время удерживания этилнитрита (время от ввода пробы до выхода max. пика). Это является качественной характеристикой. После окончания хроматографирования эталонного раствора производят точно такой же опыт с исследуемым раствором, пробами мочи или крови, в которых предполагается наличие этилового спирта. Совпадение времени удерживания вещества в обеих пробах (в пробе с эталонным и исследуемым веществом) указывает на идентичность этих веществ. Для количественного определения этилового спирта в крови и моче применяют метод внутреннего стандарта. Согласно этому методу к крови или моче, в которых определяют количественное содержание этилового спирта, прибавляют внутренний стандарт. В качестве внутреннего стандарта применяют пропиловый спирт. Содержащийся в крови или моче этиловый спирт (t° кип. 78°С), а также пропиловый спирт (t° кип. 97,5°С), прибавленный в качестве внутреннего стандарта, переводят в более летучие соединения (этилнитрит с т. кип. 17°С и пропилнитрит с т. кип. 46-48°С). Смесь алкилнитритов вводят в дозатор хроматографа и проводят хроматографирование. При этом на хроматограмме выписывается 2 пика, один из которых соответствует этиловому спирту (этилнитриту), а второй – пропиловому спирту (пропилнитриту). Затем рассчитывают отношение площади или высоты пика этилнитрита к площади или высоте пика внутреннего стандарта (пропилнитрита). Расчет количественного содержания этанола в крови или моче производится по калибровочному графику. Количественное содержание спирта в крови и моче определяется в промилях (%о). Содержание спирта в крови является исходной величиной для определения количества алкоголя в организме. Это производится по формуле: A = p . r . Ct, где р – вес тела свидетельствуемого в кг; r – фактор, обозначающий отношение между концентрацией алкоголя во всем организме и концентрации его в крови. Этот фактор в среднем равен 0,7; Ct – концентрация алкоголя в крови, установленная в момент исследования; А – количество алкоголя в граммах, находящееся в организме. Пример. В момент исследования в крови установлена концентрация алкоголя 1,85 %о. Вес обследуемого лица 79 кг. Количество алкоголя, находящегося в организме вычисляют по формуле: A = 79 . 0,7 . 1,85 = 102,3 г. (102,3 г. 96% спирта соответствует 126 мл его, или 310 мл 40% алкоголя). Зависимость степени опьянения от количества содержания алкоголя в крови. До 0,05-0,2 %о – концентрация алкоголя находится в пределах физиологической нормы. От 0,2 до 0,5 %о – свидетельствующий практически трезв. Хотя в организме находится незначительное количество спирта, но функции организма не нарушены. 0,5-1,0 %о – легкая степень опьянения. 1-2,5 %о – средняя степень опьянения. 2,5-3 %о – тяжелая степень опьянения. Свыше 3 %о – тяжелое отравление, при которым становится возможным смертельный исход. Свыше 6 %о – возможность смертельного исхода возрастает. Как уже ранее говорилось, при определении присутствия алкоголя во вдыхаемом воздухе водителями используют трубку Мохова и Шинкаренко, хотя вызывают изменение окраски и другие вещества. Обнаружение метилового спирта. В моче, крови и некоторых других объектах СН3ОН можно обнаружить при помощи предварительных проб и метода микродиффузии (метод основан на окислении метанола перманганатом калия в сернокислой среде). 5СН3ОН + 2KMnО4 + 3H2SO4 =5НСОН + 2MnSO4 + K2SO4 + 8Н2О 2| MnО4- + 8H+ + 5e= Mn2+ + 4Н2О 1| СН3ОН – 2e=НСOН + 2H+ Если объектом исследования является моча, то в качестве предварительной пробы можно провести реакцию с дихроматом калия (к 1 мл мочи прибавляют 1 мл К2Сг2О7 в 50% растворе H2SО4). К2Сг2О7 + 3СН3ОН + 4H2SО4 =2НСOН + Сг2(SО4)3 + К2SО4 + 7Н2О При наличии 150 мг% спирта в моче окраска изменяется в течение 10 сек., а при количествах 75 мг% – в течение 45 сек. Восстанавливать дихромат калия могут и другие спирты, поэтому при положительных результатах необходимо проводить дополнительные исследования. С этой целью 5 мл крови или 10 мл мочи вносят в аппарат для перегонки с водяным паром и проводят перегонку. Собирают 5 мл дистиллята, в котором определяют присутствие метанола. Здесь нужно отметить, что учитывая летучесть СН3ОН, при изолировании его из биологического материала дистилляцией, приемник для дистиллята необходимо охлаждать холодной водой. К 2 мл дистиллята по каплям прибавляют 5% раствор КМnO4, пока он не перестанет обесцвечиваться (химизм приведен выше). Для удаления избытка перманганата калия по каплям прибавляют 10% раствор щавелевой кислоты до обесцвечивания раствора. После этого к раствору прибавляют 0,1 г хромотроповой кислоты и осторожно, по стенкам пробирки приливают 1,5 мл конц. H2SO4. Появление красной или фиолетовой окраски указывает на наличие метилового спирта в дистилляте: Еще метиловый спирт можно обнаружить по реакции образования метилового эфира салициловой кислоты: При наличии метанола ощущается характерный запах образовавшегося эфира. Однако, реакция не специфична, т.к. этанол с салициловой кислотой образует идентичный по запаху эфир. Этиленгликоль. Этиленгликоль. Этиленгликоль относится к дигидроксильным высшим спиртам. Наиболее важным свойством этиленгликоля является его способность понижать температуру замерзания воды, чем и обуславливается его применение в качестве антифриза. Этиленгликоль широко применяется в различных областях народного хозяйства в качестве растворителя. (t° кип. 197°С). Острые отравления этиленгликолем возникают при приеме внутрь, например, при ошибочном употреблении его вместо этилового спирта или спиртных напитков. Этиленгликоль быстро всасывается в желудке и кишечнике. Выделяется в неизменном виде почками 20-30%; около 60% окисляется в печени по воздействием алкогольдегидрогеназы с образованием гликолевого альдегида, щавелевой кислоты и др. продуктов. Различают 3 периода интоксикации: 1. Начальный – продолжительность до 12 часов; при этом преобладают симптомы поражения ЦНС по типу алкогольного опьянения. 2. Нейротоксический – прогрессируют симптомы поражения ЦНС и присоединяются нарушения функции дыхания и сердечно-сосудистой системы. 3. Нефротоксический – на 2-5-е сутки в клинической картине интоксикации преобладают симптомы поражения печени и почек. При тяжелых отравлениях наступает потеря сознания, судороги, повышение температуры тела. Дыхание глубокое, шумное, явление острой сердечнососудистой недостаточности. Метод выделения этиленгликоля из объектов химико-токсикологического анализа разработали Н.Б. Лапкина и В.А. Назаренко, который основан на использовании бензола как селективного переносчика этиленгликоля из объектов в дистиллят. Вода, которая перегоняется при этом, практически содержит весь этиленгликоль. 1. Для обнаружения этиленгликоля применяют реакцию его окисления перйодатом натрия до формальдегида, который определяют с помощью фуксинсернистой кислоты: НО–СН2–СН2–ОН + HIO4  2НСОН + HIO3 + Н2О 2НСОН + HIO3 + Н2ОФормальдегид с фуксинсернистой кислотой образует хиноидный краситель. 2. При окислении этиленгликоля HNO3 образуется щавелевая кислота, которая с солями кальция образует белый осадок. НО–СН2–СН2–ОН + 8HNO3  НOOС–COОН + NO2 + Н2О НOOС–COОН + NO2 + Н2О3. С сульфатом меди в щелочной среде образуется раствор синего цвета: CuSO4 + 2NaOH  Cu(OH)2 + Na2SO4 Cu(OH)2 + Na2SO4Изоамиловый спирт. 4 3 2 1 3НC – СН – СН2 – CН2 – OH 3-метилбутанол-1 | СН3 Изоамиловый спирт – главная составная часть сивушного масла – побочного продукта спиртового брожения. Это жидкость с раздражающим запахом. (t° кип. 132°С). Изолируется перегонкой с водяным паром. Если в дистилляте содержится большое количество изоамилового спирта, то он "плавает" на поверхности (т.к. легче воды) в виде жирных маслянистых капель. Если изоамилового спирта мало в дистилляте, то к дистилляту прибавляют эфир, с помощью которого извлекают изоамиловый спирт. Затем, после отделения эфирной фракции, эфир удаляют при комнатной температуре и в остатке определяют присутствие изоамилового спирта. Качественное обнаружение. 1. При сочетании части остатка с салициловым альдегидом или ванилином в присутствии конц. H2SО4 – образуется розово-красное окрашивание (реакция Комаровского). Эта реакция позволяет обнаружить 1,5 мг изоамилового спирта. Реакция неспецифична, т.к. ее дают другие спирты, содержащие не менее 3-х атомов углерода. Реакция имеет отрицательное значение. 2. Часть остатка окисляют бихроматом или перманганатом калия в присутствии конц. H2SО4 при нагревании на водяной бане образуется изовалериановый альдегид (приятный запах), затем образуется изовалериановая кислота (запах гнилого сыра). Эта реакция позволяет обнаружить 0,11 мг изоамилового спирта. 3. Образование амилацетата. Эта реакция основана на том, что при взаимодействии ацетата натрия с изоамиловым спиртом в присутствии конц. H2SО4 образуется изоамилацетат, имеющий запах грушевой эссенции. 2CH3COONa + H2SО4 =2СН3СООН + Na2SО4 Токсикологическое значение. Изоамиловые спирты применяются в народном хозяйстве как растворители лаков, в производстве амилацетата, амилнитрита, валериановой кислоты, бездымного пороха. Описаны отравления эссенциями, содержащими амилацетат. При остром отравлении наблюдается раздражение глаз, дыхательных путей, тошнота, рвота. При всасывании поражает нервную систему и органы выделения. В быту отравление сивушными маслами наблюдаются при потреблении во внутрь суррогатов алкоголя, в частности самогона. Изоамиловый спирт окисляется в организме медленно и медленно выводится из него. Вступление в токсикологическую химию Содержание дисциплины, задания, разделы и объекты анализа, в токсикологической химии |
