лекции токсикхим. Лекция Предмет, разделы и задачи токсикологической химии. Пищеварение и метаболизм посторонних веществ ядов. Вещества, которые изолируются минерализацией биологического материала (металлические яды)
 Скачать 1.52 Mb. Скачать 1.52 Mb.
|
|
Обнаружение фенола Для обнаружения фенола используется часть третьего дистиллята, который вносят в делительную воронку, прибавляют раствор гидрокарбоната натрия до щелочной реакции. Реакция с бромной водой. От прибавления бромной воды к фенолу выпадает осадок трибромфенола: 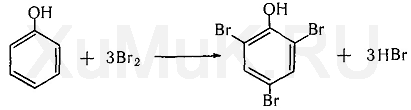 Индофеноловая реакция. При окислении смеси фенолов и аминов (в том числе и аммиака) образуются индофенолы, имеющие соответствующую окраску: 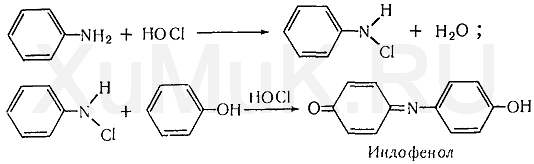 Реакция Либермана. Эта реакция также основана на образовании индофенола. В качестве реактивов на фенолыприменяют нитрит натрия и серную кислоту. При взаимодействии нитрита натрия и серной кислоты образуется азотистая кислота, которая с фенолом образует n -нитрозофенол, при изомеризации которого образуется n -хиноидоксим:  При взаимодействии хиноидоксима с избытком фенола образуется индофенол, имеющий синюю окраску: 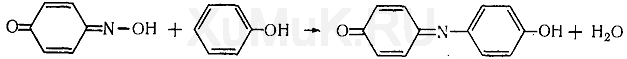 Реакция с хлоридом железа (III). От прибавления хлорида железа (III) к фенолу появляется синяя окраска. Реакция с реактивом Миллона. 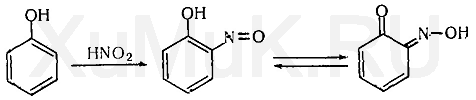 1,2-хинонмоноксим с ионами ртути образует окрашенное внутрикомплексное соединение: 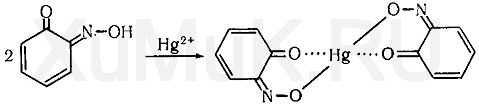 Уксусная кислота Безводная (ледяная) уксусная кислота СН 3 СООН представляет собой бесцветную гигроскопическую жидкость или бесцветные кристаллы с резким запахом. Она смешивается с водой, этиловым спиртом и диэтиловым эфиром во всех соотношениях. Эта кислота перегоняется с водяным паром. Метаболизм. Метаболитом уксусной кислоты является ацетальдегид, превращающийся частично в этиловый спирт и частично разлагающийся с образованием оксида углерода (IV) и воды. Обнаружение уксусной кислоты Реакция с хлоридом железа (III). От прибавления хлорида железа (III) к ацетат-ионам появляется красная окраска, обусловленная образованием основного ацетата железа: Реакция с нитратом лантана и иодом. При взаимодействии ацетат-ионов с нитратом лантана La(NO 3 ) 3 в присутствии иода и аммиака раствор приобретает темно-синюю окраску или выпадает такого же цвета осадок. Появление этой окраски или осадка обусловлено адсорбцией иода основным ацетатом лантана. Подобную окраску дают и пропионаты. Реакция образования индиго. При нагревании уксусной кислоты или ацетатов с солями кальция образуется ацетон: 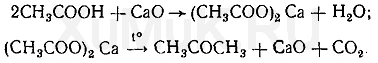 Реакция образования уксусно-этилового эфира. При нагревании ацетатов с этиловым спиртом в присутствии серной кислоты образуется уксусно-этиловый эфир (этилацетат): Изоамиловый спирт Изоамиловый спирт (2-метилбутанол-4) является главной составной частью сивушных масел. Метаболизм. Часть дозы изоамилового спирта, поступившего в организм, превращается в альдегид изовалериановой кислоты, а затем в изовалериановую кислоту. Некоторое количество неизмененного изоамилового спирта и указанных выше метаболитов выделяются из организма с мочой и с выдыхаемым воздухом. Обнаружение изоамилового спирта Реакция с салициловым альдегидом. Изоамиловый спирт с салициловым альдегидом в присутствии концентрированной серной кислоты дает окраску (реакция Комаровского). По одним данным, при этой реакцииконцентрированная серная кислота отнимает воду от изоамилового спирта, в результате чего образуется изоамилен (СН 3 ) 2 —СН—СН=СН 2, который взаимодействует с салициловым альдегидом. Согласно другим данным, концентрированная серная кислота окисляет изоамиловый спирт. Образовавшийся при этом альдегидизовалериановой кислоты вступает в реакцию конденсации с салициловым альдегидом. Реакция с n -диметиламинобензальдегидом. Изоамиловый спирт с n -диметиламинобензальдегидом в присутствии концентрированной серной кислоты дает окраску (реакция Комаровского). Реакция образования изоамилацетата. Эта реакция основана на том, что при взаимодействии ацетата натрия с изоамиловым спиртом в присутствии концентрированной серной кислоты образуется изоамилацетат, имеющий запах грушевой эссенции: 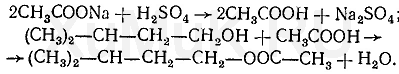 Этиленгликоль Этиленгликоль (НО—СН 2 —СН 2 —ОН) является одним из представителей двухатомных спиртов, имеющих токсикологическое значение. Это бесцветная маслянистая жидкость (т. кип. 197 °С) сладковатого вкуса. Этиленгликоль смешивается с водой во всех соотношениях, плохо растворяется в диэтиловом эфире, хорошо—в этиловом спирте. Этиленгликоль перегоняется с водяным паром. Обнаружение этиленгликоля. Реакция с сульфатом меди. От прибавления сульфата меди и щелочи к этиленгликолю образуется соединение, имеющее синюю окраску: 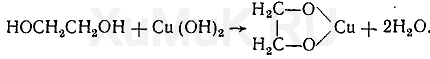 Окисление этиленгликоля азотной кислотой и обнаружение щавелевой кислоты. При многократном выпаривании этиленгликоля с азотной кислотой образуется щавелевая кислота, которая с солями кальция образует кристаллы оксалата кальция, имеющие характерную форму. Эти кристаллы в ряде случаев появляются через 2—3 суток. Тетраэтилсвинец Тетраэтилсвинец (C2H5)4Pb — прозрачная бесцветная жидкость, почти не растворяется в воде, легкорастворимая в бензине, эфире, хлороформе, спирте, в жирах, маслах. Легко разлогается под воздействием нагревания, солнечных лучей до неорганических солей свинца. Обнаружение ионов свинца Для обнаружения ионов свинца, образующихся в результате разложения ТЭС, применяют реакции с иодидом калия, хроматом калия, сероводородной водой и др. Анализ смеси второго и третьего дистиллята Остаток второго дистиллята смешивают с третьим дистиллятом и опять проводят анализ на галлоидпроизводные и формальдегид. С частью дистиллята, которая осталась, выполняют анализ на фенол и изоамиловий спирт. Фенол Фенол представляет собой тонкие длинные игольчатые кристаллы или бесцветную кристаллическую массу со своеобразным запахом. На воздухе он постепенно розовеет. Фенол растворяется в воде в соотношении 1 : 20, легко растворяется в этиловом спирте, диэти-ловом эфире, хлороформе, жирных маслах, растворах едких щелочей. Обнаружение фенола Для обнаружения фенола используется часть третьего дистиллята, который вносят в делительную воронку, прибавляют раствор гидрокарбоната натрия до щелочной реакции. Реакция с бромной водой. От прибавления бромной воды к фенолу выпадает осадок трибромфенола:  Индофеноловая реакция. При окислении смеси фенолов и аминов (в том числе и аммиака) образуются индофенолы, имеющие соответствующую окраску:  Реакция Либермана. Эта реакция также основана на образовании индофенола. В качестве реактивов на фенолыприменяют нитрит натрия и серную кислоту. При взаимодействии нитрита натрия и серной кислоты образуется азотистая кислота, которая с фенолом образует n -нитрозофенол, при изомеризации которого образуется n -хиноидоксим:  При взаимодействии хиноидоксима с избытком фенола образуется индофенол, имеющий синюю окраску: 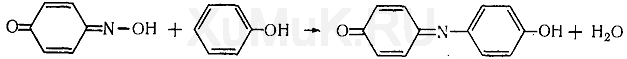 Реакция с хлоридом железа (III). От прибавления хлорида железа (III) к фенолу появляется синяя окраска. Реакция с реактивом Миллона.  1,2-хинонмоноксим с ионами ртути образует окрашенное внутрикомплексное соединение:  Токсикологическая характеристика и анализ группы ядовитых веществ, которые изолируются из биологического материала настаиванием исследуемых объектов водой (минеральные кислоты, щелочи и их соли). ВЕЩЕСТВА, ИЗОЛИРУЕМЫЕ ИЗ БИОЛОГИЧЕСКОГО МАТЕРИАЛА НАСТАИВАНИЕМ ИССЛЕДУЕМЫХ ОБЪЕКТОВ С ВОДОЙ К группе веществ, которые изолируются из различных объектов настаиванием их с водой, относятся минеральные кислоты, щелочи и соли некоторых минеральных кислот. Для очистки водных вытяжек из исследуемых объектов применяют фильтрование или центрифугование, а затем метод диализа. Химико-токсикологическое исследование соответствующих объектов на наличие минеральных кислот, щелочей и некоторых солей проводится тогда, когда материалы дела указывают на возможность отравления этими веществами, а также в случае положительных результатов предварительных проб на кислоты, щелочи и другие соединения в исследуемых объектах. МИНЕРАЛЬНЫЕ КИСЛОТЫ И ЩЕЛОЧИ Для доказательства присутствия минеральных кислот в диализатах определяют кислотность этих жидкостей и наличие в них анионов соответствующих кислот. Определение кислотности диализатов проводится с помощью кислотно-основных индикаторов, которые изменяют свою окраску в кислой среде (метиловый фиолетовый, метиловый оранжевый, конго красный и др.). Для доказательства отравлений минеральными кислотами необходимо отогнать их из диализатов. При этом отгоняются только свободные кислоты. Соли этих кислот, поступившие в вытяжки из исследуемых объектов, не перегоняются. Учитывая то, что серная и азотная кислоты перегоняются при относительно высокой температуре, вначале эти кислоты переводят в более летучие соединения, которые в процессе перегонки легко переходят в дистилляты. СЕРНАЯ КИСЛОТА Отгонка серной кислоты К диализатам прибавляют медные опилки и нагревают. При этом образуется ангидрид сернистой кислоты SO2, который отгоняют и собирают в приемник, содержащий раствор иода. При взаимодействии ангидрида сернистой кислоты с водой и иодом образуется серная кислота: 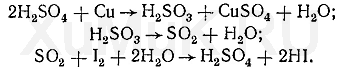 Для обнаружения серной кислоты в дистилляте применяют реакции с хлоридом бария, ацетатом свинца и родизонатом натрия. Реакция с хлоридом бария. К 3—5 каплям дистиллята прибавляют 1—2 капли 5 %-го раствора хлорида бария. Появление белого осадка сульфата бария указывает на наличие серной кислоты в дистилляте. Реакция с ацетатом свинца. К нескольким каплям дистиллята прибавляют 2—3 капли 3 %-го раствора ацетата свинца. При наличии серной кислоты выпадает белый осадок сульфата свинца, который не растворяется в азотной кислоте, но растворяется в едких щелочах и в растворе ацетата аммония при нагревании: 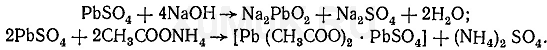 Реакция с родизонатом натрия основана на том, что родизо-нат натрия с солями бария образует родизонат бария, имеющий красную окраску. От прибавления серной кислоты или сульфатов к родизонату бария он разлагается. При этом образуется осадок сульфата бария и исчезает красная окраска родизоната: 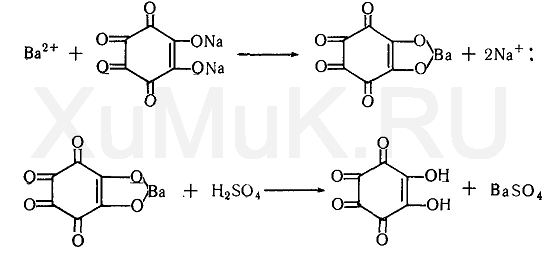 АЗОТНАЯ КИСЛОТА При отравлениях концентрированной азотной кислотой поражаются ткани языка, пищевода, слизистая желудка, а иногда и кожа лица, которые приобретают желтую окраску. Если произошло отравление азотной кислотой, концентрация которой ниже 20 %, то желтая окраска кожи и других тканей может не появиться. Выделение азотной кислоты из биологического материала. Для выделения азотной кислоты из органов и тканейтрупов их измельчают, заливают дистиллированной водой. Полученную смесь настаивают в течение 1—2 ч, затем отфильтровывают вытяжку, которую подвергают диализу. При наличии азотной кислоты полученный диализат должен иметь кислую реакцию и давать положительные реакции на нитрат-ионы. Реакция с дифениламином основана на окислении дифениламина азотной кислотой. При этом вначале образуется бесцветный дифенилбензидин, который при дальнейшем окислении превращается в соединение, имеющее синюю окраску. Реакция с бруцином. На часовое стекло или капельную пластинку наносят несколько капель дистиллята и прибавляют 2— 3 капли 0,02 %-го свежеприготовленного раствора бруцина в концентрированной серной кислоте. При наличии азотной кислоты в исследуемом растворе появляется красная окраска. Такую же окраску с бруцином дают нитриты, перхлораты и некоторые другие окислители. Удаление нитритов из исследуемых растворов. Перечисленные выше реакции с дифениламином и бруцином на азотную кислоту дает и азотистая кислота. 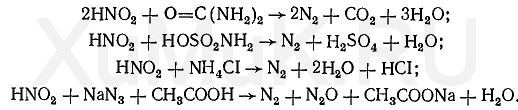 СОЛЯНАЯ КИСЛОТА Свободная соляная кислота в небольших количествах содержится в желудочном соке, а ее соли — в тканяхорганизма. При исследовании биологического материала на наличие соляной кислоты исследуемые объекты измельчают, заливают дистиллированной водой, настаивают 1—2 ч и фильтруют, полученный фильтрат подвергают диализу. Диализат проверяют на наличие соляной кислоты при помощи реакции с нитратом серебра. При положительной реакции с нитратом серебра (образование белого осадка хлорида серебра) соляную кислоту отгоняют из диализата. При этом отгоняется свободная соляная кислота, а ее соли остаются в растворе. Реакция с нитратом серебра. К 1—2 мл дистиллята прибавляют 1—2 капли 5 %-го раствора нитрата серебра и 1 мл разбавленной азотной кислоты. Появление белого осадка хлорида серебра, растворимого в аммиаке, указывает на наличие соляной кислоты в дистилляте. Реакция с хлоратом калия. К 1 мл дистиллята прибавляют несколько кристалликов хлората калия (КСlО 3 ) и нагревают. При наличии соляной кислоты в дистилляте выделяется свободный хлор, который можно обнаружить по посинению иод-крахмальной бумажки: 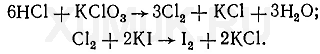 ГИДРОКСИД КАЛИЯ Ярко выраженная щелочная реакция водных вытяжек из биологического материала или диализатов, отсутствие карбонатов и присутствие в вытяжках ионов калия указывают на наличие гидроксида калия в биологическом материале. Реакция с гидротартратом натрия. Гидротартрат натрия в нейтральных или уксусно-кислых растворах с ионамикалия дает белый кристаллический осадок КНС4Н4О6. Этот осадок растворяется в горячей воде, минеральных кислотах и щелочах. Потирание стенок пробирки стеклянной палочкой ускоряет выпадение осадка. Реакция с кобальтинитритом натрия. Кобальтинитрит натрия Na3[Co(NO2)6 ] из нейтральных или слабокислых растворов осаждает ионы калия в виде желтого кристаллического осадка K2Na[Co(NO2 )6]. В сильнокислой среде происходит разложение реактива с образованием нестойкой кислоты Н3[Со(МО2)6], а в щелочной среде при разложении реактива образуется осадок Со(ОН) 3. Потирание стенок пробирки стеклянной палочкой ускоряет выпадение осадка. Реактив должен быть свежеприготовленным. ГИДРОКСИД НАТРИЯ При отравлении гидроксидом натрия водные вытяжки из биологического материала или диализаты имеют ярко выраженную щелочную реакцию и в них содержатся ионы натрия. Наличие ионов натрия в диализатах определяют при помощи реакций с гидроксостибиатом калия (антимонатомкалия) и с цинк-уранилацетатом. Реакция с гидроксостибиатом калия. Одним из реактивов на ионы натрия является гидроксостибиат калия, которому в литературе приписывается несколько формул: KSbO 3 ·3H 2 O, KH 2 SbO 4, K[Sb(OH) 6 ]. Этот реактив в нейтральной или слабощелочной среде с ионами натрия дает белый кристаллический осадок Na[Sb(OH) 6 ]. Осадок гидроксостибиата (антимоната) натрия растворяется в горячей воде и в щелочах. В кислой среде происходит разложение реактива с образованием аморфного осадка метасурьмяной кислоты HSbO 3. Реакция с цинк-уранилацетатом. Уранилацетат UO2(СН3СОО) 2 в нейтральных или уксусно-кислых растворах с солями натрия дает зеленовато-желтый кристаллический осадок NaUO2(CH3COO)3. Чувствительность этой реакции повышается в присутствии ионов цинка или магния. Поэтому в качестве реактива на ионы натрия применяют раствор цинк-уранилацетата Zn(UO2)3(СH3COO)8. Этот реактив с ионами натрияобразует кристаллический осадок NaZn(UO2)3(СН3СОО)9. |
