лекции токсикхим. Лекция Предмет, разделы и задачи токсикологической химии. Пищеварение и метаболизм посторонних веществ ядов. Вещества, которые изолируются минерализацией биологического материала (металлические яды)
 Скачать 1.52 Mb. Скачать 1.52 Mb.
|
|
Галогенпроизводственные алифатического ряда Летальные дозы для них такие: хлороформ СHCl3 = 50—70 граммов; четыреххлористый углерод СCl4 = 20—50 мл; По токсическому действию: хлороформ и хлоралгидрат являются наркотиками. Они сначала возбуждают, а затем парализуют нервную систему; четыреххлористый углерод действует на организм подобно хлороформу, но медленнее и вызывает значительные нарушения в органах: в печенке, почках наблюдается жировое перерождение; дихлорэтан по наркотическим действиям — самый сильный из ядовитых галоидпроизводных. Отравление этими веществами сопровождается рвотой, поносом, вздутием живота, увеличением и болезненностью печени, анурией. Метаболизм изучен недостаточно, конечным результатом метаболических пpoцесов является углерод диоксид и хлористоводородная кислота: Особенностью изолирования галогенпроизводных ядов алифатического ряда является способность перегнаться уже в neрвые порции дистиллята. При значительных количествах ядов (> 1 грамма) в дистилляте наблюдаются капли жидкости, которые несмешиваются с водой. Анализ начинают из общей (неспецифической) и низькочувствительной реакции на Сl из AgN03 после отделения органически связанного хлора, которую дают все галоидпроизводные. На протяжении 4 часов нагревают в запаянной ампуле. Наблюдается белый осадок или белая муть в растворе: Если не отмечается появление мути или осадка, то проводится реакция Фудживара, основанная на образовании полиметина, — чувствительная, неспенифическая. Методика перегонки с водяным паром Измельченный биоматериал помещают в колбу и смешивают с водой до однородной массы. Подкисляют винной или щавелевой кислотой. Через присоединенный парообразователь насыщают паром. После этого пар поступает через водяной холодильник в приемник. Этим методом перегоняются как вещества растворимые в воде: - синильная кислота, метанол, этанол, уксусная кислота и т.д. так и труднорастворимые: - хлороформ, четыреххлористый углерод, дихлорэтан, изоамиловый спирт и др. В первых порциях дистиллята, при их наличии будут присутствовать: - синильная кислота, метанол, этанол. Галогенводороды нашли применение в промышленности, медицине, быту. Поэтому мы изучили наиболее характерные представители этой группы: хлороформ, четыреххлористый углерод, дихлорэтан, хлоралгидрат. Общей качественной реакцией для всех перечисленных галогенуглеводородов является реакция отщепления органически связанного хлора и определения ионов хлора нитратом серебра. Исследование галогенпроизводных углеводородов. Хлороформ Хлороформ Качественное определение 1. Отщепление хлора и определение ионов хлора нитратом серебра: CHCl3 + 4NaOH 2NaCl + HCOONa + 2H2O NaCl + AgNO3 AgCl↓ + NaNO3 2. Как видно из предыдущей реакции, при отщеплении органически связанного хлора, одним из продуктов реакции является формиат натрия, который определяют с реактивом Фелинга:  2Cu(OH)2 + HCOONa Cu2O↓ + CO2 + 2H2O + NaOH желтый → красный цвет 3. Образование изонитрила. Проводят с первичными аминами с последующим прибавлением щелочи при нагревании – неприятный запах:  4. Реакция с пиридином в щелочной среде. Образуется глутаконовый альдегид – красного цвета: 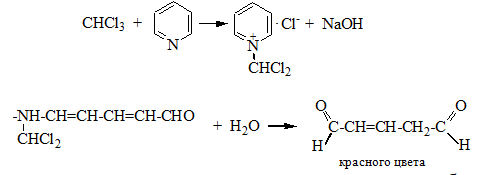 Эта реакция применяется для предварительного обнаружения галогенуглеводородов. 5. С резорцином – малиновое окрашивание.  Количественное определение Все галогенуглеводороды количественно определяют аргентометрически по хлорид-иону. Токсикологическое значение Применяется в промышленности как растворитель и экстрагент. Отравления – при вдыхании через пищеварительный тракт. Легкая степень – сознание затемнено, понижение слуха, косоглазие с диплопией. Средняя тяжесть – тоже, что и при легкой, только с тошнотой, рвотой, болями головы, поносом. Тяжелая – судороги, кома, нефропатия, перерождение печени. Смерть наступает от оттека легких. Антидотов нет. Метаболизм – СО2 и НCl. Выделяют в неизменном виде из легких – 9%. Четыреххлористый углерод Прозрачная жидкость со своеобразным запахом (т. кип. 75—77 °С). Он смешивается в любых соотношениях с ацетоном, бензолом, бензином, сероуглеродом и другими органическими растворителями. В воде при 20 °С растворяется около 0,01 % четыреххлористого углерода. Четыреххлористый углерод не огнеопасен, его пары в несколько раз тяжелее воздуха. Обнаружение четыреххлористого углерода Реакция отщепления хлора. Четыреххлористый углерод можно обнаружить по наличию в его молекуле атомов хлора. Выполнение этой реакции описано выше. CCl4 + 4NaOH = 4NaCl + CO2 + 2H2O NaCl + AgNO3 = AgCl (осадок белого цвета) + NaNO3 Реакция Фудживара. При нагревании СCl4 с пиридином в присутствии щелочи появляется красная окраска. Реакция образования изонитрила. Четыреххлористый углерод при взаимодействии с анилином образует изонитрил, имеющий неприятный запах. Реакция с резорцином. При нагревании ССl4 с резорцином в присутствии щелочи появляется розовая или малиново-красная окраска. С 2,7-диоксинафталином: Светло-бурое → зелено-желтое окрашивание. Отличительные реакции представлены в таблице (Крамаренко). Токсикологическое значение CCl4 – растворитель, экстрагент. Попадает – на кожу, ЖКТ, легкие. Накапливается – жировая ткань, печень, мозг, костный мозг, почки. Выделяется – через легкие, с мочой. Далее перерождение клеток печени, почек. Легкая степень отравления: раздражение глазных яблок, головокружение, головная боль. Массивное отравление: тошнота, рвота, понос, боли в животе, желудочно-кишечные кровотечения, головная боль, головокружение, спутанное сознание, сонливость, расстройство зрения, судороги, кома – смерть за счет остановки дыхания, сердца. Антидотов нет. Хлоралгидрат Хлоралгидрат Качественное определение 1. Отщепление хлора. CCl3СОH + NaOH НСCl3 + HCOONa Как видно из этой реакции хлоралгидрат при отщеплении атома хлора образует хлороформ, поэтому он дает все те же реакции, что и хлороформ. 2. С реактивом Несслера. Эта реакция позволяет отличить хлоралгидрат от остальных галогенуглеводородов. CCl3СОH + K2[HgI4] + 3KOH Hg↓ + СCl3COOK + 4KI + 2H2O Обличить его можно экстракцией из дистиллята диэтиловым эфиром. При его присутствии в дистилляте в выпарительной чашке характерное кристаллическое вещество – сухой остаток хлоралгидрата. Токсикологическое значение Применяется в медицине – успокаивающее, снотворное, противосудорожное. Накопление, симптомы – похожи на действие хлороформа. Метаболизм – трихлорэтанол, трихлоруксусная кислота. Выводится – с мочой в виде глюкуронида. Антидотов нет. Дихлорэтан Дихлорэтан Качественное определение 1. Реакция отщепление органически связанного хлора. В зависимости от условий проведения этой реакции образуется разные продукты, на которые проводят соответствующие реакции. 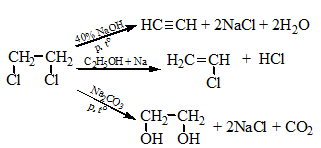 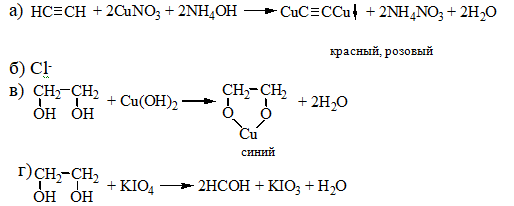 Выделившийся формальдегид определяют реакциями: 1. С хромотроновой кислотой:  фиолетовая 2. С фуксинсернистой кислотой: 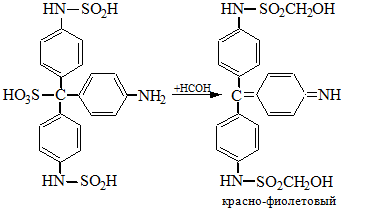 3. С резорцином: 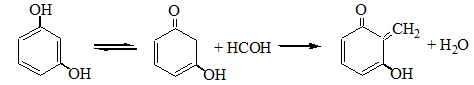 4. С метиловым фиолетовым – синее окрашивание. 5. С кодеином и серной кислотой – синее окрашивание. 6. С реактивом Фелинга – сказано выше. 7. С аммиачным раствором нитрата серебра. 2[Ag(NH3)2]NO3 + HCOH + H2O 2Ag + HCOONH4 + 2NH4NO3 + NH3 Токсикологическое значение С2Н4Cl2 – применяется – как растворитель, экстрагент, в кожевенной промышленности. Системный яд. Попадает через легкие, кожу, ЖКТ. Поражает: ЦНС, печень, почки, сердечную мышцу. Расстройства: нервные, кишечные. Метаболиты – неизвестны. Антидотов нет. Обнаружение и определение спиртом имеющих токсикологическое значение К спиртам, которые имеют значение при отравлениях, относятся – метанол, этанол, изоамиловый, этиленгликоль (двухатомный спирт). Схема анализа дистиллята химическим методом на ацетон, метанол, этанол Обнаружение ацетона Ацетон СН 3 —СО—СН 3 (диметилкетон, пропанон) — бесцветная подвижная жидкость (т. кип. 56,3 °С) с характерным запахом. Он смешивается с водой, этиловым спиртом и диэтиловым эфиром во всех соотношениях. Из водных растворов ацетон высаливается хлоридом натрия, хлоридом кальция, карбонатом калия (жидкость разделяется на два слоя). Ацетон хорошо растворяет соли многих неорганических кислот и ряд органических соединений. Ацетонполучают при сухой перегонке дерева, каменного угля, а также путем синтеза. Метаболизм. Незначительная часть ацетона, поступившего в организм, превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом. Некоторое количество ацетона выделяется из организма в неизменном виде с выдыхаемым воздухом и через кожу, а некоторое — с мочой. Обнаружение ацетона В химико-токсикологическом анализе для обнаружения ацетона применяют реакции с растворами иода, нитропруссида натрия, фурфурола, о -нитробензальдегида и метод микродиффузии. Реакция образования йодоформа. При взаимодействии ацетона с раствором иода в щелочной среде образуется йодоформ: 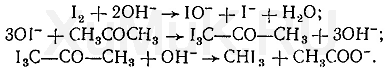 Выполнение реакции. К 1 мл исследуемого раствора прибавляют 1 мл 10 %-го раствора аммиака и несколько капель раствора иода в иодиде калия. В присутствии ацетона образуется желтый осадок йодоформа с характерным запахом, а его кристаллы имеют характерную форму. Предел обнаружения: 0,1 мг ацетона в пробе. Эту реакцию дает и этиловый спирт. Реакция с нитропруссидом натрия. Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску. При подкислении уксусной кислотой окраска переходит в красно-фиолетовую: 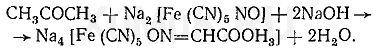 С нитропруссидом натрия окрашенные соединения образуют вещества, содержащие енолизируемые СО-группы Кетоны, в молекулах которых отсутствуют метильные или метиленовые группы, связанные с СО-группами, не дают этой реакции. Реакция с о -нитробензальдегидом. При взаимодействии ацетона с о-нитробензальдегидом в щелочной среде образуется индиго, имеющее синюю окраску: 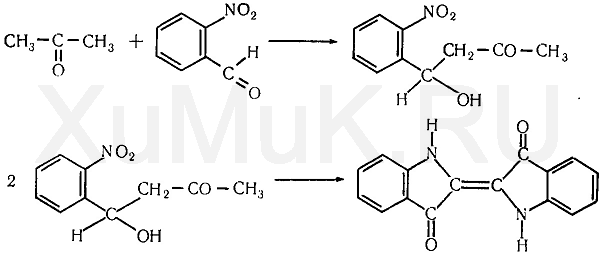 Метиловый спирт Метиловый спирт (метанол) — бесцветная жидкость (т. кип. 64,5 °С, плотность 0,79), смешивающаяся во всех соотношениях с водой и многими органическими растворителями. Метаболизм. Метиловый спирт, поступивший в организм, распределяется между органами и тканями. Наибольшее количество его накапливается в печени, а затем в почках. Меньшие количества этого спирта накапливаются в мышцах, жире и головном мозгу. елями. Обнаружение метилового спирта Реакция образования метилового эфира салициловой кислоты. При наличии метилового спирта в исследуемом растворе ощущается характерный запах метилового эфира салициловой кислоты: 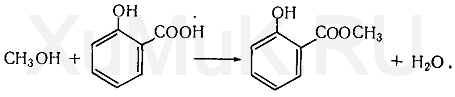 Окисление метилового спирта. Большинство реакций обнаружения метилового спирта основано на окислении его до формальдегида и определении последнего при помощи реакций окрашивания. Прежде чем приступить к окислению метилового спирта до формальдегида, необходимо проверить наличие этого альдегида в исследуемом растворе. Для окисления метилового спирта в формальдегид применяют перманганат калия или другие окислители: 5СН 3 ОН + 2КMnО 4 + 3H 2 SO 4 ---> 5НСНО + 2MnSO 4 + K 2 SO 4 + 8Н 2 О. При взаимодействии ионов марганца с избытком перманганата калия может образоваться оксид марганца (IV): 3Mn 2+ + 2MnO 4 - + 2Н 2 О ---> 5MnO 2 + 4Н +. Для связывания избытка перманганата калия и оксида марганца (IV) прибавляют сульфит натрия или другие восстановители (гидросульфит натрия, щавелевую кислоту и др.). Этиловый спирт Этиловый спирт С2Н5ОН (этанол, этиловый алкоголь, винный спирт) — бесцветная, летучая жидкость с характерным запахом, жгучая на вкус (пл. 0,813—0,816, т. кип. 77—77,5 °С). Этиловый спирт горит синеватым пламенем, смешивается во всех соотношениях с водой, диэтиловым эфиром и многими другими органическими растворителями, перегоняется с водяным паром. Действие на организм и токсичность. Этиловый спирт может поступать в организм несколькими путями: при приеме внутрь, при внутривенном введении, а также через легкие в виде паров с вдыхаемым воздухом. Обнаружение этилового спирта При исследовании органов трупов (желудок с содержимым, печень, почки и др.) на наличие этилового спирта его отгоняют с водяным паром. Обнаружение этилового спирта производят при помощи описанных ниже реакций. Для обнаружения этилового спирта в крови и моче применяют метод газожидкостной хроматографии. Реакция образования йодоформа. При нагревании этилового спирта с раствором иода и щелочью образуется йодоформ, имеющий специфический запах: 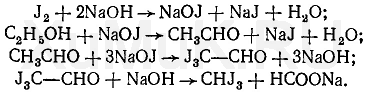 Реакция образования уксусно-этилового эфира. Этиловый спирт с ацетатом натрия в присутствии серной кислоты образует уксусно-этиловый эфир, имеющий характерный запах: 2CH3COONa + 2C2H5OH + H2SO4 ---> 2СН3СООС2Н5 + Na2SO4 + 2H2O Реакция образования этилбензоата. При взаимодействии этилового спирта с бензоилхлоридом (хлористым бензоилом) образуется этилбензоат, имеющий характерный запах: 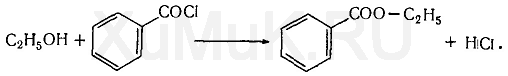 Реакция образования ацетальдегида. Этиловый спирт окисляется дихроматом калия, перманганатом калия и некоторыми другими окислителями до ацетальдегида: ЗС2Н5ОН + К2Cr2O7, + 4H2SO4 ---> 3СН3СНО + Cr2(SO4)3 + K2SO4 + 7R2O Схема анализа дистиллята химическим методом на фенолы, уксусную кислоту изоамиловый спирт, этиленгликоль, тетраэтилсвинец Анализ смеси второго и третьего дистиллята Остаток второго дистиллята смешивают с третьим дистиллятом и опять проводят анализ на галлоидпроизводные и формальдегид. С частью дистиллята, которая осталась, выполняют анализ на фенол и изоамиловий спирт. Фенол Фенол представляет собой тонкие длинные игольчатые кристаллы или бесцветную кристаллическую массу со своеобразным запахом. На воздухе он постепенно розовеет. Фенол растворяется в воде в соотношении 1 : 20, легко растворяется в этиловом спирте, диэти-ловом эфире, хлороформе, жирных маслах, растворах едких щелочей. |
