лекции токсикхим. Лекция Предмет, разделы и задачи токсикологической химии. Пищеварение и метаболизм посторонних веществ ядов. Вещества, которые изолируются минерализацией биологического материала (металлические яды)
 Скачать 1.52 Mb. Скачать 1.52 Mb.
|
|
Способы «маскировки» мешающих ионов 1. Комплексообразование. В такой cпocоб мешающие ионы связывают в бесцветные стойки комплексы. Для маскировки используют цианиды, фториды, фосфаты, тиосульфат, тиомочевину, трилон Б, аскорбиновую кислоту, гидроксиламин. Например, реакции на Со2+ с роданидом мешают Fe3+, потому добавляют растворы фторидов или фосфатов, которые связывают Fe3+ в бесцветные комплексы [FeF6]3- или [Fe(PО4)2]3-. 2. Оперирование малыми объемами или большими разведеннями минерализата для устранения влияния эндогенных ионов металлов; с этой целью минерализат сразу разводят до 180 мл и используют небольшие порции для выявления отдельных ионов: для Мn2+ — 1; Сu2+ - 3; Bi+ - 10 мл и так далее 3. Вариирование рН среды. Таким путем комплексы дитизоном свинца образуются только в щелочной среде, в кислой среде комплексы из дитизоном образуют ртуть и серебро, при сильном подкислении серебра дитизонат разрушается, а ртуть дитизонат — нет. 4. Применение реакции окисления. Перманганат-иoн переводят в ион марганца (II) при выявлении хрома по реакции с дифенилкарбазидом. 5. Использование ряда активности диэтилдитиокарбаминатив (ДДТК) — свинец из ДДТК вытесняется медью, медь — ртутью СХЕМА АНАЛИЗА МИНЕРАЛИЗАТА НА «МЕТАЛЛИЧЕСКИЕ» ЯДЫ ПО О. М. КРИЛОВОЙ. ОБНАРУЖЕНИ РТУТИ В ДЕСТРУКТАТИ 1. Отделение осадков PbSО4 и BaSО4от основного объема минерализата — фильтрат I. 2. Промывание осадка водой, подкисленной серной кислотой, - для удаления соосадженных ионов Fe3+; Cu2+; Zn2+; Cd2+ и др. Если осадок имеет грязно-зеленый цвет, его промывают аммония персульфатом (для отмывания от Сг3+). Для разделения бaрия и свинца сульфатов осадок обрабатывают горячим раствором аммонию ацетата, PbSО4 растворяется — фильтрат II: 2PbSO4 + 2CH3COONH4 = [Pb(CH3COO)2·PbSO4] + (NH4)2 SO4 Исследование осадка бария сульфата. Перекристаллизации бария сульфата c концентрированной серной кислота. Реакция чувствительна, при негативном результате исследования на барий можно закончить. Реакция получения осадка бария йодату: BaSO4 + 2C = BaS + 2CO2 окрашивание пламени горелки в зеленый цвет, BaS + 2HCl = BaCl2 + H2S Ba2+ + 2IO3- Ba(IO3)2 характерные бесцветные кристаллы. Реакция высокочувствительна, обнаружению бария не мешают другие элементы. Исследование фильтрата IІ на Рb2+. Реакция с хлороформным раствором дитизона в щелочной среде (рН = 7,5—8,0); наблюдают красную расцветку хлороформного слоя. Реакция предварительная: при негативном результате исследования заканчивают, при позитивном — проводят подтверждающие реакции. После реэкстракции Рb2+ в водную фазу проводят реакции образования осадков PbS; PbSO4;PbCrO4; РbI2, наблюдая при этом соответственно черный, белый, оранжево-желтый и желтый осадки; даны реакции подтверждающие. Проводят так же реакцию с родизонатом натрия: Схема дробного анализа минерализата на «металлические яды»: марганец, хром, серебро, медь и цинк. Исследование фильтрата I Выявление марганца Мn2+. Используют две специфических реакции окисления Мn2+ c помощью калия перйодата и аммония персульфата до перманганат-иoнов, которые имеют фиолетовую окраску. В реакции с калия перйодатом для маскировки ионов, которые мешают реакции (ионы Fe3+), используют натрия дигидрофосфат:  Реакция высокочувствительна (обнаруживает эндогенный марганец), имеет самостоятельное значение при отрицательном результате, при положительном — выполняют подтверждающую реакцию:  Реакция проходит при наличии катализатора — серебра нитрата, для маскировки Fe3+ используют дигидрофосфаты. Обнаружение Сг Выявление Сг3+. Реакция с дифенилкарбазидом высокочувствительна, но не специфическая. Для маскировки ионов, которые мешают (железо, сурьма), добавляют фосфат ионы перманганата возобновляют с помощью натрия азида.  Реакции окисления Сг3+ до надхромовых кислот, которые имеют синюю окраску и более стойкие в органических растворителях, чем в воде: 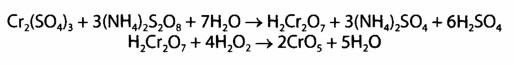 Данная реакция специфическая для хрома. Выявление Сu Выявление Сu2+. Реакция из (ДДТК)2РЬ — специфический реактив на Сu2+ (в соответствии с правилом рядов Тананаева свинец витесняют из комплекса, кроме меди, только серебро и ртуть). Наблюдается желто-коричневая окрашивание хлороформного слоя. 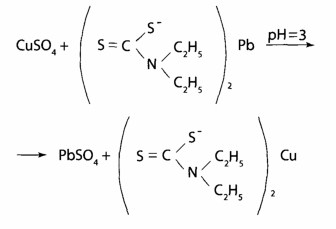  При положительном результате реакции реэкстрагируют медь в водный слой с помощью HgCl2 и проводят подтверждающие исследование. 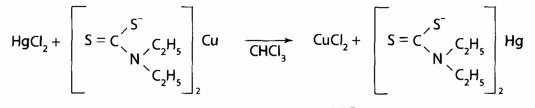  Реакция с пиридин-родановым реактивом: 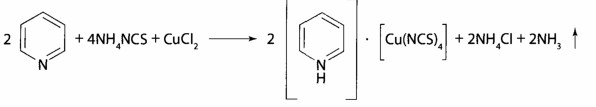  образуется изумрудно-зеленый осадок, который растворяется в хлороформе. Реакция с калию гексацианофератом (II):   Выявление Ag+ Выявление Ag+. Образование серебра дитизоната в сернокислой среде, наблюдают золотисто-желтую окраску хлороформного слоя. Для того, чтобы отличить от ртути дитизоната, окрашенного в оранжево-желтый цвет, серебра дитизонат разрушают 0,5 н раствором соляной кислоты; ртути дитизонат в этих условиях не изменяется. 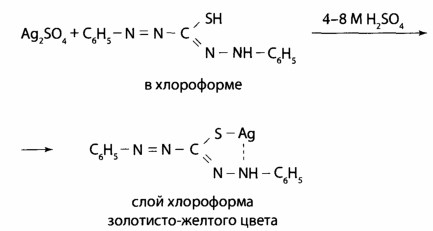  При позитивном результате этой реакции серебро осаждают из всего объема минерализата в виде AgCl. Осадок фильтруют и проводят подтверждающие исследование. Для этого его обрабатывают раствором аммиака:  Потом проводят реакцию с азотной кислотой, наблюдают образование белого осадка. При взаимодействии с калия йодидом выпадает желтый осадок. Во время реакции с тиомочевиной и калия пикратом образуются желтые призматические кристаллы.   Обнаружение Zn Реакция с дитизоном (предварительная). К 0,5 мл минерализата прибавляют 0,25 мл насыщенного раствора тиосульфата натрия, устанавливают рН=4,5-5,0 (по универсальному индикатору) с помощью ацетатного буферного раствора, добавляют 2 капли 0,01 % раствора дитизона в хлороформе и 1 мл хлороформа. Полученный раствор энергично встряхивают. При наличии ионов цинка слой хлороформа окрашивается в розовый или красно-фиолетовый цвет. 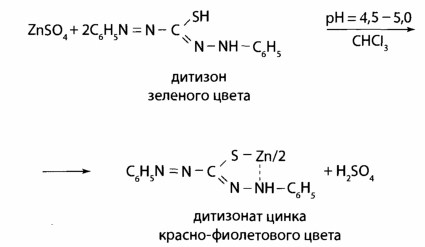  Оценка. Реакцией можно обнаружить в 100 г исследуемого объекта 5 мг цинка. Реакция имеет судебно-химическое значение при отрицательном результате. Выделение цинка из минерализата, К 10 мл минерализата добавляют 4 мл раствора калия-натрия тартрата или 20% раствор лимонной кислоты (для маскирования железа), 1 мл насыщенного раствора тиомочевины (или тиосульфата натрия) для маскирования ионов кадмия и меди и доводят pH до 8,5 (по универсальному индикатору) с помощью 10% раствора гидроксида натрия. Смесь взбалтывают с 3 мл 1% раствора диэтилдитио- карбамата натрия и 5 мл хлороформа. Слой хлороформа отделяют, промывают 10 мл воды и встряхивают с 3 мл 1 М раствора хлороводородной кислоты. Водную фазу (реэкстракт), содержащую хлорид цинка, отделяют и исследуют. 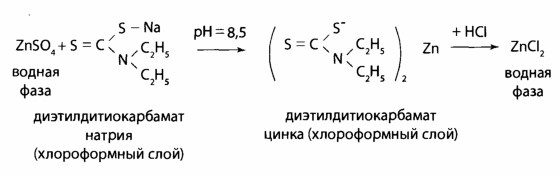  Реакция с гексацианоферратом(П) калия. К 1 мл реэкстракта добавляют 10% раствор гидроксида натрия до рН=5 (по универсальному индикатору) и 2 капли 5% раствора гексацианоферрата(И) калия. Образуется осадок или муть белого цвета.   Реакция с сульфидам натрия. К 1 мл реэкстракта прибавляют 10% раствор гидроксида натрия до рН=5 (по универсальному индикатору) и 3-4 капли свежеприготовлешюго 5% раствора сульфида натрия. Образуется осадок или муть белого цвета. Реакция с тетрароданамеркуроатам аммония. 3-4 капли реэкстракта выпаривают досуха на предметном стекле. Сухой остаток растворяют в капле 10% раствора уксусной кислоты и прибавляют каплю раствора тетрароданомеркуроата аммония. В присутствии ионов цинка образуются бесцветные одиночные клиновидные кристаллы или дендриты  Схема дробного анализа минерализата на «металлические яды»: кадмий, таллий, висмут, стибиум и арсен Выявление ионов кадмий КАДМИЙ. Распространение и применение. В 1818 году немецкий химик и фармацевт, профессор Теттингенского университета опубликовал подробные сведения о новом химическом элементе – кадмии, который занимает в периодической системе элементов Д.И. Менделеева №48. Кадмий применяется в промышленности при добыче легкоплавких сплавов, замене висмута в типографическом шрифте или замене олова при эмалировке посуды. Оксид кадмия, соли кадмия и сплавы используются в производстве сухих никелево-кадмиевых аккумуляторов и батареек, при паянии и изготовлении светящихся красок и пластиковых красителей. Металлический кадмий используется для изготовления регулировочных стержне в атомных реакторах, потому что хорошо поглощает тепловые нейтроны. Подверженность воздействию кадмия связана с его использованием в промышленности при производстве сплавов, кадмиевом покрытии металлов. При нагревании , размоле, сварке, спайке содержащих кадмий металлических изделий человек вдыхает пыль и пары, что часто является причиной отравления. В основном люди подергаются воздействию соединениями кадмия при приеме пищи, воды, вдыхании воздуха и при курении сигарет (одна пачка в среднем содержит 1,9 мкг кадмия). Ежедневное потребление кадмия организмом в количестве 2-200 мкг в пересчете на металл, считается нормальным. Аккумуляция кадмия организмом человека, начиная от рождения, предположительно способствует возникновению гипертонии. Тем более, в 1968 году в научной литературе появилась статья «Кадмий и сердце». В ней говорилось, что служба здравоохранения США обнаружила зависимость между содержанием кадмия в атмосфере и частотой смертельных случаев от сердечно-сосудистых заболеваний. Предельно допустимая концентрация для кадмия в воздухе в виде пыли или дыма не должна превышать 0,01 мг/м3, тем более, что это соединение отнесено к канцерогенным веществам. Концентрация в крови. Концентрация кадмия в сыворотке крови, у людей которые не подвергаются его воздействию, находится в пределах от 0,5 до 2,0 мкг/л. содержание кадмия в цельной крови вдвое больше. При этом не наблюдалось разницы в зависимости от пола и возраста человека. Содержание кадмия в крови у курящих людей 1,1 мкг/л, а у некурящих – 0,4 мкг/л. Концентрация кадмия у рабочих, подвергавшихся воздействию данным металлом и не имеющих признаков отравления – 9,0 мкг/л. Концентрация в крови у рабочих занятых кадмированием металлов и получением его сплавов в среднем находится в пределах от 1,0 до 113 мкг/л. Метаболизм и выделение. Кадмий, попадающий в организм человека при вдыхании пыли, паров, с продуктами, водой, при курении накапливается в легких, печени, почках и медленно выводится с мочой. Постепенное выведение ионов металла связано с наличием в указанных органах малого белка металлотионеина, который в качестве кофактора имеет ион кадмия. Уровень кадмия в почках хорошо коррелируется с возрастом людей. При исследовании трупов людей, которые обрабатывали минералы, содержащие кадмий, уровень металла в печени в среднем составлял 2,0 мг/кг, в почках – 11,7 мг/кг. Содержание кадмия в моче в норме составляет 0,1-0,2 мкг/мл, но этот показатель увеличивается у курящих людей. В случае если концентрация кадмия в рабочей зоне производственных помещений составляет 0,01 мг/м3 его содержание в моче составляет 3,7 мкг/л. Концентрация кадмия у людей в норме (мг/л или мг/кг)
Токсичность. Индустриальное загрязнение прибрежных вод кадмием приводит к накоплению металла в устрицах, крабах и других морских животных. Это приводит к отравлению кадмием и вызывает болезнь «итай-итай», получившую наиболее широкое распространение в Японии. Повреждение почек ведет к нарушениям метаболизма кальция и фосфора, что вызывает деформацию скелета, тяжелому повреждению нижних конечностей и болям в спине. Исследователи установили, что концентрация кадмия в пределах 100-140 мг/кг в мозговом веществе почек является критической для проявления токсичности кадмия. Попадание кадмия в организм человека с парами и дымом вызывает признаки усталости, кашель, боль в груди, ощущение жжения в горле. Уровень кадмия в моче в этих случаях составляет 10-50 мкг/л. Такая небольшая доза как 4 мг кадмия при попадании в организм человека через дыхательные пути является фатальной. Смертельная доза при пер оральном введении составляет несколько сотен миллиграмм в виде растворимой соли. При этом концентрация металла в печени составляла 128 мг/кг, в печени – 180 мг/кг. Обнаружение кадмия в минерализате Исследование минерализата на наличие ионов кадмия основано на экстракции его хлороформом в виде диэтилдитиокарбамината (ДДТК)2Сd при рН 12. полученное внутрикомплексное соединение разлагают хлороводородной кислотой и наличие ионов кадмия в водном растворе подтверждается химическими реакциями. Выделение ионов кадмия из минерализата. Вначале из минерализата выделяют ионы кадмия, т.к. там помимо исследуемого соединения содержится ряд ионов, которые могут мешать ходу анализа. С этой целью к минерализату прибавляют диэтилдитиокарбамат натрия ДДТК-Na, который с ионами кадмия образует устойчивые внутрикомплексные соединения (ДДТК)2Сd:  С ДДТК-Na образуют комплексные соединения и другие, находящиеся в минерализате ионы(Fe3+, Cu2+, Zn2+). Их влияние устраняют введением сегнетовой соли (тартрат калия-натрия). Введение глицерина в реакционную смесь обеспечивает более полное выделение Сd2+, а прибавление гидроксида натрия – отделение Cd2+ от Zn2+ (образование сравнительно прочного цинката натрия. Образовавшийся (ДДТК)2Сd экстрагируют хлороформом, а затем разлагают хлороводородной кислотой. В солянокислом растворе определяют наличие ионов кадмия следующими реакциями С ДДТК-Na образуют комплексные соединения и другие, находящиеся в минерализате ионы(Fe3+, Cu2+, Zn2+). Их влияние устраняют введением сегнетовой соли (тартрат калия-натрия). Введение глицерина в реакционную смесь обеспечивает более полное выделение Сd2+, а прибавление гидроксида натрия – отделение Cd2+ от Zn2+ (образование сравнительно прочного цинката натрия. Образовавшийся (ДДТК)2Сd экстрагируют хлороформом, а затем разлагают хлороводородной кислотой. В солянокислом растворе определяют наличие ионов кадмия следующими реакциями Методы качественного обнаружения ионов кадмия: 1. Реакция с сульфидом натрия. К исследуемому солянокислому раствору добавляют по каплям 2.5н раствор гидроксида натрия до рН=5 (по универсальному индикатору) и свежеприготовленный 5% раствор сульфида натрия. При наличии ионов кадмия в растворе выпадает желтый осадок CdS. Cd2++S2-→CdS↓ Предел обнаружения: 50 мкг ионов кадмия в пробе. Граница обнаружения: 2 мг ионов кадмия в 100 г биологического материала. При отрицательном результате этой реакции дальнейшие исследования водной фазы на наличие ионов кадмия не производят. При положительной реакции дополнительно проверяют наличие ионов кадмия в водной фазе. 2. Реакция с гексацианоферратом (II) калия. Исследуемый раствор с помощью 2.5н раствора гидроксида натрия доводят до рН=5 (по универсальному индикатору) и к смеси добавляют 5% раствор гексацианоферрата (II) калия. При наличии ионов кадмия в растворе выпадает белый осадок. 3Cd2++2[Fe(CN)6]4-+2K+→K2Cd3[Fe(CN)6]2↓ Дополнительные реакции основаны на обнаружении ионов кадмия микрокристаллоскопическими реакциями: 1. Каплю исследуемого раствора наносят на предметное стекло и упаривают досуха, добавляют каплю насыщенного раствора бруцина в разбавленной серной кислоте, каплю 5% раствора бромида калия – в присутствии ионов кадмия образуется бесцветные призматические кристаллы в виде сфероидов. 2. На предметное стекло наносят каплю исследуемого раствора, упаривают досуха и на остаток наносят каплю 5% раствора бромида калия и каплю пиридина – выделяются бесцветные призматические кристаллы в виде сфероидов. Микрокристаллоскопическими реакциями можно обнаружить 0,2 мг кадмия в 100 г биологического материала Количественное определение. 1. Объемный метод. Комплексометрическое титрование ионов кадмия основано на выделении его из минерализата в виде (ДДТК)2Сd, реэкстракции с помощью раствора хлороводородной кислоты в водную фазу и комплексометрическом определении ионов кадмия при индикаторе эрихроме черном Т. Граница определения 1 мг. Фотоколориметрический метод. Дитизоновый метод является наиболее подходящим для определения кадмия в биологическом материале. Дитизонат кадмия, красного цвета, количественно экстрагируется четыреххлористым углеродом при рН 12. точность определения невелика, т.к. дитизонат кадмия не очень устойчив и поэтому превращает комплекс в свободный дитизон, взбалтывая раствор с хлороводордной кислотой. Оптическую плотность дитизона определяют при 620 нм. При количественном определении ионов кадмия в присутствии обычно всех встречающихся вместе с ним элементов (цинк, кобальт, никель, свинец, висмут, серебро и медь) применяется следующий вариант дитизонового метода. Сначала проводят экстракцию дитизоната кадмия из щелочного раствора, затем разрушают дитизонат кадмия, и переводят ионы кадмия в водный раствор обработкой хлороводородной кислотой и затем снова экстрагируют дитизонат кадмия из щелочной среды хлороформом. Оптическую плотность раствора определяют при 520 нм. Следы ионов кадмия определяют методом атомной абсорбционной спектроскопии. Следует обратить внимание на то, что при обнаружении и количественном определении ионов кадмия в объектах исследования обязательным является необходимость наличие и содержание данного металла в лабораторном стекле, реактивах и растворителях. Выявление ионов стибиума Сурьма (Sb). Применение и токсичность соединений сурьмы. Большинство соединений сурьмы токсичны. Соединения трёхвалентной сурьмы более токсичны, чем пятивалентной. Соединения сурьмы применяются в медицине и различных областях народного хозяйства. Они используются при изготовлении некоторых сортов стекла, красок, резиновых изделий. Сульфид сурьмы (V) применяют в пиротехнике, при производстве спичек, для вулканизации каучука и т.д. Металлическая сурьма входит в состав некоторых сплавов, которые используются при производстве подшипников, печатного шрифта и др. Хлорид сурьмы (III) используют для защиты металлов от коррозии. В некоторых странах в медицине используют так называемый рвотный камень KOOC–CHOH–CHOH–COO–SbO как отхаркивающее и рвотное средство. В качестве химиотерапевтических препаратов применяются органические соединения сурьмы (натрий-антимонила тартрат, рвотный камень), солюсурмин (при лейшманиозе). Клиническая картина отравления. Парентеральное введение солей сурьмы вызывает кардиотоксичность; возможны коллапс и смерть вследствие анафилактического шока. Промышленное отравление обусловлено вдыханием соединений сурьмы в виде паров или порошка. Симптомы острого перорального отравления сурьмой напоминает наблюдаемые при остром отравлении мышьяком, и включают боли в животе, рвоту и диарею. При патологоанатомическом исследовании трупов лиц, отравленных соединениями сурьмы, наблюдаются гиперемия ткани лёгких, кровоизлияние в лёгких и кишечном тракте. Сурьма выводится из организма в основном почками. Поэтому при отравлении сурьмой может развиться нефрит. Исследование минерализатов на наличие сурьмы. В минерализате сурьма находится в виде трёхвалентного состояния HSbO2 (метасурьмянистая кислота). Для её определения сурьму трёхвалентную переводят в ацидокомплекс – H[SbCl6] с помощью нитрита натрия. Избыток нитрита натрия удаляют мочевиной: HSbO2 + 2NaNO2 + 8HCl → H[SbCl6] + 2NO↑ + 2NaCl + 4H2O 2NaNO2 + 2HCl + O=C(NH2)2 → 2N2↑ + CO2↑ + 2NaCl + 3H2O Гексахлоро (V) стибиат водорода с малахитовым или бриллиантовым зелёным образует ионный ассоциат, при прибавлении к которому толуола или ксилола слой органического растворителя окрашивается в голубой или синий цвет. Определению мешают Fe3+, Tl3+, Ag+. 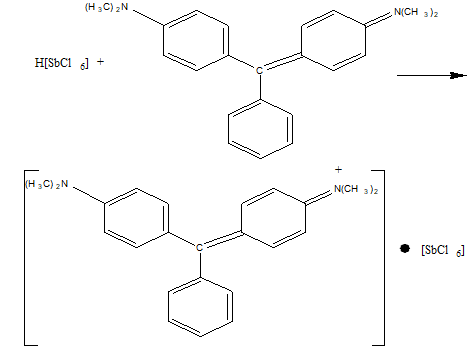 Эти реакции не специфичны и имеют предварительное значение. Для подтверждения присутствия сурьмы в минерализате проводят следующие реакции. 1.Медная фольга в азотнокислой среде при наличии сурьмы окрашивается в пурпурно-чёрный цвет. 2.Реакция с тиосульфатом натрия в кислой среде – выпадает осадок оранжевого цвета – Sb2S3. 2Sb3+ + 3Na2S2O3 + 3H2O → Sb2S3 + 3Na2SO4 + 6H+ При несоблюдении условий реакции вместо Sb2S3 может образоваться красный осадок стибиевой киновари – Sb2ОS2 2Sb3+ + 2Na2S2O3 + 3H2O → Sb2OS3↓ + 2Na2SO4 + 6H+ При большом избытке кислоты вместо Sb2S3 выпадает осадок серы: 2Na2S2O3 + 3HCl → S↓ + SO2↓ + 2NaCl + H2O Минерализат не рекомендуются разбавлять водой при наличии в нём хлорида сурьмы (III), т.к. при этом образуется белый осадок хлороксида сурьмы (III). SbCl3 + H2O → SbOCl↓ + 2HCl Количественное определение определение Фотоколориметрические методы: 1.Содинения сурьмы (V) в солянокислой среде образуют с родамином В фиолетово-красное соединение RHSbCl6, экстрагируемое изопропиловым эфиром. Предварительно сурьму (III) переводят в сурьму (V). 2.Определение с метиловым фиолетовым или кристаллическим фиолетовым. Реакция аналогична предыдущей. 3.Определение с йодидом. Сурьма (III) в кислом растворе образует с йодид-ионами комплексные соединения жёлтого цвета. Ту же реакцию даёт и Sb (V). Образующееся соединение экстрагируется бензолом K[SbI4] 4.Фотоколориметрический метод на основе реакции соединений сурьмы (III) с малахитовым или бриллиантовым зелёным. Выделение ионов висмута Висмут Среди элементов периодической системы висмут – последний практически не радиоактивный элемент. И он же открывает шеренгу тяжёлых металлов – естественных α-излучателей. Традиционные потребители висмута – металлургическая (лёгкоплавкие сплавы), фармацевтическая (лекарственные средства) и химическая промышленность (красители, пигменты). Последние десятилетия к ним добавилась ядерная техника и электроника. В медицинской практике применяются малорастворимые соединения висмута (алюминаты, карбонаты, галлаты, нитраты, салицилаты, цитраты в виде основных солей), как вяжущие антацидное средство при лечении язв диареи, сифилиса, дерматитов, эрозии, экземы, бородавок. К лекарственным средствам, содержащим висмут и включённых в номенклатуру разрешённых к применению в Украине препаратов относятся: нитрат висмута основной, ксероформ (триброфенолят висмута основной),дерматол (галлат висмута основной), бисмоверол (основная соль висмута и моновисмутовинной кислоты), пентеабисмол, хинина йодвисмутат. Содержание в крови: концентрация висмута в крови пациентов, лечивших язву желудка и двенадцатипёрстной кишки, находилась в пределах от 0,001 до 0,012 мг/л. Метаболизм и выделение. Малорастворимые соединения висмута принимаемые перорально в значительной степени выводятся с калом. Препараты висмута вводимые в организм в виде инъекции (обычно субсалицилаты, тиогликоляты, тригликоляты, йодвисмутаты, тартраты, цитраты) выводятся мочой в течение нескольких недель. Человеческий мозг, лёгкие и печень содержат менее чем 0,4 мг/кг. Содержание висмута в моче в норме составляет 0,018 мг/л. В то время как при лечении язвы препаратами, содержащими висмут, содержание его в моче составляет 0,480 мг/л. При лечении сифилиса путём введения внутримышечно висмута салицилата (60-2100 мг в пересчёте на висмут) и умерших через 1-251 день, содержание элементов в ткани было следующим:
Токсичность. Проявление токсичности висмута подобны тем, которые наблюдаются при отравлении свинцом или ртутью. Усиленное слюноотделение, обесцвечивание языка, дёсен, кожи, боли в абдоминальной полости, тошнота. Повреждение почек является основным результатом приёма завышенной дозы висмута. Однако наблюдается явления энцефалопатии и периферической невропатии. Иногда наблюдается тошнота, рвота и нефротоксичность при внутримышечном введении висмута тиогликолята; причём функция почек возвращалась в норму через несколько недель. Подобная картина наблюдается и при пероральном приеме тригликолямата висмута. Постоянное употребление субгаллата висмута перорально, обычно назначаемого при желудочно-кишечных заболеваний, приводит к дрожанию мышц, нарушению координации движения, потери памяти, замешательство, раздражительность и временной потери зрения. В ряде случаев постоянное применение субсалицилата висмута приводит к энцефалопатии, концентрация висмута в крови при этом составляла 0,072 мг/л. При отравлении висмутом, которое является результатом постоянного и длительного применения субнитрата висмута перорально концентрация его в крови была в пределах от 0,05 до 1,60 мг/л, а в моче – 0,15-10,25 мг/л. Все пациенты, которые выжили в первые 7-14 дней после появления признаков отравления, не зависимо от пути введения ви смута в организм, поправлялись без особого ущерба для здоровья. Обнаружение висмута в минерализате. Для обнаружения висмута в минерализатах вначале выполняют предварительные реакции на ионы этого металла с тиомочевиной и 8-оксихинолином (о-оксихинолином). При положительном результате этих реакций висмут выделяют из минерализата в виде диэтилдитиокарбамата, который экстрагируют хлороформом. После прибавления кислоты к хлороформной вытяжке происходит разложение диэтидитиокарбамата висмутом. Образовавшиеся при этом ионы висмута переходят в водную фазу, которую используют для обнаружения указанных ионов. Реакция с тиомочевиной. Во время взаимодействия ионов висмута с тиомочевиной могут образовываться различного состава тиомочевинные комплексы, имеющие лимонно-желтую окраску: 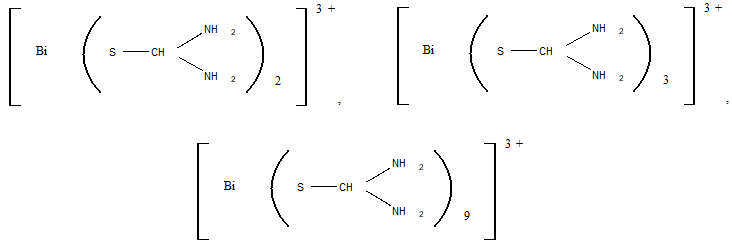 Образованию положительных комплексов мешают окислители. Реакция с 8-оксихинолином (о-оксихинолином). Эта реакция осонована на переведении ионов висмута в ацидокомплекс [BiI4]-, который при взаимодействии с 8-оксихинолином (о-оксихинолином) в кислой среде образует оранжево-краснный осадок. Этот осадок является ионным ассоциатом (иодвисмутат 8-оксихинолина). Образование этого ионного ассоциата можно изобразить следующими уравнениями Bi3+ + 4KI → [BiI4]- + 4K+ 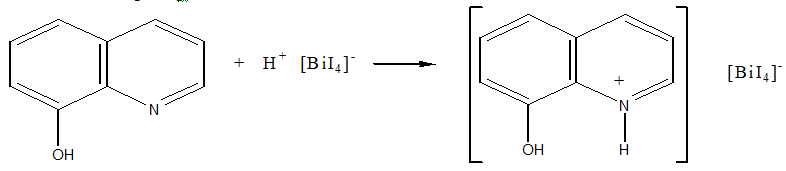 Этой реакции мешают окислители при наличии которых иодид-ионы переходят в иод, вследствие чего комплекс [BiI4]- образовываться не будет. Образованию иодвисмутата 8-оксихинолина мешают также катионы ряда металлов, которые с 8-оксихинолином образуют плохо растворимые соединения. С целью маскировки мешающих ионов к смеси добавляют аскорбиновую кислоту, восстанавливающую ионы железа (III), и сегнетовую соль, которая связывает другие ионы, мешающие обнаружению висмута. Предел обнаружения: 5 мкг висмута в пробе. Граница обнаружения:0,1 мг в 100 г биологического материала. Описанные реакции на висмут с тиомочевиной и 8-оксихинолином являются предварительными. Отрицательный результат реакции указывает на отсутствие ионов висмута в минерализате. При положительном результате этих реакций проводят дальнейшее исследование минерализата на наличие ионов висмута. С этой целью ионы висмута выделяют из минерализата в виде комплекса с диэтилдитиокарбаматом, который экстрагируют хлороформом, а затем разлагают кислотой. Выделение ионов висмута из минерализата. К минерализату прибавляют раствор диэтилдитиокарбамата натрия. При этом ионы висмута переходят в комплекс:   Кроме ионов висмута с диэтилдитиокарбаматом натрия образует комплексные соединения и другие ионы, содержащиеся в минерализате. Для маскировки этих ионов добавляют раствор трилона Б (комплексона (III)). образовавшийся комплекс диэтилдитиокарбамата висмута экстрагируют хлороформом, затем разлагают азотной кислотой. Висмут при этом переходит в водную фазу в виде Bi(NO3)3. Хлороформный слой отбрасывают. При дальнейших исследованиях необходимо учитывать, что разбавление водой минерализата приводит к гидролизу нитрата висмута, который в виде белого аморфного соединения выпадает в осадок. Методы качественного обнаружения висмута. С нитратом висмута проводят специфические микрокристаллоскопические реакции: 1.Реакция с бруцином и бромидом калия. На предметное стекло наносят несколько капель водной фазы, которую выпаривают досуха. На сухой остаток наносят 2н раствор азотной кислоты, а затем прибавляют каплю насыщенного раствора бруцина в 1м растворе серной кислоты и каплю 5%-го раствора бромида калия. При наличии ионов висмута образуются сфероиды желто-зеленого цвета, краснеющие (в отличие от кадмия) при добавлении иодида калия. 2.Реакция с хлоридом цезия и иодидом калия. На предметное стекло наносят несколько капель водной фазы, которую выпаривают досуха. На сухой остаток наносят 1-2 капли цезия, а затем кристаллического иодида калия – в присутствии ионов висмута образуется многоугольники и шестиугольные звездочки оранжевого цвета – Сs[BiI4]. Чувствительность реакции 0,1мкг/мл. Граница обнаружения 0,1 мг в 100 г биоматериале. 3.Реакция с тиомочевиной. В азотнокислой среде с ионами висмута образует водорастворимые комплексы лимонно-желного цвета различного состава (см. реакцию вше) 4.Тест Рейнша. Методика теста. Методика теста применяется для обнаружения висмута в моче, содержимом желудка и остатках веществ с места происшествия. При нагревании медной пластинки, предварительно очищенной азотной кислотой, с анализируемым раствором в присутствии концентрированной хлороводородной кислоты её поверхность окрашивается в блестящий черный цвет при наличии паров висмута в исследуемом объекте. Чувствительность теста – 2 мг/л. Если на поверхность, почерневшей в процессе теста медной пластинки, нанести реактив, содержащий хини и иодид калия, висмут медленно образует оранжево-коричневую суспензию. 5.Реакция с цинхонином и иодидом калия. Многие, преимущественно одноосновные органические соединения, и среди них цинхонин, образует в слабокислых растворах солей висмута и иодида калия нерастворимые двойные иодиды с общей формулой BiI3•B•HI, где В – молекула цинхонина. На фильтровальную бумагу, пропитанную раствором цинхонина (один из алкалоидов хинного дерева) помещают каплю слабокислого анализируемого раствора. Образование оранжево-красного пятна указывает на присутствие ионов висмута. Предел обнаружения 0,14 мкг. 6.Люминисценция в водородном пламени. Водородное пламя вызывает васильково-синее свечение ионов висмута. Метод позволяет обнаружить весьма небольшие количества висмута, если анализируемый образец предварительно смещать с карбонатом щелочноземельного металла и смесь внести в пламя. Предел обнаружения – 0,004 мкг. 7.Реакция с тиоциоатом хром-калия. Минеральнокислые растворы солей висмута, взаимодействуя с гексатиоцианатохромато (III) калия K3[Cr(SCN)6], дают нерастворимый кирпично-красный осадок гексатиоцианатохромато (III) висмута Bi3++[Cr(SCN)6]3- = K3[Cr(SCN)6]↓ На фильтровальную бумагу наносят каплю анализируемого раствора, высушивают и добавляют каплю спиртового раствора реагента. Вновь высушивают и добавляют каплю разбавленной (1:2) серной кислоты. В зависимости от содержания висмута образуется кирпично-красно пятно или кольцо. Предел обнаружения 0,4 мкг. 8.Соосаждение ионов висмута с тиоционатом свинца. Ионы висмута соосаждаются с тиоционатом свинца, давая коричневый или оранжевый осадок, состоящий изсмеси кристаллических Pb(SCN)2 и Pb3[Bi(SCN)6]2. На этом основана капельная реакция на ионы висмута. Предел обнаружения 0,05 мкг. Дополнительные реакции обнаружения ионов висмута в минерализате. 1.Реакция обнаружения ионов висмута с щелочным раствором станита и добавлением солей свинца. Окислительно-восстановительная реакция протекает настолько быстро, что при смешивании на капельной пластинке анализируемого раствора с каплей щелочного раствора станита сразу же появляется осадок металлического висмута в виде чёрного пятна: 2.Реакция обнаружения ионов висмута с йодидом калия. При добавлении к анализируемому раствору йодида калия образуется чёрно-бурый осадок BiI3, который при кипячении превращается в BiOI красного цвета. 3.Реакция обнаружения ионов висмута путём экстрагирования йодида висмута. При экстрагировании йодида висмута из кислых растворов в присутствии йодида щелочного металла изобутилкетоном экстракт окрашивается в жёлтый цвет. Предел обнаружения 1 мкг. Количественное определение. Методы количественного определения основаны на выделении ионов висмута из минерализата экстракцией в виде Bi(ДДТК)3 в щелочной среде, с последующей реэкстракцией в водный слой азотной кислотыи определении: Объёмный метод. Комплесонометрическое титрование. Титрование ионов висмута раствором динатриевой соли этилен-диамино-тетрауксусной кислоты (ЭДТА) проводится с использованием в качестве индикатора йодидов, которые с ионами висмута образуют при рН 1,5-2,0 окрашенной в оранжевый цвет комплекс – [BiI4]–. В точке конца титрования оранжевый раствор обесцвечивается. При титровании ионов висмута раствором ЭДТА в качестве индикатора можно использовать пирокатехиновый фиолетовый (или тиомочевину) при рН от 2,0 до 3,0. В точке конца титрования цвет раствора меняется от синего до лимонно-жёлтого (или от жёлтого до обесцвечивания). Граница определения 1 мг. Фотометрические методы. 1. Определение ионов висмута по тиомочевинному комплексу. В разбавленном растворе сильной кислоты ионы висмута образуют с тиомечевиной комплекс жёлтого цвета. Окраска устойчива в течение 1 часа. Оптическая плотность раствора измеряется при 470 нм. Граница определения 0,1 мг. 2. Определение ионов висмута по дитизоновому комплексу. В делительную воронку вносят азотнокислый раствор ионов висмута, который доводят до рН 8,5-9,0 с помощью аммиака. К смеси лобпвляют хлороформный раствор дитизона и смесь тщательно взбалтывают. Слой органического растворителя отделяют и оптическую плотность окрашенного в оранжевый цвет дитизоната висмута определяют при 505 нм. 3. Определение ионов висмута по комплексу с диэтилдитиокарбоматом натрия. Экстракция ионов висмута четыреххлористым углеродом в аммиачной среде в виде его комплекса с диэтилдитиокарбоматом натрия – метод специфичный для висмута. Получается внутрикомплексное соединение желтого цвета. Оптическую плотность слоя органического растворителя, содержащего диэтилдитиокарбомат висмута, определяют при 400 нм. 4. Определение ионов висмута по комплексу с иодидом калия. При добавлении избытка иодида калия к кислому раствору ионов висмута образуется желтая окраска – K[BiI4]. Измерение оптической плотности проводят при 465 нм. Для анализа висмута в биологических объектах на уровне следов используются методы пламенной атомной абсорбционной спектроскопии, атомно-эмиссионной спектроскопии, эмиссионной пламенной спектроскопии. Мышьяк Применение и токсичность соединений мышьяка. Соединения мышьяка относятся к веществам, которые проявляют выраженную токсичность на организм людей и животных. Описаны случаи отравления ангидридом мышьяковистой кислоты, арсенитами, арсенатами, хлоридом мышьяка (III), арсином – AsH3, и другими соединениями мышьяка. Ангидрид мышьяковистой кислоты используют для получения некоторых пестицидов, которые используются в сельском хозяйстве. Арсениты и арсенаты некотрых металлов применяются как пестициды, к которым относятся парижская зелень – Cu(CH3COO)2 • 3Cu(AsO)2 и некоторые другие соединения. Определённое токсикологическое значение имеют органические соединения мышьяка, применяемые в медицине (осарсол, новарсенол, миарсенол). Очень токсичными являются боевые отравлющие вещества (люизит, адамсит и др.), в состав которых входит мышьяк Обладает кожно-резорбтивным действием, вызывает появление язв, некроз тканей, гемолиз крови. Входит в состав спецсредства «Черёмуха» обладает слезоточивым действием. Токсическое действие соединений мышьяка зависит от валентности этого элемента. Соединения трёхвалентного мышьяка более токсичны чем пятивалентного. Большинство соединений пятивалентного мышьяка в организме превращаются в трёхвалентный. Определённое количество мышьяка содержится в тканях организма (печень, селезёнка, лёгкие, сердечные мышцы). Водорастворимые соединения мышьяка всасываются в кровь из кишечного тракта. Они действуют на ферменты, которые содержат сульфгидрильные группы. Часть соединений мышьяка, которые поступили в кровь, проникают в эритроциты и вызывают гемолиз. Это приводит к закупорке почечных канальцев и возникновению желтухи. Некоторые соединения мышьяка проявляют некротическое действие. Это свойство ангидрида мышьяковистой кислоты используют в стоматологической практике. Соединения мышьяка имеют способность кумулироваться в организме. При остром отравлении соединениями мышьяка они накапливаются преимущественно в паренхиматозных органах, при хронических отравлениях – в костях и ороговевших тканях (кожа, ногти, волосы и тд.). Мышьяк выводится из организма через почки с мочой, кишечник и некоторые железы. Выделение мышьяка из организма происходит постепенно, чем и обусловлена возможность его кумуляции. В экскрементах мышьяк можно обнаружить через несколько недель, в трупном материале через несколько лет после смерти. При остром отравлении мышьяком возникают жгучие боли в пищеводе, желудке, появляется рвота, понижается артериальное давление, развивается кома, судороги. При меньших дозах мышьяка возникает беспокойство, тошнота, рвота, головная боль, головокружение, озноб, спазмы мышц и различные параличи. При отравлении пылью, содержащей мышьяк, проникающей через дыхательные пути возникает беспокойство, кашель, отдышка, цианоз, отёк лёгких. Арсин (мышьяковистый водород) вызывает жжение кожи лица, тошноту, тяжесть в груди. Клиническая картина отравления мышьяком характеризуется тремя степенями: лёгкая, средней тяжести и тяжёлая степень. Поражение крови вызывает гемолиз эритроцитов, анемию. Во всех степенях отравления мышьяком наблюдаются: нефропатия, гематопатия, а их тяжесть зависит от степени отравления. Патоанатомическая картина при остром отравлении не характерна. Органическое отравление вызывает жировые перерождения печени, почек, сердечной мышцы. Для судебно-химической экспертизы при эксгумации трупа необходимо проводить забор грунта с шести сторон захоронения гроба (голова, ноги, под гробом, над гробом, слева и справа от гроба). Обнаружение мышьяка в минерализате. В минерализате соединения мышьяка присутствуют в виде арсенитов (AsO33–) и арсенатов (AsO43–). В дробном методе анализа при химико-токсикологическом исследовании используют три основных реакции. Реакция обнаружения мышьяка по методу Зангер-Блека с диэтилтиокарбоминатом серебра имеют отрицательное значение. Реакция Марша является основной. Реакция Зангер-Блека. Реакцию проводят в специальном приборе. В колбу помещают минерализат, добавляют серную кислоту не содержащую мышьяк и раствор хлорида олова (II) в концентрированной серной кислоте. К реакционной смеси прибавляют гранулы купрированного цинка, свободного от мышьяка. Колбу закрывают специальной насадкой. В середине насадки помещают вату, смоченную ацетатом свинца для улавливания сероводорода. На верхней части насадки находятся две пластинки, между которыми помещают бумагу, пропитанную сулемой (HgCl2) или бромидом ртути (II). Опыт проводят в течение часа. При больших количествах мышьяка цветные пятна на реактивной бумаге появляются раньше. После окончания опытов, реактивную бумагу снимают, при этом на ней могут присутствовать пятна различного цвета – от жёлтого до коричневого. Для проявления бумагу обрабатывают раствором йодида калия. Бумага окрашивается в красный цвет. Для удаления последнего, бумагу помещают в насыщенный раствор йодида калия. Бумага обесцвечивается, а оставшиеся пятна с окраской от жёлтого до коричневого цвета, указывают на присутствие соединений мышьяка. H3AsO3 + H3AsO4 + 7Zn + 7H2SO4 → 2AsH3↑ + 7ZnSO4 + 7H2O H2S + Pb(CH3COO)2 → PbS↓ + 2CH3COOH AsH3 + HgCl2 → AsH2HgCl + HCl AsH3 + 2HgCl2 → AsH(HgCl)2 + 2HCl AsH3 + 3HgCl2 → As(HgCl)3 + 3HCl 2AsH3 + 3HgCl2 → As2Hg3 + 6HCl HgCl2 + 2KI → HgI2↓ + 2KCl HgI2 + 2KI → K2[HgI4] Реакция с диэтилкарбоминатом серебра. Реакцию проводят в приборе, который состоит из колбы, делительной воронки, газоотводной трубки, приёмника. В колбу вносят купрированный цинк. Через делительную воронку приливают помещённый в неё минерализат, раствор хлорида олова (II) в серной кислоте, в воде. Затем к содержимому воронки прибавляют серную кислоту. Отводную трубку погружают в приёмник, содержащий диэтилкарбоминат серебра в пиридине. Появление розового или красно-фиолетового окрашивания показывает наличие мышьяка в минерализате. Реакция Марша. Реакция (метод) Марша является основным доказательством обнаружения мышьяка в биоматериале при химико-токсикологических исследованиях. При проведении этой реакции проводят несколько качественных реакций по открытию мышьяка в минерализате. При этом необходимо соблюдать правила работы с аппаратом Марша: 1.Маскировать мешающие ионы хлорида олова в концентрированной серной кислоте. 2.Проверить реактивы на наличие в них мышьяка. 3.Правильно собрать прибор. 4.Проверить полноту вытеснения воздуха из прибора. 5.В делительной воронке всегда должна находиться серная кислота. Исследования в аппарате Марша проводят от одного часа и более в зависимости от количества мышьяка в минерализате после полного удаления воздуха из прибора. При наличии даже незначительного количества воздуха в приборе Марша во время исследования может произойти взрыв. Нагревают и охлаждают восстановительную трубку прибора Марша. Через некоторые время отставляют горелку и наблюдают: 1.Окрашивание пламени восстановительной трубки Марша – синее, запах чеснока. 2.При внесении в пламя трубки фарфоровой пластинки появляются буровато-серые пятна. 3.осторожно поворачивают восстановительную трубку аппарата Марша на 1800 и погружают её в пробирку с раствором нитрата серебра, слабо подщелочённого раствора гидроксида аммония. H3AsO3 + H3AsO4 + 7Zn + 7H2SO4 → 2AsH3 + 7ZnSO4 + 7H2O AsH3 + 3AgNO3 → AsAg3 + 3HNO3 AsAg3 + 3AgNO3 → AsAg3•3AgNO3 AsAg3•3AgNO3 + 3H2O → 6Ag + H3AsO3 + 3HNO3 4.Продолжают нагревать восстановительную трубку Марша. Налёт в охлаждаемой части, его характер и расположение указывает на присутствие мышьяка и сурьмы. Мышьяк – буровато-серая окраска с металлическим блеском, откладывается в суженной части восстановительной трубки Марша сразу за местом нагревания. Сурьма – матово-чёрный цвет, откладывается по обе стороны нагревания восстановительной трубки Марша 2AsH3 = 2As + 3H2 Через один час на лёд исследуют мышьяк: Нагревают место налёта в восстановительной трубки Марша: As2O3 – кристаллы в виде октаэдров Sb2O3 – аморфный осадок Если As2O3 не имеет выраженного кристаллического строения проводят микрокристаллоскопическую реакцию с хлоридом цезия и йодидом калия – образуется красно-оранжевый осадок: Cs2AsI5•2,5H2O Мышьяк – ярко-красные треугольные звёздочки или шестиугольные многогранники. Сурьма – напоминают мышьяк. После добавления пиридина. Мышьяк – зеленовато-жёлтые игольчатые кристаллы (со временем теряют форму и цвет). Сурьма – остаются без изменений. При пропускании сероводорода через восстановительную трубку Марша образуются сульфиды: мышьяк – жёлтые, сурьма – красные As2S3 + 3H2S → As2S3↓ + 3H2O жёлтый осадок Sb2O3 + 3H2S → Sb2S3↓ + 3H2O красный осадок Сульфид мышьяка растворим в растворе карбоната натрия и гидроксида натрия: As2S3 + 3Na2CO3 → Na3AsS3 + Na3AsO3 + 3CO2↑ As2S3 + 6NaOH → Na3AsS3 + Na3AsO3+ 3H2O При добавлении к раствору хлороводородной кислоты в осадок выпадает сульфид мышьяка (III): 2Na3AsS3 + 6HCl → As2S3↓ + 6NaCl + 3H2S↑ При добавлении к сульфиду мышьяка концентрированной азотной кислоты он растворяется с образованием арсенатов. As2S3 + 28HNO3 → 2H3AsO4 + 28NO↑ + 8H2O + 3H2SO4 Налёты мышьяка растворимы в свежеприготовленном гипохлорите натрия – NaOCl. После добавления нитрата серебра выпадает осадок шоколадного цвета 2As + 5NaOCl + 3H2O = 2H3AsO4 + 5NaCl H3AsO4 + 3AgNO3 → Ag3AsO4↓ + 3HNO3 Сурьма не растворима в NaOCl. С азотной кислотой мышьяк и сурьма образуют мышьяковистую и соответственно метасурьмянистую кислоты 3As + 5HNO3 + 2H2O → 3H3AsO4 + 5NO↑ 3Sb + 5HNO3 → 3HSbO3 + 5NO↑ + H2O При добавлении к их сухим остаткам соляной кислоты и хлорида цезия: Мышьяк – не образует кристаллы Сурьма – бесцветные кристаллы в виде многогранника Арсениты и арсенаты с нитратом серебра образуют цветные осадки: H3AsO3 + 3AgNO3 → Ag3AsO3↓ + 3HNO3 осадок жёлтого цвета H3AsO4 + 3AgNO3 → Ag3AsO4↓ + 3HNO3 осадок шоколадного цвета Количественное определение Объёмные методы: 1.Окислительное титрование мышьяка (III) броматом калия в кислой среде. 2.Титрование мышьяка (III) йодом в среде гидрокарбоната натрия (рН 8,3). Колориметрические методы. 1.Колориметрия на очувствленной бумаге (метод Тутцайта). Выделяющийся арсин пропускают над бумагой пропитанной бромидом ртути. На бумаге образуется пятно от жёлтого до коричневого цвета, размеры которого и интенсивность окраски возрастают с увеличением количества мышьяковистого водорода. Окраска эта вызвана образованием веществ H(HgBr)2As – жёлтого цвета, (HgBr)3As – коричневого цвета и Hg3As2 – чёрного цвета. Её сравнивают со шкалой эталонных окрасок, приготовленных такой же обработки растворов H3AsO3 с известным содержанием в них мышьяка. 2.Фотоколориметрический метод по реакции соединений мышьяка (III) с диэтилдитиокарбамата серебра в пиридин. Оптическую плотность раствора измеряют при 540 нм относительно контрольного реактива и вычисляют концентрацию мышьяка по предварительно построенной калибровочной кривой. Чувствительность реакции 0,5 мг/л. Занятие 2 | ||||||||||||||||||||||||||||||||||||||||||
