Л1 Введение. Методы исследования медицинской генетики.. Лекция Введение. Методы изучения медицинской генетики. Введение в медицинскую генетику. Основные положения и понятия. Термин генетика
 Скачать 7.14 Mb. Скачать 7.14 Mb.
|
К общим показаниям для проведения клинико-генеалогического метода относятся:1) наличие случая наследственного синдрома, а также с наследственной предрасположенностью в семье, прогрессирующее нарушение функций различных систем организма неясного генеза при исключении соматической патологии; 2) нарушение физического развития детей: неправильный рост, деформация костей туловища и конечностей, чрезмерное развитие подкожно-жировой клетчатки, тугоподвижность или гипермобильность в суставах, снижение зрения или слепота, тугоухость и глухота; 3) нарушение пигментации кожных покровов; 4) почечнокаменная болезнь у детей; 5) гемолитическая анемия, желтуха “эндогенного” генеза; 6) планирование потомства, возраст женщин, планирующих деторождение моложе 18 или старше 35 лет 7) первичная аменорея; бесплодие у женщин и мужчин; 8) оценка мутагенных воздействий (в случае, если кто-либо из родителей имел контакт до или в период беременности с химическими, радиактивными и др. мутагенами); 9) первичное невынашивание беременности, 1 и более спонтанных абортов, выкидышей, мертворождения); 10) несовместимость родителей по резус-фактору; 11) кровное родство родителей; 12) накопление патологического признака в семье; 13) пренатальная диагностика наследственного синдрома 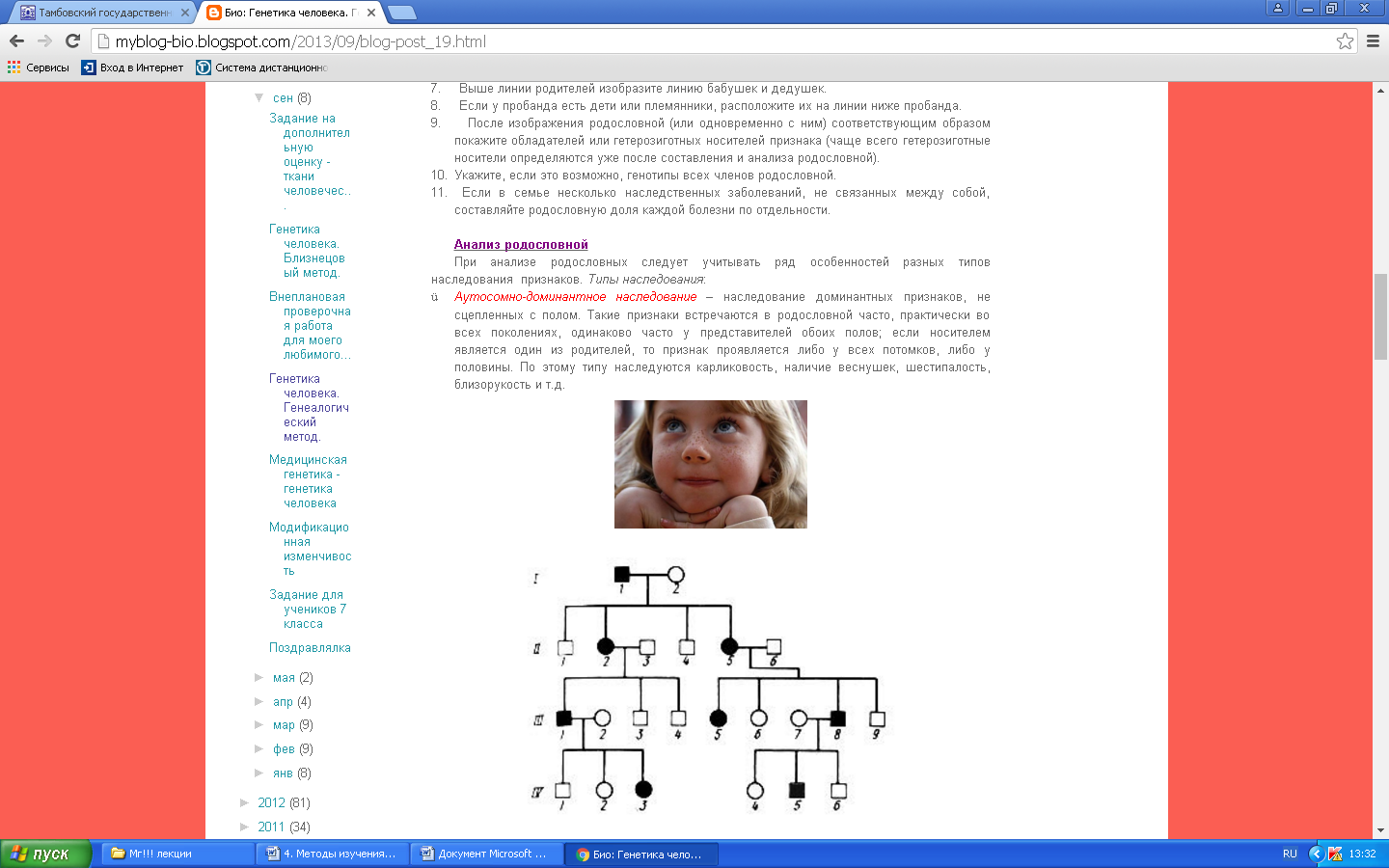 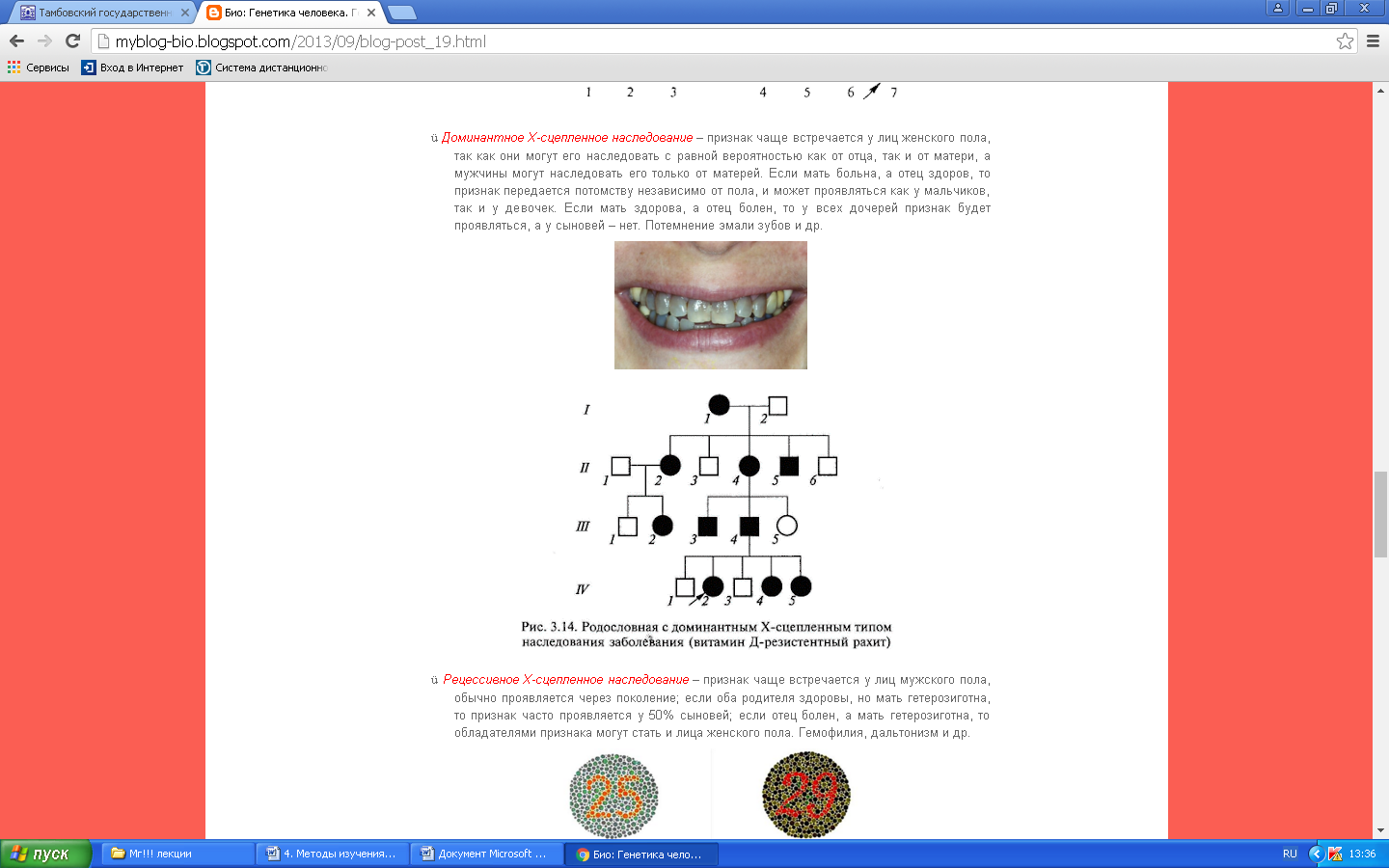 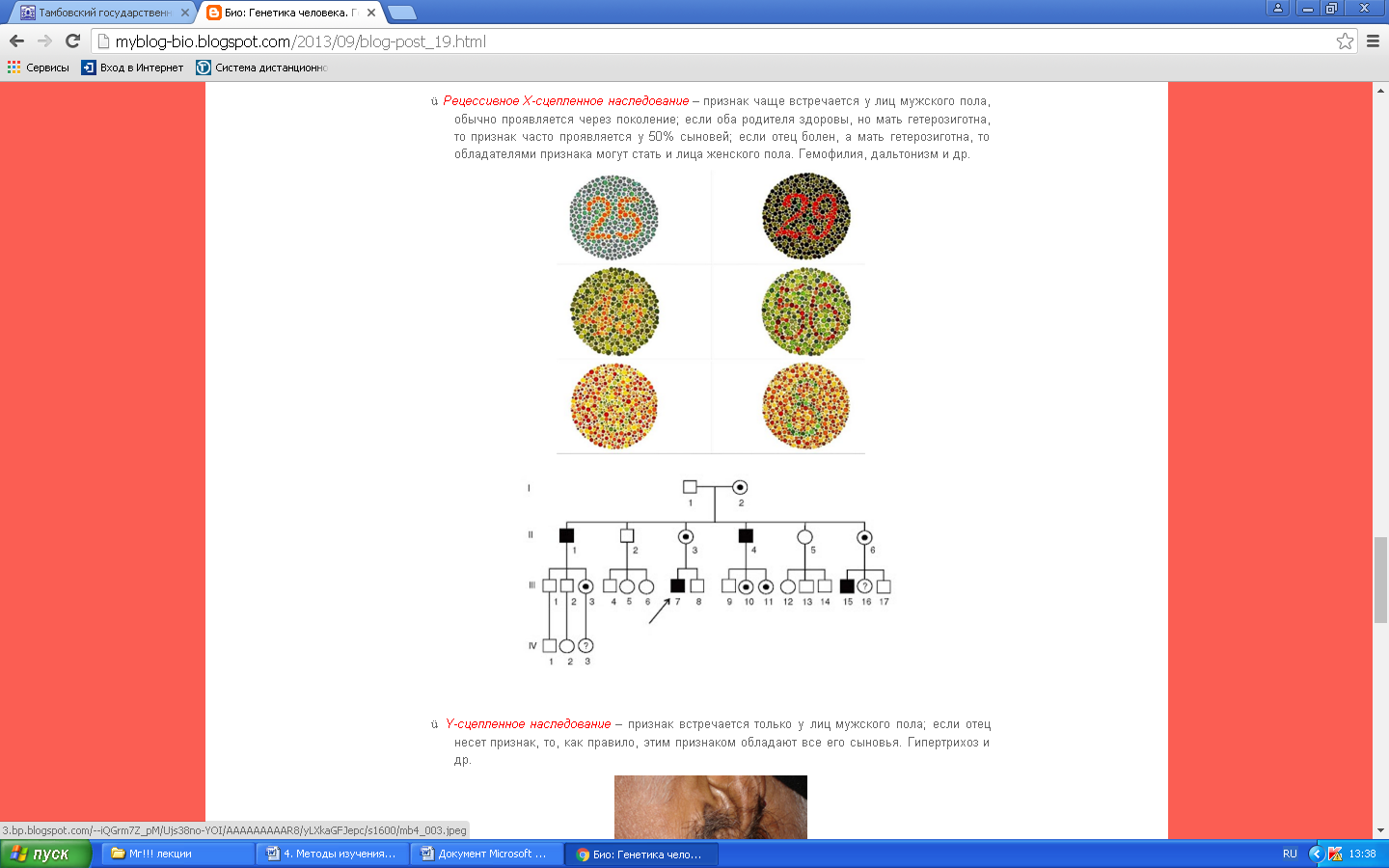  Близнецовый метод Близнецовый метод широко применяется в изучении наследственности и изменчивости у человека для определения соотносительной роли наследственности и среды в формировании различных признаков, как нормальных, так и патологических. Суть метода состоит в сравнении проявления признака в разных группах близнецов при учете сродства или различия их генотипов. Развитие признака у обоих близнецов называю конкордантностью. Если по определенным признакам между близнецами наблюдаются различия, то говорят о дискордантности. По определенным признакам близнецов подразделяют на монозиготных и дизиготных. Монозиготные близнецы развиваются в результате оплодотворения и деления одной яйцеклетки (при первом делении зиготы) на два самостоятельных генетически одинаковых индивида. Дизиготные формируются при одновременном созревании двух и более яйцеклеток с последующим оплодотворением их. Монозиготные близнецы генетически идентичны, общность генов у них составляет 100 %, и различия признаков зависят от внешних условий. Дизиготные по наследственным свойствам сходны между собой не более чем обычные братья и сестры, рожденные в разное время. Однако условия эмбриогенеза и внешней среды у дизиготных близнецов одинаковы. Признаки, отличающиеся у дизиготных близнецов, но тождественные у монозиготных, следует считать генетически детерминированными. Например, очень высокая степень конкордантности по олигофрении у монозиготных близнецов и относительно умеренная у дизиготных указывает на высокую степень наследственной предрасположенности к этому заболеванию. 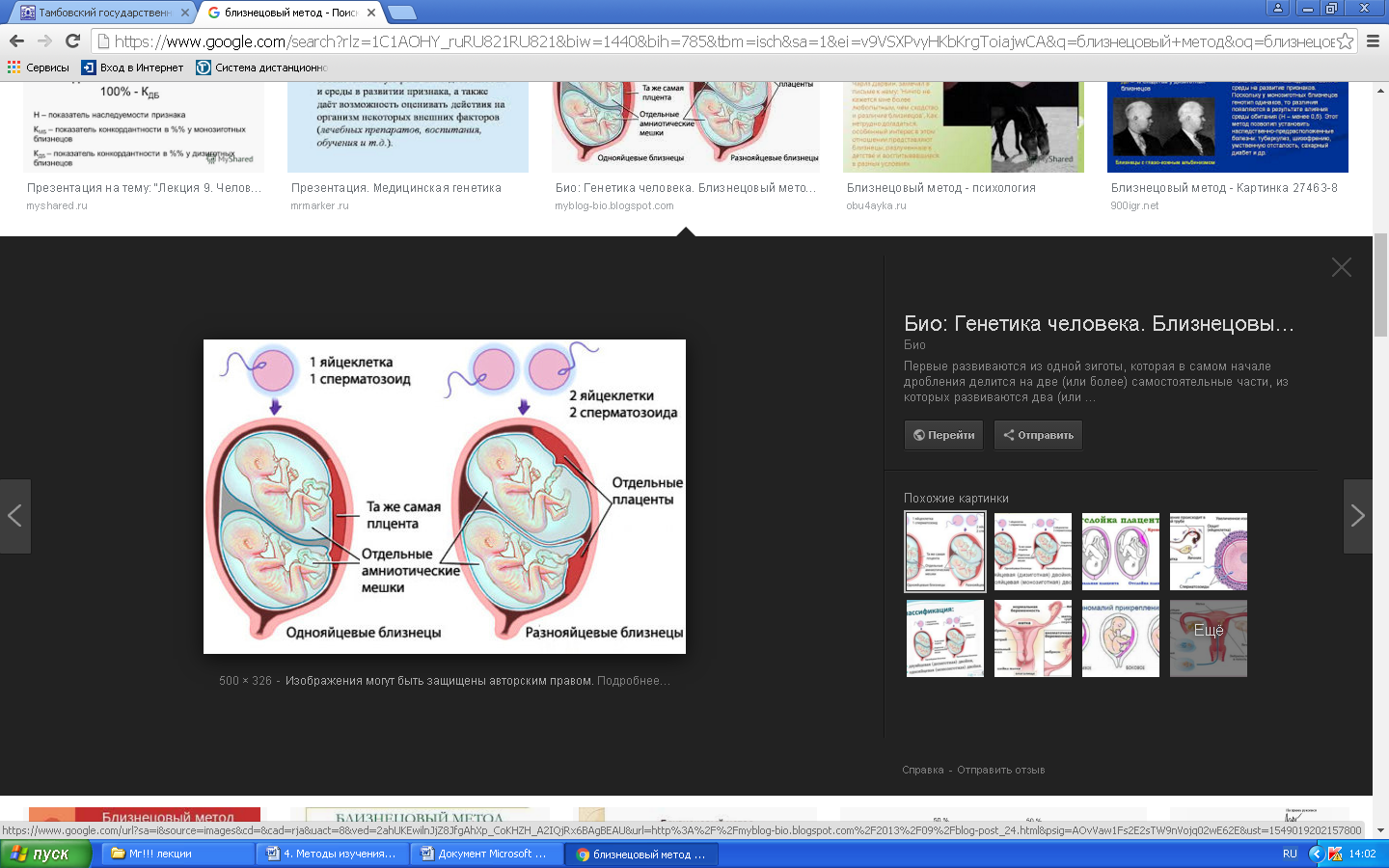 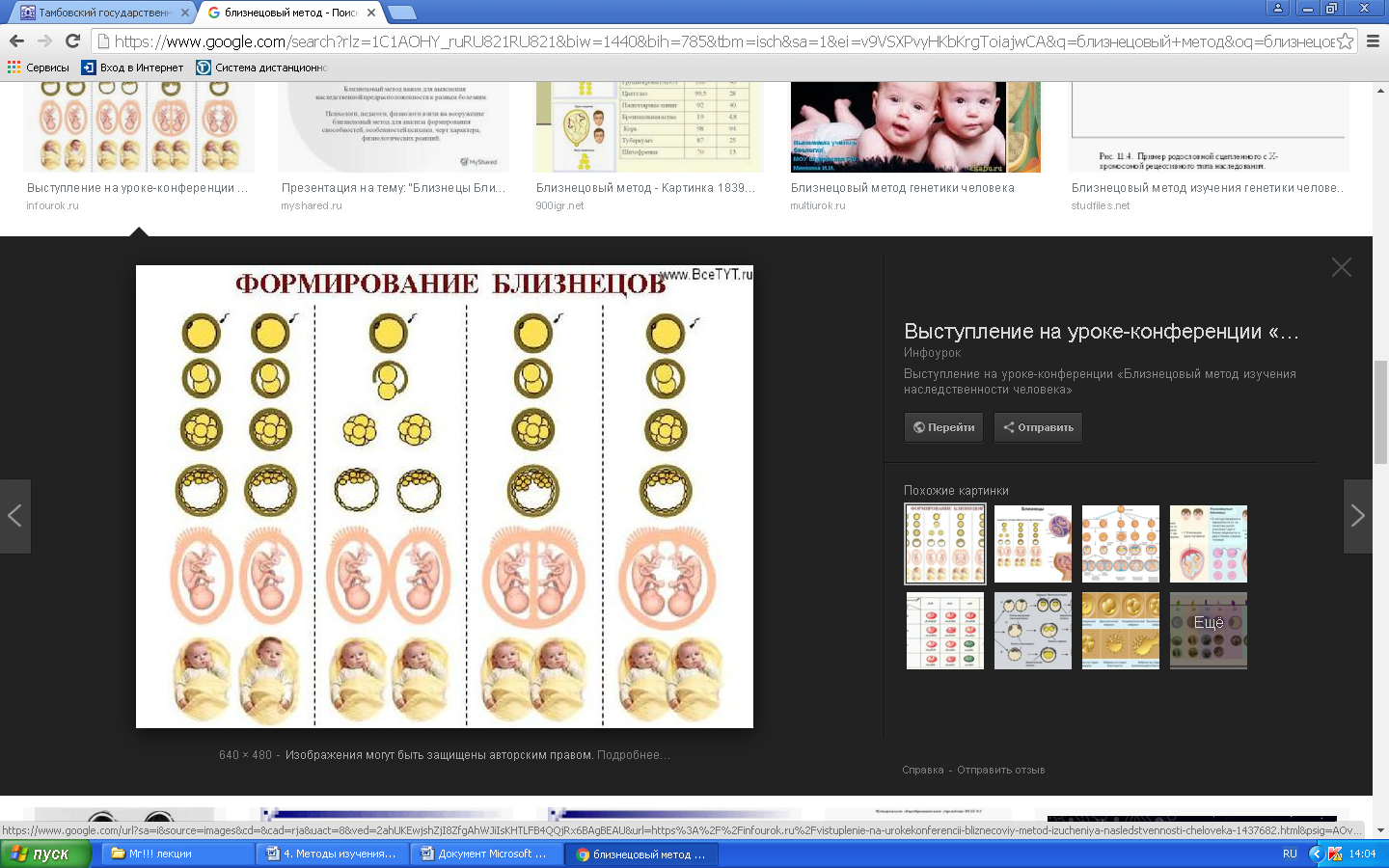 Одинаковые внешние условия и неполная идентичность генотипов (50 %) у дизиготных близнецов обеспечивают относительно низкую степень конкордантности по тем заболеваниям в возникновении, которых факторы среды играют второстепенную роль. Сходство показателя конкордантности у моно - и дизиготных близнецов свидетельствует о незначительной роли наследственных различий и определяющей роли среды в формировании признака или развитии заболевания. Так незначительная разница в конкордантности отмечена среди близнецов по заболеваемости инфекционными болезнями. Установление соотносительной роли наследственности и среды в развитии различных патологических состояний позволяет врачу правильно оценить ситуацию и проводить профилактические мероприятия при наследственной предрасположенности к заболеванию или осуществлять вспомогательную терапию при его наследственной обусловленности. Трудности метода. Близнецовый метод считается достаточно объективным и чувствительным. Однако имеется ряд трудностей связанных, во-первых, с относительно низкой частотой рождения близнецов в популяции. В среднем она равна 1,1-1,2 % всех рождений. Из них одна треть приходится на монозиготных близнецов, а две трети - на дизиготных. Однако в связи с несколько повышенной смертностью среди близнецов, по сравнению с таковой у одиночно рожденных, доля близнецов среди населения составляет всего 0,9 %. Это осложняет подбор достаточного количества пар с исследуемым признаком. Количественной оценкой доли наследственной обусловленности признака является коэффициент наследуемости (H), рассчитываемый по следующей формуле, предложенной Хольцингером Н = (КМБ – КДБ)/(100- КДБ),где КМБ и КДБ – выраженная в процентах конкордантность признака для моно- и дизиготных близнецов соответственно. Если Н>70%, решающая роль в проявлении признака принадлежит наследственным факторам. При H<30%– средовые факторы являются основными в формировании признака. При промежуточных значениях Н предполагается примерно равное участие в контроле признака как генетических, так и средовых факторов. Например, при заболевании корью или коклюшем одного из партнеров близнецовой пары вероятность заболевания второго (конкордантность пары)в группах моно и дизиготных близнецов практически одинаковая: 98% и 94%и 97% и 93%, соответственно. Преобладающая роль инфекционного факторов в данном случае очевидна.  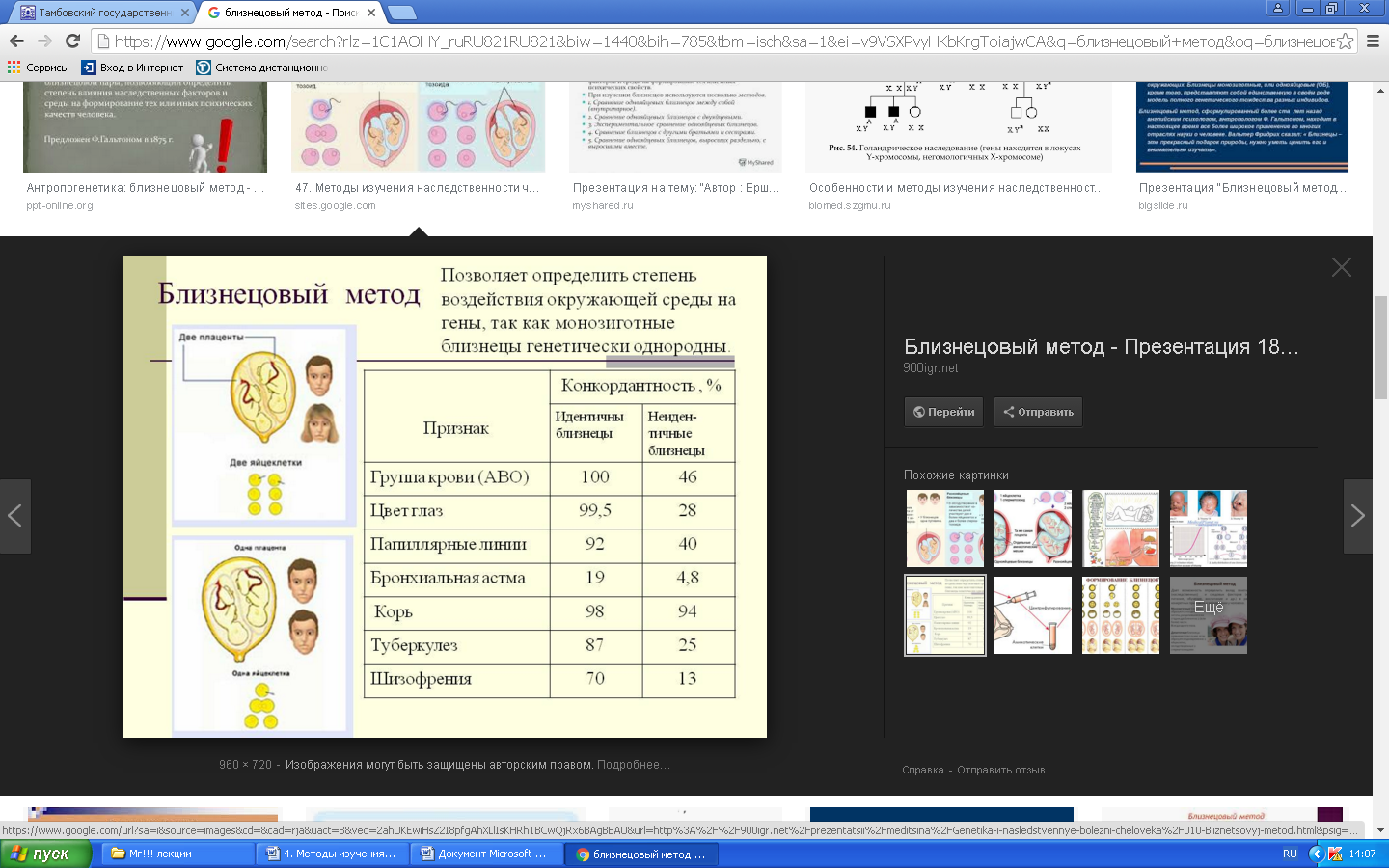 При туберкулезе вероятность заболевания второго близнеца в монозиготной паре почти в 3 раза больше, чем в дизиготной –67% и 23 %. То есть при идентичном генотипе сходная реакция на туберкулезную инфекцию наступает чаще, чем при разных генотипах. Этот факт показывает значительную роль наследственной предрасположенности ребенка к туберкулезу, что в настоящее время очень важно иметь в виду в связи с данными об увеличении распространенности туберкулеза. Популяционный метод Популяционный метод направлен на изучение частот аллелей игенотипов в различных популяциях, а также факторов, влияющих на их динамику. Этот метод особенно важен при проведении эпидемиологических исследований. Генетическое изучение популяций человека невозможно без учета географических и климатических условий. Но особенно важны демографические характеристики популяции, такие как численность, рождаемость, смертность, возрастная и социальная структура, национальный состав, религиозная принадлежность, образ жизни, особенности питания, наличие вредных привычек и др. Наследственные заболевания в разных популяциях, этнических группах и расах встречаются с разными частотами, и это обусловлено различиями в частотах и спектрах мутаций. Анализ соответствия распределения частот аллелей и генотипов в различных популяциях по закону Харди-Вайнберга позволяет судить о том, является ли популяция панмиктической, то есть соблюдается ли в ней принцип случайности скрещивания вне зависимости от генотипов особей. Важными практическими задачами являются анализ спектров и частот распределения в отдельных популяциях мутантных аллелей, ассоциированных с определенными наследственными заболеваниями, и выявление среди них мажорных (частых) мутаций.  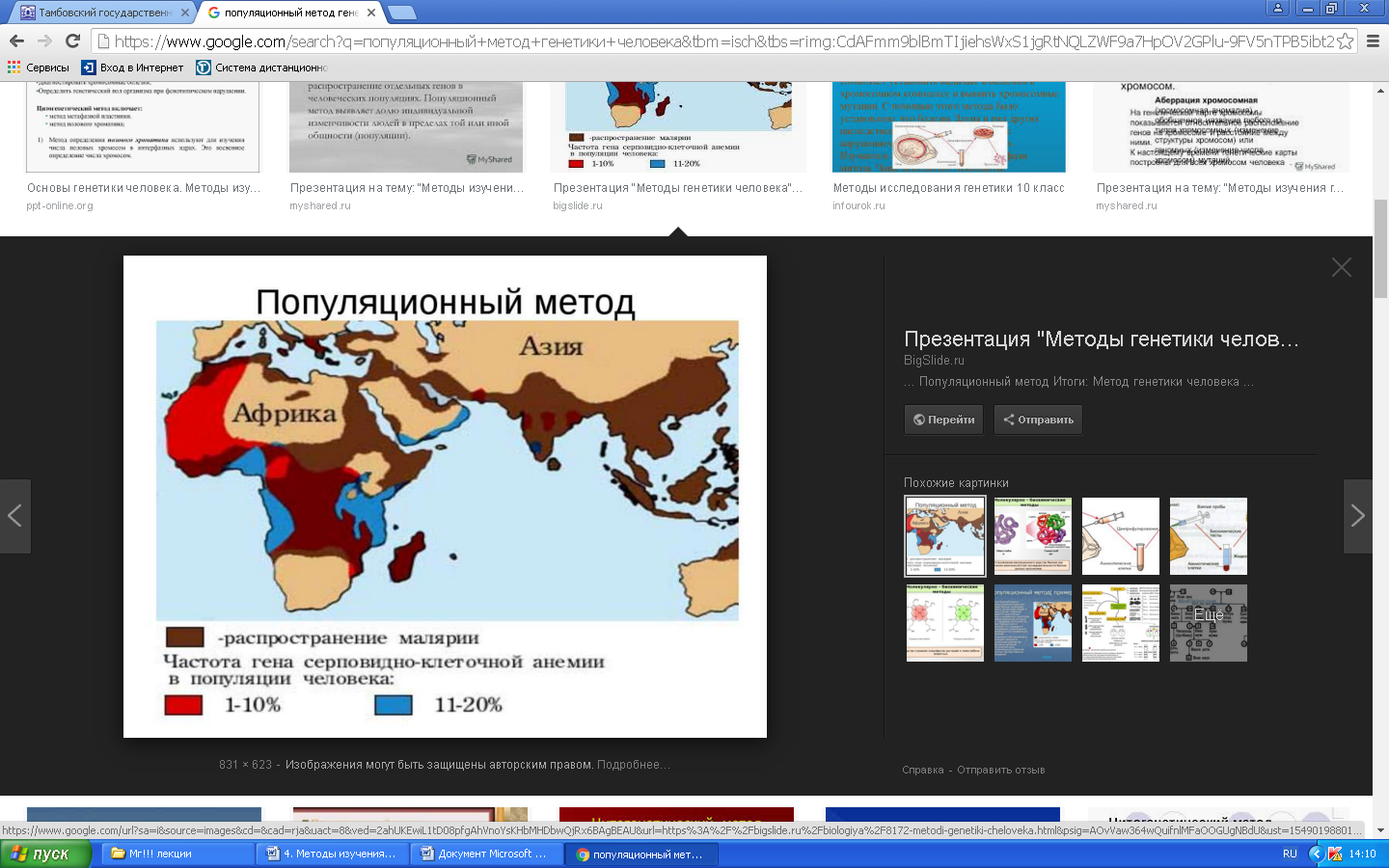  Цитогенетический метод Цитогенетический метод применяется для анализа кариотипа и его аномалий у отдельных индивидуумов. Для проведения исследования достаточно получить образец периферической крови пациента объемом 1-2мл. Анализ кариотипа проводят в три этапа: культивирование лимфоцитов крови, окраска препарата и его микроскопический анализ. Культивирование проводят для того, чтобы стимулировать деление лимфоцитов, так как успех цитогенетического исследования зависит от количества клеток, находящихся на стадии метафазы, когда хромосомы находятся в наиболее компактной форме. Продолжительность культивирования обычно составляет 72 часа. Для увеличения количества метафазных клеток в конце культивирования в среду вводят колхицин, который приостанавливает деление на стадии метафазы, разрушает веретено деления и увеличивает конденсацию хромосом. Далее клетки помещают в гипотонический раствор, который приводит к разрыву ядерной оболочки и свободному перемещению хромосом в цитоплазме. Наследующем этапе клетки фиксируют смесью этанола и уксусной кислоты в соотношении 3:1, их суспензию раскапывают на предметные стекла и высушивают. В зависимости от целей кариотипирования используют различные методы дифференциального окрашивания хромосом (G-, R-, C-,Q-методы). Процедура окрашивания занимает несколько минут и приводит к появлению рисунка поперечной исчерченности, специфичного для каждой хромосомы. Световое микроскопирование окрашенных препаратов является самым трудоемким этапом всего исследования, требующим высокой квалификации. Для выявления хромосомных аномалий необходимо проанализировать не менее 30 метафазных пластинок. Большой эффективностью обладают методы компьютерного анализа хромосом. Внедрение молекулярных технологий в сочетании с использованием флюоресцентных окрасок резко увеличивает разрешающую способность цитогенетического анализа. При этом отдельные сегменты хромосом могут быть окрашены в разные цвета, а кариотипы в целом выглядят как фантастические удивительно красочные картины. Разработаны также методы окрашивания хромосом в клетках, находящихся в состоянии покоя, когда хромосомы максимально растянуты. С их помощью могут быть идентифицированы сегменты хромосом размером около 50 килобаз (1 кб = 1000 нуклеотидов). 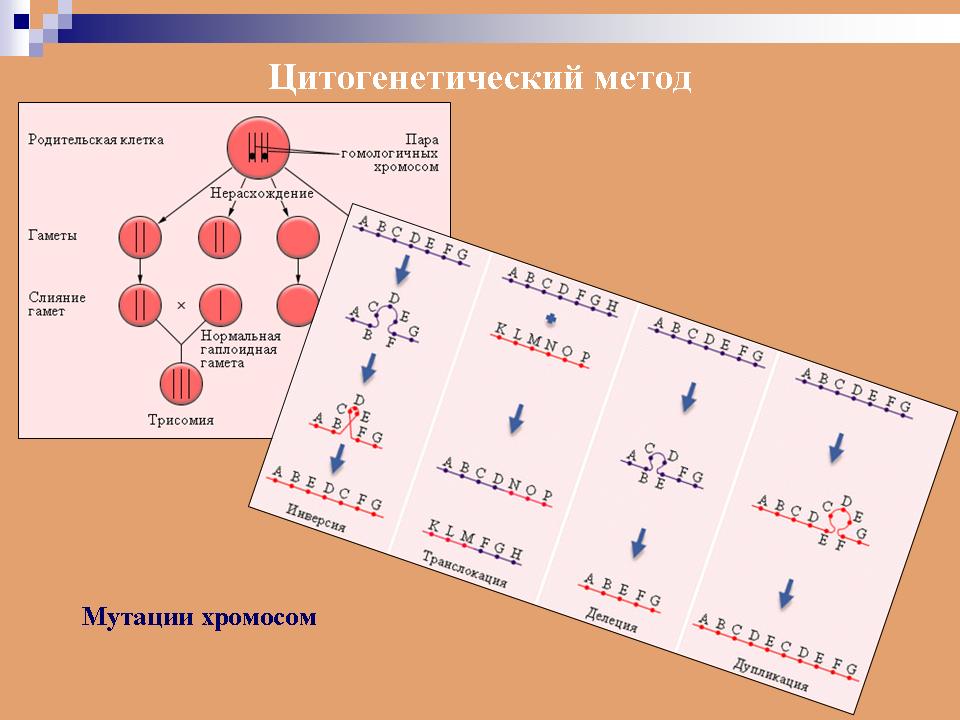  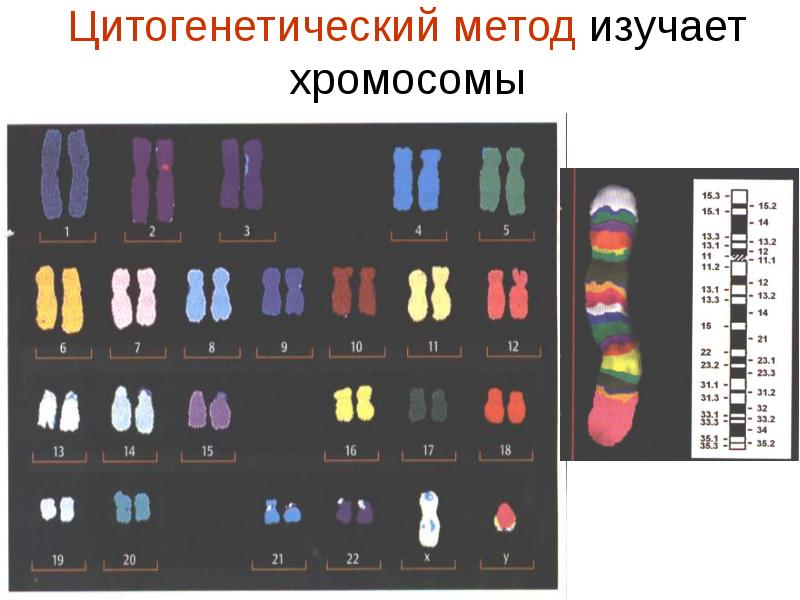 Цитогенетический анализ проводится с целью определения кариотипа, а также изучения структуры и функции хромосом, определения частоты сестринских хроматидных обменов, частоты и типов аббераций хромосом, исследования полового хроматина. Объект цитогенетических исследований - делящиеся соматические, мейотические и интерфазные клетки. Большинство цитогенетических исследований проводится на соматических клетках В цитогенетике применяются следующие методы: световая микроскопия, электронная и конфокальная лазерная микроскопия, люминисцентная микроскопия. Материал: клетки слизистых оболочек, амниотической жидкости, ворсин хориона, плаценты, пуповинной крови, костного мозга. Наиболее удобным объектом для приготовления цитогенетических материалов является культура лимфоцитов периферической крови. Показания для цитогенетического исследования 1) наличие случая хромосомного заболевания (ХЗ) в семье, либо подозрение на ХЗ по клиническим проявлениям: множественные микро- и макроаномалии у пробанда, особенно в сочетании с отставанием в психоречевом и моторном развитии; задержка умственного и физического развития и др.(см. тема №2) ; 2) первичное невынашивание беременности (2 и более спонтанных аборта, либо выкидыша, мертворождения), первичная аменорея, бесплодие у женщин и мужчин, что может быть обусловлено носительством сбалансированных хромосомных перестроек; 3) пренатальная диагностика хромосомной патологии; 4) синдромы с хромосомной нестабильностью (пр.: лейкоз, наследственные анемии, иммунодефицитные состояния); 5) оценка эффективности лечения, прогноза при лейкозах; 6) оценка мутагенных воздействий. Исследование набора хромосом проводят используя различные методики рутинного окрашивания, при котором все хромосомы приобретают одинаковый цвет, равномерно распределенный по их длине. Такой метод позволяет определить количественные нарушения кариотипа, а также выявлять некоторые крупные внутри- и межхромосомные перестройки без уточнения их происхождения. 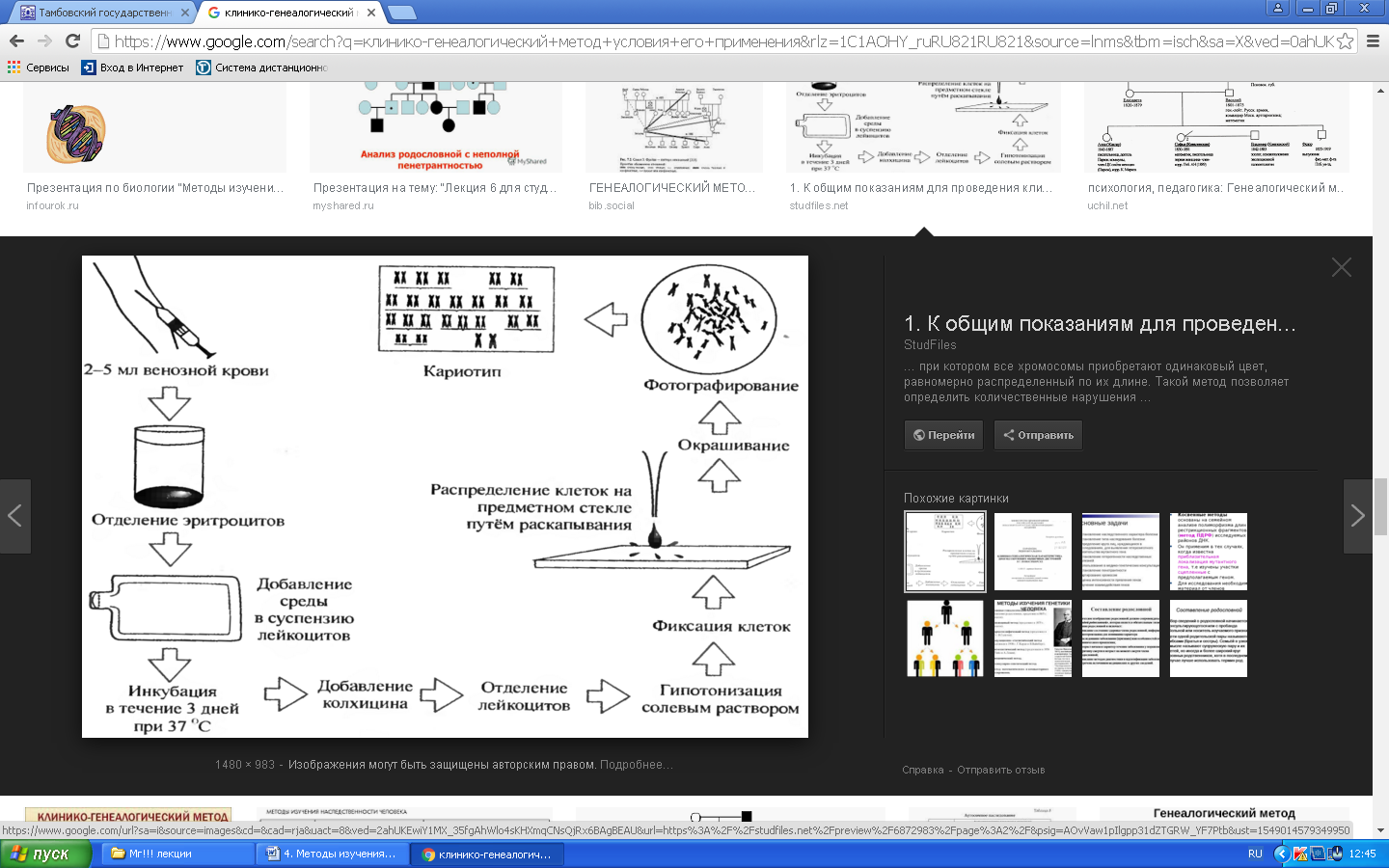 Метод дерматоглифики. Дерматоглифический анализ — это изучение папиллярных узоров пальцев, ладоней и стоп. На этих участках кожи имеются крупные дермальные сосочки, а покрывающий их эпидермис образует гребни и борозды. Дерматоглифические узоры обладают высокой степенью индивидуальности и остаются неизменными в течение всей жизни. Поэтому их используют для определения зиготности близнецов, для идентификации личности в криминалистике и установления отцовства в судебной медицине. Трудности использования дерматоглифического анализа в медицине заключаются в отсутствии специфических изменений дерматоглификипри определенных заболеваниях. В медико-генетических консультациях дерматоглифический анализ чаще используется в качестве экспресс-метода диагностики некоторых геномных мутаций (болезни Дауна), реже - хромосомных мутаций.
Папиллярные гребни на различных участках гребешковой кожи образуют узоры разного типа и ориентации. Узоры изучают на отпечатках, сделанных на бумаге, после нанесения на кожу типографской краски. На пальцевых подушечках имеются узоры трех типов: дуги (А - arch), петли (L - loop) и завитки(W - whorl). Для большинства узоров характерна дельта (трирадиус) - место схождения трех разнонаправленных папиллярных линий. Дуга представляет собой открытый, бездельтовый узор; петля - замкнутый с одной стороны, однодельтовый узор; завиток - полностью замкнутый, двухдельтовый узор. Иногда встречаются комбинированные сложные узоры. Количественным показателем узора является гребневый счет - число папиллярных линий между дельтой и центром узора. Гребневый счет дугового узора равен нулю. Узоры, аналогичные пальцевым, имеются и на ладонях - в области тенора и гипотенора и на II, III, IV и V межпальцевых промежутках. В межпальцевых промежутках имеются трирадиусы (a, b, c, d), а вблизи браслетной складки расположен главный ладонный трирадиус t. Если соединить трирадиусы a, d и t, то получим главный ладонный угол atd, который в норме не превышает 57°. На ладони различают три главные флексорные (сгибательные) борозды: борозды большого пальца, косая и поперечная. Иногда косая борозда сливается с поперечной в одну четырехпальцевую борозду (ЧПБ). Частота ее встречаемости в норме не превышает 5%. Совокупность радиальных петель на IV и V пальцах, четырехпальцевой борозды и главного ладонного угла свыше 60°-80° свидетельствует о врожденной компоненте наследственного заболевания. 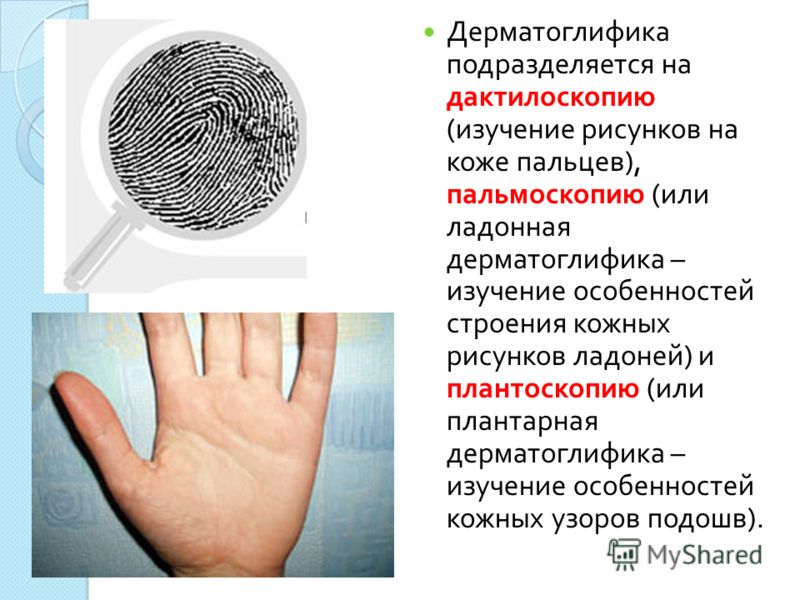  Биохимический, иммунологический и микробиологический методы Биохимический и иммунологический методы основаны на анализе различных классов органических и неорганических соединений, дефектных при разных наследственных заболеваниях, в первую очередь, при наследственных болезнях обмена. Биохимические нарушения, как правило, предшествуют появлению клинических симптомов заболевания и являются по сравнению с ними более константными. Предметом биохимической диагностики могут быть белки, аминокислоты, углеводы, липиды, ионы металлов и др., а также их метаболиты. При этом исследовать можно разные ткани и секреты организма (кровь, моча, слюна, пот, ликвор, амниотическая жидкость, биоптаты мышц, кожи, печени и других специализированных тканей). Биохимические методы играют первостепенную роль в диагностике наследственных нарушений обмена веществ. В некоторых случаях они позволяют выявлять гетерозиготных носителей мутаций. Очень важна роль биохимических методов анализа при проведении массовых скринингов беременных или новорожденных с целью более раннего выявления наследственных заболеваний. Ключевая роль в патогенезе любого моногенного заболевания принадлежит первичному биохимическому дефекту – тому белку, который кодируется мутантным геном. Идентификация и анализ первичного биохимического дефекта, определение первичной патологической метаболической цепи – вот главные цели биохимической генетики, решение которых является основой для разработки патогенетических методов профилактики и терапии наследственных заболеваний. Не менее важна роль биохимических методов при диагностике вторичных нарушений. Например, первичным биохимическим дефектом при мышечной дистрофии Дюшенна/Беккера является недостаточность дистрофина – белка, соединяющего цитоскелет мышечной клетки с внеклеточным матриксом. В результате этого нарушения в крови больных повышается уровень одного из мышечных ферментов креатинфосфокиназы, как в начале заболевания, так и в его развернутой стадии. Более того, содержание этого фермента повышено у 30% гетерозиготных носительниц мутации. Хотя это нарушение является вторичным, но простата тестирования креатинфосфокиназы и стойкость его повышения у больных делают его удобным диагностическим маркером заболевания. Разнообразие биохимических методов огромно, и они постоянно совершенствуются. Их подразделяют на качественные, количественные и полуколичественные. Качественные реакции позволяют обнаруживать избыточное количество промежуточных метаболитов, накапливающихся при наследственных болезнях обмена в результате блока ферментативной реакции. Они просты, недороги и достаточно чувствительны. Часто в качестве субстрата для качественной реакции используется моча. Полуколичественные и количественные тесты проводятся как с мочей, так и с кровью. Наиболее простые из них измерение пирувата, лактата, ионов аммония, измерение кислотно-щелочного баланса. Ведущая роль в диагностике наследственных болезней обмена принадлежит высокоточным количественным тестам, использующим методы флуориметрии, спектрофотометрии, хромотографии, электрофореза, масс-спектрометрии. Некоторые методы позволяют одновременно проводить количественную оценку нескольких тысяч метаболических маркеров. Однако эти методы требуют использования достаточно дорогого оборудования и расходных материалов. В некоторых случаях иммунологические методы анализа белков оказываются более эффективными по сравнению с биохимическими. Среди них следует упомянуть иммуногистохимический метод, позволяющий проводить анализ белков и определять их локализацию в специализированных клетках и тканях организма. |
