М.И.Кузин. Хирургические болезни. Литература для студентов медицинских вузов Хирургические болезни Под редакцией
 Скачать 10.27 Mb. Скачать 10.27 Mb.
|
5.6. Опухоли молочной железы5.6.1. Доброкачественные опухолиПатологоанатомическая картина. Опухоль состоит из пролиферирую-щих эпителиальных элементов и соединительной ткани. Различают пери-и интраканаликулярные фиброаденомы. Размеры опухоли различны — от микроскопических до гигантских (листовидная опухоль молочной железы). 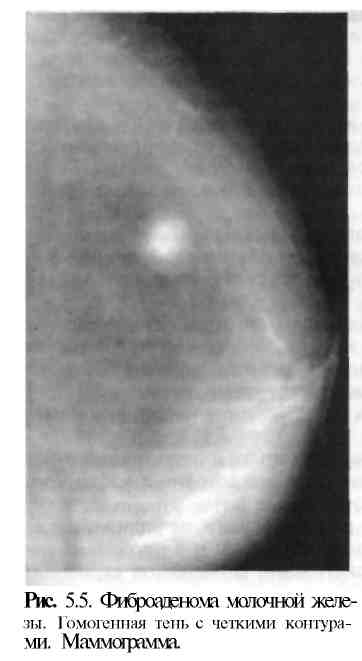 К К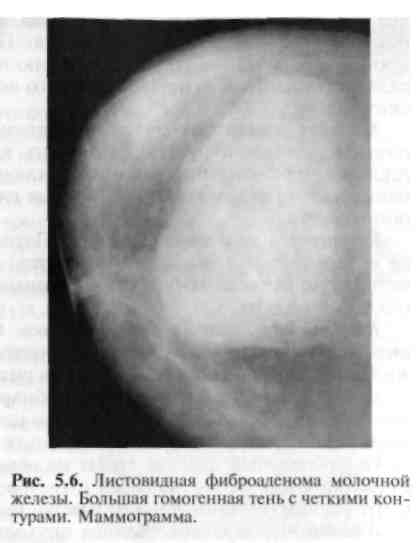 линическая картина и диагностика. Фиброаденома имеет округлую форму, четкие контуры, ровную гладкую поверхность, не спаяна с окружающими тканями. Пальпация ее безболезненна. При пальпации молочной железы в положении лежа опухоль не исчезает. На маммограмме видна тень округлой формы с четкими контурами (рис. 5.5). Более информативно УЗИ, так как позволяет выявить полость кисты и тем самым помочь дифференциальной диагностике между кистой и фиброаденомой. У пожилых женщин в фиброаденоме на фоне выраженного фиброза могут быть выявлены отложения кальция. При гистологическом исследовании отмечаются разные составляющие повышенного риска малигнизации, особенно у молодых женщин. линическая картина и диагностика. Фиброаденома имеет округлую форму, четкие контуры, ровную гладкую поверхность, не спаяна с окружающими тканями. Пальпация ее безболезненна. При пальпации молочной железы в положении лежа опухоль не исчезает. На маммограмме видна тень округлой формы с четкими контурами (рис. 5.5). Более информативно УЗИ, так как позволяет выявить полость кисты и тем самым помочь дифференциальной диагностике между кистой и фиброаденомой. У пожилых женщин в фиброаденоме на фоне выраженного фиброза могут быть выявлены отложения кальция. При гистологическом исследовании отмечаются разные составляющие повышенного риска малигнизации, особенно у молодых женщин.Фиброаденома (аденофиброма) — доброкачественная опухоль молочной железы, наиболее часто встречающаяся в возрасте 15—35 лет в основном (90%) в виде одиночного узла. Некоторые исследователи относят фиброаденому к дисгормональным дисплазиям. Лечение. Опухоль обычно удаляют вместе с выраженной капсулой и небольшим количеством окружающей молочную железу ткани. У молодых женщин при операции следует позаботиться о косметическом результате. Разрез рекомендуют делать по краю ареолы. Затем несколько туннелируют ткань для доступа и удаления аденомы. При удалении ее одновременно убирают минимум здоровой ткани для получения хорошего косметического результата. Швы в глубине раны не накладывают. В Европе при уверенности в диагнозе фиброаденомы небольших размеров не удаляют. Фиброаденомы больших размеров (около 5 см в диаметре), наблюдающиеся иногда у молодых женщин, подлежат удалению и срочному гистологическому исследованию. По клиническим данным фиброаденому почти невозможно отличить от гамартомы. В таких случаях опухоль подлежит удалению. Листовидная опухоль молочной железы является разновидностью периканаликулярной фиброаденомы. Она имеет характерную слоистую структуру, хорошо отграничена от окружающих тканей, однако настоящей капсулы не имеет. Часто она спаяна с кожей, быстро увеличивается в размерах. При достаточно больших размерах опухоли появляются истончение и синюшность кожи над ней. Листовидная фиброаденома иногда подвергается злокачественному перерождению и метастазирует в кости, легкие и другие органы (рис. 5.6). Лечение. Хирургическое вмешательство является основным методом лечения. Объем операции зависит от размеров опухоли. При малых размерах производят секторальную резекцию, при новообразованиях диаметром более 8—10 см — простую мастэктомию. Удаленная опухоль подлежит срочному гистологическому исследованию. При злокачественном перерождении производят радикальную мастэктомию по Пейти. Дальнейшее лечение определяется данными гистологического исследования удаленных лимфатических узлов. Аденома, гамартома молочной железы встречаются редко. Обе опухоли плотные, имеют округлую форму, их трудно отличить от фиброаденомы. Аденома четко отграничена от окружающей ткани молочной железы. Уточнение диагноза возможно лишь после гистологического исследования макропрепарата. Кровоточащая молочная железа. Патологическое выделение кровянистого содержимого из соска наблюдается при внутрипротоковой папилломе, которая может возникнуть как в крупных протоках, связанных с соском, так и в более мелких. Клиническая картина и диагностика. Основным симптомом заболевания является выделение из сосков желтовато-зеленой, бурой или кровянистой жидкости, иногда сопровождающееся сильными болями в молочной железе. Дуктография дает возможность обнаружить дефекты наполнения в протоках, точно определить локализацию папиллом. Дефекты наполнения имеют четкие контуры, округлые очертания. Окончательный диагноз ставят на основании данных цитологического исследования вьщелении из соска и гистологического исследования удаленного центрального (подареолярного) участка молочной железы. Липома — доброкачественная опухоль, развивающаяся из жировой ткани, обычно располагается над тканью молочной железы и в ретромаммар-ном пространстве. Опухоль мягкой консистенции, дольчатого строения. Встречается чаще у пожилых женщин. На маммограмме выявляется в виде просветления с четкими ровными контурами на фоне более плотной железистой ткани. Лечение. Удаление опухоли. 5.6.2. Злокачественные опухоли5.6.2.1. РакРак молочной железы — злокачественная опухоль, развивающаяся обычно из эпителия молочных протоков (80%) и долек железы. Заболеваемость раком молочной железы у женщин неуклонно увеличивается в последние десятилетия и занимает одно из первых мест среди злокачественных новообразований. Частота рака молочной железы колеблется от 80 (США) и 76,1 (Великобритания) до 48,4 (ФРГ) и 46 (Россия) на 100 000 женского населения. Рак молочной железы среди мужчин составляет 0,2 на 100 000 человек. В Москве и Санкт-Петербурге рак молочной железы — наиболее частое онкологическое заболевание у женщин. Заболеваемость женщин, живущих в крупных городах, выше, чем у проживающих в сельской местности. Наиболее часто болеют женщины в возрасте 50—60 лет. По американской статистике, для женщин в возрасте 35 лет риск заболеть раком молочной железы по истечении 20 лет, т. е. к 55 годам, составляет всего 2,5%; для женщин 50-летнего возраста опасность развития рака в период до 75 лет равна 5%. Этиология. Причиной, способствующей развитию рака молочной железы, является сочетание нескольких факторов риска: 1) наличие рака молочнои железы у прямых родственников; 2) раннее менархе; 3) позднее наступление менопаузы; 4) поздние первые роды (после 30 лет), не рожавшие женщины; 5) фиброкистозная мастопатия при наличии участков атипической гиперплазии эпителия молочных желез; 6) внутрипротоковый или дольковый рак in situ в анамнезе (инвазивный или неинвазивный); 7) мутация генов BRCA-1, BRCA-2 и BRCA-3. BRCA-1 предрасполагает к появлению рака молочных желез и яичников. BRCA-2 имеет отношение только к риску возникновения рака молочных желез. Оба гена BRCA-1 и BRCA-2 в 75% случаев имеют отношение к наследственному раку молочных желез. 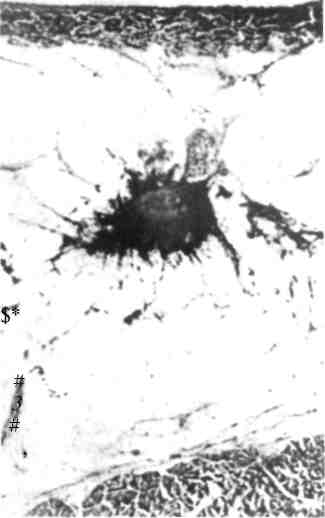 Рис. 5.7. Раковая опухоль на разрезе (скирр). Макропрепарат. Повышение эстрогенной активности, избыточный синтез половых гормонов или введение их в организм по медицинским показаниям стимулируют пролиферацию эпителия молочных желез, способствуют развитию его атипии. Хронические воспалительные процессы в женских половых органах, послеродовые маститы, приводящие к прекращению лактации, расстройства менструально-овариальной функции также могут рассматриваться как предрасполагающие факторы к возникновению рака молочной железы. Большое значение для лечения рака, течения и исхода заболевания имеет состояние эстрогенных рецепторов (ЭРЦ)). Наличие их в опухоли может в корне изменить течение болезни, поэтому выявление ЭРЦ в тканях удаленной опухоли так важно. ЭРц-позитивные опухоли чаще обнаруживаются у больных в менопаузе (при первичных раках 60—70% случаев). ЭРц-негатив-ные опухоли чаще выявляют в пременопаузе. У одной трети больных с ЭРЦ-негативными первичными раками молочных желез в последующем развиваются рецидивы ЭРц-положительных опухолей. Патологоанатомическая картина. Рак молочной железы чаще развивается из эпителия млечных протоков. Дольковый рак развивается из эпителия, долек железы. Он составляет 1—2% всех раков молочной железы и характеризуется мультицентрическим ростом опухоли. Правая и левая молочные железы поражаются одинаково часто. Двустороннее поражение молочных желез встречается в 13% наблюдений, а при дольковом раке — несколько чаще. Опухоль второй железы нередко имеет метастатический характер. Макроскопически различают узловую и диффузную формы рака молочной железы (рис. 5.7). В основном наблюдается узловая форма, при которой опухоль чаще всего локализуется в верхненаружном квадранте (47—60% больных). Далее по частоте локализации идут верхневнутренний квадрант (12%), нижневнутренний (6%), нижненаружный (10%) и центральный (12% больных). Клиническая картина. При диффузном раке опухолевый узел в железе в большинстве случаев не пальпируется. Опухоль выявляется в виде инфильтрата без четких границ, который может занимать значительную часть молочной железы. Диффузная форма наблюдается при отечно-инфильтратив-ном, воспалительном (маститоподобном или рожистоподобном) и панцирном раке. Диффузные формы рака характеризуются быстрым ростом и ранним метастазированием. Прогноз неблагоприятный. Метастазирование рака молочной железы происходит главным образом лимфогенным и гематогенным путями, наиболее часто в кости, легкие, плевру. При определении стадии заболевания учитывается размер опухоли и распространенность процесса (Т — tumor), метастазы в регионарные лимфатические узлы (N — nodus) и наличие отдаленных метастазов (М — metastasis). Международная классификация рака молочной железы по системе TNM (1997 г.) Т — первичная опухоль Тх — первичная опухоль не выявлена Tis — преинвазивная карцинома: интрадуктальная или дольковая карцинома in situ; болезнь Педжета (поражение соска без наличия опухоли) Примечание. Болезнь Педжета, при которой пальпируется опухолевый узел, классифицируется по его размерам Т.1 — опухоль менее 2 см в наибольшем измерении T.I mic — микроинвазия 0,1 см и меньше в наибольшем измерении Т.1а — опухоль более 0,1 см, но не более 0,5 см в наибольшем измерении Т. lb — опухоль более 0,5 см, но не более 1 см в наибольшем измерении Т. 1с — опухоль более 1 см, но не более 2 см в наибольшем измерении Т.2 — опухоль более 2 см, но не более 5 см в наибольшем измерении Т.З — опухоль более 5 см в наибольшем измерении Т.4 — опухоль любого размера с прямым распространением на грудную стенку или кожу Т.4а — распространение на грудную стенку Т.4Ь — отек (включая "лимонную корочку"), или изъязвление кожи молочной железы, или сателлиты в коже железы Т.4с — признаки, перечисленные в Т4а и Т4Ь T.4d — воспалительная карцинома N — Регинарные лимфатические узлы Nx — недостаточно данных для оценки состояния регионарных лимфатических узлов N0 — нет признаков поражения регионарных лимфатических узлов N1 — метастазы в смещаемых подмышечных лимфатических узлах на стороне поражения N2 — метастазы в подмышечных лимфатических узлах, фиксированных на стороне поражения. N3 — метастазы во внутренних лимфатических узлах молочной железы на стороне поражения М — Отдаленные метастазы Мх — недостаточно данных для определения отдаленных метастазов МО — нет признаков отдаленных метастазов Ml — имеются отдаленные метастазы Примечание. Степень Т и N уточняется при гистологическом исследовании опухоли и удаленных лимфатических узлов. В нашей стране принята клинико-анатомическая классификация рака молочной железы с выделением четырех стадий распространения опухолевого процесса, которым соответствуют следующие сочетания TNM по Международной классификации. Клинические стадии (основаны на TNM)
Па стадия — опухоль 2—5 см в диаметре. Пальпируются подвижные подмышечные лимфатические узлы, отдаленных метастазов нет. Пятилетняя выживаемость 66% ( Т О N1 М О , Т1 N1 М О , N0 М О ) . ПЬ стадия (Т2 N1 МО, ТЗ N0 МО). Ша стадия — опухоль более 5 см, возможно локальное прорастание, пальпируются лимфатические узлы за пределами подмышечной области, отдаленных метастазов нет. Пятилетняя выживаемость 41% ( Т О N2 М О , Т1 N2 М О , Т2 N2 М О , ТЗ N1-2M0). ШЬ стадия (Т4 любая N МО, любая Т N3 МО). IV стадия характеризуется отдаленными метастазами. Пятилетняя выживаемость 10% (любая Т любая N Ml). Приведенная классификация удобна в практической деятельности, так как предусматривает для каждой стадии заболевания определенные лечебные мероприятия. Клиническая картина и диагностика. В доклинической стадии выявление опухоли возможно при специально организованном диспансерном обследовании, включающем ультразвуковое исследование, маммографию. При этом обнаруживают опухоли или скопление микрокальцинатов диаметром до 0,5 см, которые не могут быть выявлены при пальпации. Обычно женщина сама обнаруживает опухоль в молочной железе, что заставляет ее обратиться к врачу. Иногда это происходит неожиданно для больной при профилактическом осмотре или обращении к врачу по поводу другого заболевания. В этот период опухоль обычно уже имеет диаметр 2— 5 см. 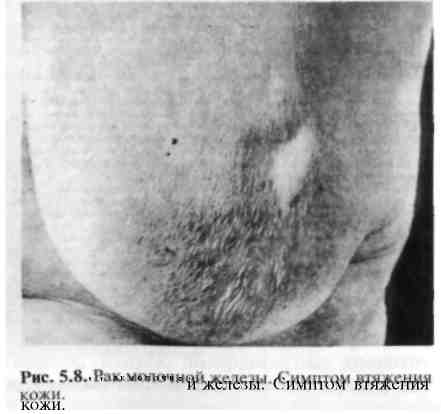 Узловая форма. При этой форме рака пальпируется узел плотной консистенции, чаще безболезненный, с неровной поверхностью и нечеткими контурами. Отмечается положительный симптом Кенига (опухоль не исчезает при переводе пациентки из положения сидя в положение лежа). Для выяснения связи опухоли с кожей последняя берется в небольшую складку над образованием. Если этот прием удается так же хорошо, как и на некотором отдалении от места расположения опухоли, можно говорить о том, что кожа с ней не связана. При начинающейся инфильтрации кожи опухолью сдавление небольшого участка ее приводит к образованию более глубокой складки, иногда с втянутостью кожных пор (рис. 5.8). Морщинистость кожи над опухолью может появляться уже на ранних стадиях рака. Этот симптом указывает на то, что опухоль растет наиболее интенсивно по направлению к коже, прорастая жировую клетчатку и расположенные в ней соединительнотканные связки. По мере увеличения размера опухолевого узла происходит втяжение кожи — симптом "умбиликации" (рис. 5.9). Симптом "лимонной корки" является признаком распространения опухолевого процесса в глубоких кожных лимфатических щелях; при этом появляется отек, а на коже над опухолью резко выступают поры потовых желез (рис. 5.10). С 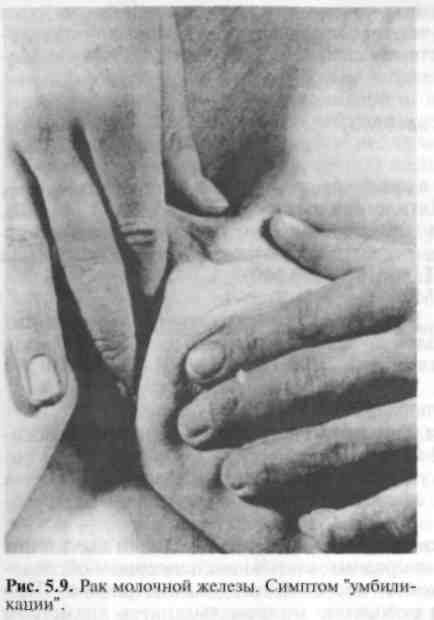 тепень вовлечения подлежащих тканей в процесс определяют, захватывая опухоль пальцами и смещая ее в продольном и поперечном направлениях. После этого выявляют подвижность опухоли при отведенной до прямого угла руке, тепень вовлечения подлежащих тканей в процесс определяют, захватывая опухоль пальцами и смещая ее в продольном и поперечном направлениях. После этого выявляют подвижность опухоли при отведенной до прямого угла руке,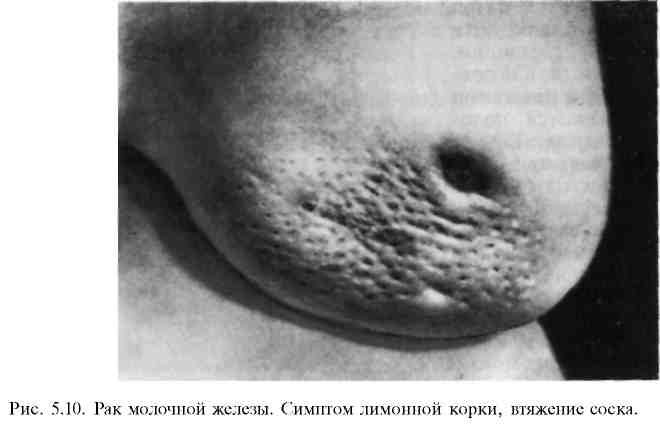 т. е. при растянутой большой грудной мышце, а также при плотно приведенной руке, т. е. при сокращенной грудной мышце. Если при этом подвижность опухоли резко уменьшается, можно считать прорастание доказанным. Полная неподвижность опухоли свидетельствует о значительной степени прорастания опухоли в грудную стенку (симптом Пайра). Для определения связи опухоли с соском его фиксируют пальцами одной руки, а пальцами другой руки (плашмя) опухоль прижимают к грудной стенке. При смещении соска опухоль остается неподвижной, следовательно, связи с соском нет; если опухоль смещается вместе со смещаемым соском, имеется прорастание, инфильтрация протоков (симптом Пибрама). Деформация соска, его втяжение выявляются при явном распространении опухоли по протокам. Вследствие эмболии раковыми клетками субареоляр-ного лимфатического сплетения появляется отек кожи ареолы и соска. Д и ф ф у з н ы е формы. Различают отечно-инфильтративную форму, воспалительную (маститоподобный, рожистоподобный рак), панцирный рак, рак Педжета.
При обследовании выявляют трудно отличимое от истинной экземы эк-земоподобное поражение кожи, сопровождающееся зудом, гиперемией, мокнутием соска, образованием корочек, чешуек, поверхностных кровоточащих язвочек; обнаруживают также деформацию соска или его разрушение, пальпируемую опухоль в железе. Метастазы в регионарных лимфатических узлах появляются относительно поздно. Диагноз подтверждается в случае обнаружения при гистологическом исследовании клеток рака молочных протоков (у 80%) или крупных пузырьковидных клеток Педжета, корочек, чешуек, содержимого пузырьков. Ранняя диагностика рака молочной железы затруднена, однако возможна при диспансерном обследовании женщин, составляющих группу повышенного риска. Это женщины старше 35 лет; лица с дисгормональными заболеваниями молочных желез; оперированные в прошлом по поводу заболеваний молочной железы; страдающие заболеваниями матки, яичников и маточных труб (придатков матки), дисменореей; женщины, у которых в ходе массового профилактического обследования обнаружены затемнения на флюорограмме; имеющие отягощенную по раку молочной железы наследственность. 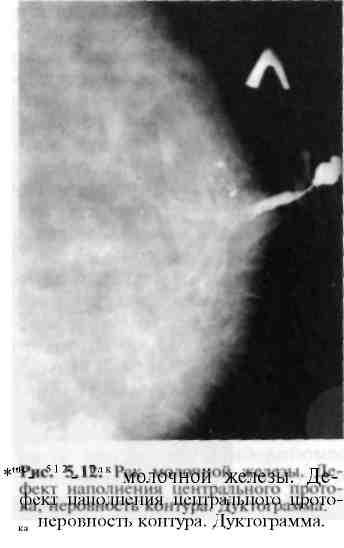  Для более раннего выявления рака молочной железы необходимо пациенток, относящихся к группе риска, периодически осматривать, проводить УЗИ, при необходимости — маммографию. Маммография и УЗИ необходимы для дифференциальной диагностики пальпируемых уплотнений в молочной железе. При несомненном диагнозе рака молочной железы маммографию выполняют с целью уточнения изменений в противоположной молочной железе. При пальпируемом раке на маммограммах определяют тень ракового узла, чаще одиночную, неправильной формы с неровными контурами и тяжистостью по периферии. Иногда выявляют мелкие отложения извести (микрокальцинаты). При диффузных формах рака молочной железы обнаруживают скопления мик-рокальцинатов на ограниченном участке, диффузное утолщение кожи, перестройку структуры молочной железы (рис. 5.11). При опухолях, развивающихся из протоков, на дуктограммах молочной железы определяются дефекты наполнения в протоке — сужение или обтурация протока (рис. 5.12). П  ри непальпируемом раке молочной железы, когда диаметр опухоли не превышает 0,5 см, на маммо-граммах выявляют тень узла неправильной или звездчатой формы с тяжистостью по периферии или только скопления микрокальцина-тов на ограниченном участке (рис. 5.13; 5.14). ри непальпируемом раке молочной железы, когда диаметр опухоли не превышает 0,5 см, на маммо-граммах выявляют тень узла неправильной или звездчатой формы с тяжистостью по периферии или только скопления микрокальцина-тов на ограниченном участке (рис. 5.13; 5.14).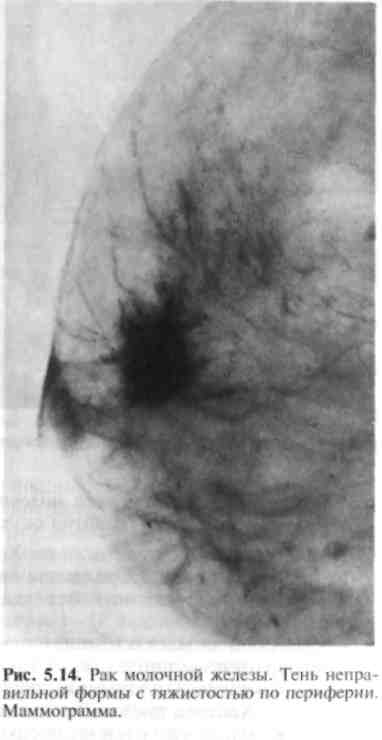 В настоящее время широко используется в качестве скринингового метода ультразвуковое исследование молочных желез. Оно дает возможность на основании особенностей УЗИ-семиотики предположить структуру опухоли, облегчает получение субстрата для морфологического исследования при помощи пункционной тонкоигольной аспирационной биопсии. При сопоставлении УЗИ-семиотики и данных морфологического исследования удаленной опухоли установлено, что различные формы рака имеют разную УЗИ-картину. Для инвазивного протокового рака, скиррозной карциномы, большинства случаев долькового рака характерно наличие акустической тени позади образования ("заднее усиление" тени). При медуллярном слизистом раке акустической тени позади предполагаемой опухоли нет. При внутрипротоковом раке отмечается симптом "заднего усиления". УЗИ позволяет легко отличить кисту от плотных узлов по просветлению рисунка над кистой (рис. 5.15). В настоящее время широко используется в качестве скринингового метода ультразвуковое исследование молочных желез. Оно дает возможность на основании особенностей УЗИ-семиотики предположить структуру опухоли, облегчает получение субстрата для морфологического исследования при помощи пункционной тонкоигольной аспирационной биопсии. При сопоставлении УЗИ-семиотики и данных морфологического исследования удаленной опухоли установлено, что различные формы рака имеют разную УЗИ-картину. Для инвазивного протокового рака, скиррозной карциномы, большинства случаев долькового рака характерно наличие акустической тени позади образования ("заднее усиление" тени). При медуллярном слизистом раке акустической тени позади предполагаемой опухоли нет. При внутрипротоковом раке отмечается симптом "заднего усиления". УЗИ позволяет легко отличить кисту от плотных узлов по просветлению рисунка над кистой (рис. 5.15).Для уточнения диагноза производят тонкоигольную биопсию под контролем УЗИ или маммографии, при необходимости — секторальную резекцию молочной железы, позволяющую также выбрать тот или иной вид лечения.  Хирургическое лечение рака молочной железы является ведущим методом. В зависимости от стадии развития опухоли производят последующие операции:
3) простая мастэктомия без удаления подмышечных лимфатических узлов;
В 1894 г. Холстед предложил для лечения рака молочной железы радикальную мастэктомию, предусматривающую удаление молочной железы единым блоком вместе с большой и малой грудными мышцами, удалением подмышечных лимфатических узлов. Для предотвращения локальных рецидивов иссечение кожи, покрывающей железу, было столь обширным, что для закрытия дефекта приходилось прибегать к пластическим операциям. Для устранения этого недостатка разными авторами был предложен ряд модификаций разрезов, позволявших закрыть рану без пластики. Этот тип операции быстро завоевал популярность своим радикализмом и нашел широкое распространение в США, Европе, России и других странах. Вплоть до 70—80-х годов XX столетия радикальная мастэктомия по Холстеду считалась операцией выбора. К сожалению, косметический результат был шокирующим, так как удаление грудных мышц резко деформировало грудную клетку, снижало функциональные возможности верхней конечности на стороне операции, часто возникал отек верхней конечности на стороне, подвергшейся операции. В 70—80-х годах было показано, что такой радикализм операции не оправдан, широкое иссечение тканей часто не гарантировало благоприятного исхода. Пациентки, оперированные по столь радикальному, калечащему методу, умирали не от локальных рецидивов, а от системных метастазов, возникающих в раннем периоде развития рака. С того времени стали разрабатывать и широко применять щадящие молочную железу и психический статус женщин оперативные вмешательства, позволяющие без ущерба для 5- и 10-летней выживаемости получить приемлемый косметический результат. 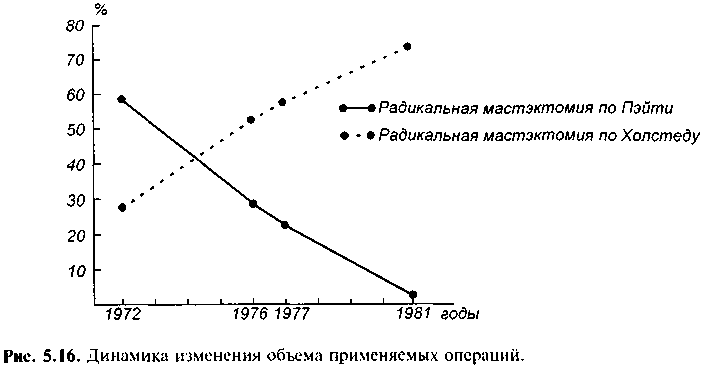 Число мастэктомий по Холстеду уменьшилось в большинстве клиник до 5—7% в год, а в США и странах Европы операции производились значительно реже. Опыт последних 15—20 лет показал, что наиболее щадящей операцией, позволяющей получить отличный косметический результат без ущерба для радикальности и пятилетней выживаемости, является лампэкто-мия и модифицированная радикальная мастэктомия по Пэйти (рис. 5.16). Л а м п э к т о м и я — удаление опухоли I—II стадии с окружающим ее венчиком здоровой ткани железы размером до 2 см от края пальпируемого новообразования. Эта процедура требует определенного опыта и знаний, чтобы осторожно и тщательно иссечь опухоль вместе с небольшим участком окружающей ее здоровой ткани. Для того чтобы облегчить аккуратное удаление опухоли из маленького разреза, рекомендуется наложить один шов на здоровую ткань железы, расположенную непосредственно над опухолью (но не через опухоль!). Потягивание ткани железы вверх за нити наложенного шва облегчает иссечение и удаление опухоли с окружающей здоровой тканью. При этом особое внимание должно быть обращено на то, чтобы сохранить по периферии полоску здоровой ткани железы не менее 2 см, нигде не повредить опухоль, после удаления которой не рекомендуется накладывать швы в глубине раны с целью уменьшения "мертвого" пространства. Следует обеспечить самый тщательный гемостаз и не дренировать рану. Полость раны заполнится экссудатом и заживет без деформации рубца и железы, что обеспечивает хороший косметический результат. После завершения лампэктомии через отдельный разрез удаляют регионарные подмышечные лимфатические узлы I—III уровня. Для этой цели проводят поперечный разрез от края большой грудной мышцы до края широчайшей мышцы спины, отступив на три пальца ниже подмышечной ямки. Некоторые хирурги предпочитают продольный разрез по краю большой грудной мышцы до подмышечной ямки. После мобилизации краев раны удаляют лимфатические узлы I—II или I—III уровня. Рану дренируют. Дренаж подключают к аспиратору, что уменьшает возможность образования се-ромы и обеспечивает плотный контакт отсепарованных кожных лоскутов с грудной стенкой. Для оценки правильности удаления опухоли препарат снаружи окрашивают чернилами. Затем его разрезают и делают отпечатки на бумаге, при этом выявляя, что краска осталась только на здоровой ткани, расположенной по периферии опухоли, а опухоль не повреждена. Окончательное заключение по этому поводу дает морфологическое исследование препарата. Если окружающая опухоль ткань и сама опухоль повреждены во время операции, то следует произвести радикальную модифицированную мастэктомию по Пэйти. В послеоперационном периоде проводят химиотерапию, облучение, в некоторых случаях ограничиваются только оперативным лечением. Эта операция во многом близка к предложенной Н. Н. Блохиным операции — радикальной резекции молочной железы. По эффективности ламп-эктомия не уступает более радикальным оперативным вмешательствам. Р е з е к ц и я к в а д р а н т а ( к в а д р а н т э к т о м и я ) . При этой операции удаляют квадрант (одну четвертую) молочной железы, содержащий опухоль. Затем, произведя отдельный разрез, удаляют лимфатические узлы 1— III уровня из подмышечной ямки. Оперативное лечение сочетают с лучевой терапией. Изучение отдаленных результатов показало, что эта операция не уступает по эффективности радикальной мастэктомии по Холстеду. М о д и ф и ц и р о в а н н а я радикальная мастэктомия по П э й т и . Эта операция стала более широко применяться начиная с 70—80-х годов. В отличие от радикальной мастэктомии по Холстеду при модифицированной радикальной мастэктомии по Пэйти производят два полуовальных, окаймляющих железу поперечных разреза от парастернальной до сред-неаксиллярной линии. Из этого разреза удаляют железу вместе с фасцией большой грудной мышцы, саму мышцу оставляют на месте. Для улучшения доступа к лимфатическим узлам подмышечной ямки малую грудную мышцу удаляют (по Пэйти), или пересекают (по Маддену), или оттягивают в медиальном направлении для улучшения доступа к лимфатическим узлам III уровня. Таким образом, молочную железу удаляют единым блоком вместе с регионарными лимфатическими узлами. Рану дренируют и зашивают. Дренаж подключают к аспиратору. Сохранение большой грудной мышцы делает эту операцию менее травматичной и более приемлемой в функциональном и в косметическом отношении. Начиная с середины 70-х годов эта операция стала быстро распространяться и в настоящее время является стандартной при хирургическом лечении рака молочной железы. Отдаленные результаты, как показали рандомизированные исследования, не уступают результатам операции Холстеда. Р а д и к а л ь н а я м а с т э к т о м и я по X о л с т е д у — радикальное удаление пораженной молочной железы вместе с большой и малой грудными мышцами, удаление лимфатических узлов, жировой клетчатки из подмышечной и подключичной ямок и подлопаточного пространства. По радикальности операция по Холстеду не имеет преимуществ перед радикальной мастэктомией по Пэйти, но более травматична, сопровождается большим числом осложнений и худшими косметическим и функциональным результатами. В настоящее время эту операцию производят редко, преимущественно в поздней стадии рака, когда имеется прорастание опухоли в большую грудную мышцу, инфильтрация и отек ее. Р а с ш и р е н н а я радикальная мастэктомия по Урбану отличается от операции Холстеда только тем, что при ней дополнительно удаляют парастернальные лимфатические узлы, расположенные по ходу внутренней грудной артерии. Для доступа к ним резецируют два-три -реберных хряща по парастернальной линии. Несмотря на кажущуюся суперрадикальность, отдаленные результаты этой операции не лучше результатов мастэктомии по Холстеду. Поэтому в настоящее время ее применяют очень редко, при выявленных с помощью компьютерной томографии метастазах в парастернальные лимфатические узлы. Впрочем, на лимфатические узлы можно эффективно воздействовать с помощью лучевой и химиотерапии. Подкожная (субку-танная) мастэктомия и простая мастэктомия применяются редко, по специальным показаниям. 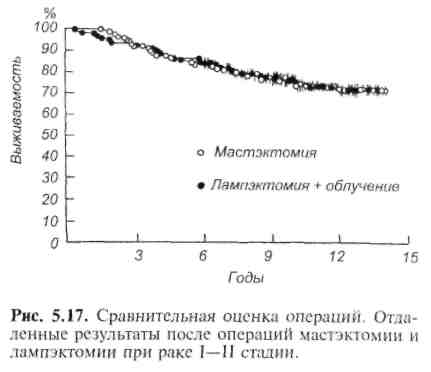 Лечение рака I и II стадий. В настоящее время для хирургического лечения рака I и II стадий применяют лампэктомию, квадрантэктомию, модифицированную радикальную мастэк-томию по Пэйти. Выбор метода зависит от хирурга, от желания пациентки сохранить молочную железу, от размеров опухоли и величины молочной железы. При наличии нескольких узлов или большой (5 см и более) опухоли в маленькой железе лампэктомия теряет смысл, так как получить хороший косметический результат невозможно. В специализированных отделениях при раке I—II стадии предпочтение отдают лампэктомии с удалением регионарных лимфатических узлов с последующей лучевой терапией или без нее. Некоторые хирурги предпочитают мастэктомию по Пэйти, так как предполагают, что лампэктомия не прошла еще широкой клинической проверки. Однако опыт показал, что модифицированная мастэктомия по Пэйти и лампэктомия с облучением или без облучения дают одинаковый процент выживаемости. При наличии метастазов в лимфатические узлы при всех видах оперативных вмешательств пятилетняя выживаемость несколько хуже Данные многочисленных рандомизированных исследований убедительно свидетельствуют о том, что при раке I—II стадии лампэктомия с удалением подмышечных лимфатических узлов дает хорошие результаты. При послеоперационном облучении, способном повлиять на частоту локальных рецидивов, заметного увеличения выживаемости не отмечается. Поэтому после лампэк-томии его применяют при опухолях более 1 см в диаметре, при пальпируемых подмышечных лимфатических узлах диаметром до 2 см. Вместо послеоперационного облучения рекомендуется лечение тамоксифеном, который в такой же степени обладает способностью подавлять появление локальных рецидивов. Органосохраняющие операции не рекомендуется делать в I—II триместре беременности, при больших опухолях, расположенных в разных квадрантах молочной железы, при невозможности четко определить край опухоли. Таким образом, методы лечения рака молочной железы I—II стадии претерпевают эволюцию. Модифицированная радикальная мастэктомия и лампэктомия с удалением подмышечных лимфатических узлов с последующей химиотерапией или облучением, по данным многих проспективных рандомизированных исследований, имеют много преимуществ перед радикальной мастэктомией по Холстеду. Многие аспекты этой проблемы подлежат дальнейшему изучению по мере эволюции методов лечения рака молочной железы (рис. 5.17). 5.6.2.2. Рак молочной железы in situДо появления маммографии только 3 — 5% рака молочной железы оценивали как неинвазивный рак. С введением маммографии частота его возросла до 25%. В связи с этим возник вопрос о способе лечения. Если при инвазивном раке I стадии предпочтение отдается лампэктомии, то следует ли при неинвазивном раке in situ производить мастэктомию? Выяснилось, что лобулярный неинвазивный рак может появиться в любой части железы, часто дает двустороннее поражение, не обнаруживается при маммографии, не дает метастазов. В противоположность лобулярному неинвазивный рак эпителия протоков образует микрокальцинаты на маммограмме, что позволяет распознать его. Это вид рака может давать микрометастазы. В связи с этим лечение их следует рассматривать раздельно. Лечение протоковой карциномы insitu. Этот вид неинвазивного рака очень напоминает инвазивный рак протоков без инвазивного компонента. При длительном наблюдении протоковая карцинома in situ в 20—40% становится инвазивной. Поэтому при обнаружении микрокальцинатов размером до 25 мм необходимо производить лампэктомию; если зона микро-кальцинатов более 25 мм, необходимо производить модифицированную радикальную мастэктомию по Пэйти, так как риск наличия инвазивного компонента высок. Кроме того, при попытке лампэктомии трудно определить границы опухоли, что затрудняет возможность эксцизии опухоли вместе с ободком здоровой ткани. В подобных случаях показана мастэк-томия без удаления лимфатических узлов с последующей химиотерапией или облучением в зависимости от морфологии опухоли. Мастэктомия дает 100% излечение. Лечение лобулярной карциномы insitu. Исторически для лечения этого вида рака применяли мастэктомию, так как хирурги предполагали возможность перехода ее в инвазивный рак. В настоящее время полагают, что она скорее является маркером для идентификации пациенток с высоким риском развития рака и способностью к двустороннему поражению. В 80-х годах была принята щадящая, более консервативная хирургия рака. В связи с этим лечение лобулярной карциномы in situ вызывает разногласие среди специалистов. Одна группа хирургов и пациенток (54—55%) считает, что надо ограничиться наблюдением за динамикой развития болезни. Вторая группа (33%) рекомендует производить одностороннюю мастэктомию. Третья группа (9%) рекомендует двустороннюю мастэктомию, учитывая возможность двустороннего поражения. Большинство же считают целесообразным производить регулярное наблюдение и принимать решение об оперативном лечении в связи с изменением течения болезни. Лечение непальпируемых опухолей. При непальпируемых опухолях участок, подлежащий удалению, определяют на основании изучения рентгенограмм молочной железы, выполненных в двух проекциях, или данных УЗИ. В день операции производят внутритканевую маркировку узла, подлежащего удалению. Для этого вводят 0,5—1 мл 1% раствора метиленового синего в смеси с 0,5 мл контрастного вещества (60% раствор урографина, верографина). Правильность маркировки контролируют повторной маммографией. Убедившись в правильности выбора участка с непальпируемым образованием, производят секторальную резекцию его, приближающуюся по технике исполнения к лампэктомии. После операции препарат подвергают рентгенологическому исследованию для контроля правильности удаления намеченного участка. После гистологического исследования определяют дальнейшую тактику. При обнаружении инвазивного рака производят радикальную мастэктомию по Пэйти или ограничиваются послеоперационной химиотерапией, как при лампэктомии, производимой по поводу рака I—II стадии. Лечение рака молочной железы III стадии. Выбор метода лечения при этой стадии рака зависит от возможности удаления опухоли, проведения адъю-вантной терапии, общего состояния больной. При операбельных опухолях проводят предоперационную и послеоперационную адъювантную химиотерапию или облучение, затем производят мастэктомию с последующим облучением или химиотерапией. При неоперабельных опухолях применяют обычно комбинированный метод лечения. Если облучение и дополнительная химиотерапия позволят уменьшить размеры опухоли, то производят операцию с последующей комбинированной химиотерапией для уничтожения раковых клеток за пределами пораженной области и предотвращения развития отдаленных метастазов. Секторальная резекция молочной железы. Применяется в исключительных случаях у крайне тяжелобольных и больных старческого возраста, не способных перенести мастэктомию. Операция может быть дополнена облучением или химиотерапией. Профилактическая мастэктомия может быть рекомендована при лобулярной карциноме in situ, при фиброзно-кистозной мастопатии с атипичной гиперплазией клеток протоков, особенно при неблагоприятном семейном анамнезе, при высоком риске развития рака молочной железы. Во всех случаях необходимо тщательно взвесить целесообразность и риск оперативного вмешательства. В ближайшем послеоперационном периоде возможны такие осложнения, как кровотечение, гематома, лимфорея, отек (лимфедема) верхней конечности. Лимфедема конечности на оперированной стороне наиболее часто наблюдается после радикальной мастэктомии по Холстеду. П л а с т и к а м о л о ч н ы х желез. Удаление молочной железы психологически тяжело переносится женщинами. Поэтому в дальнейшем применяют протезирование молочных желез наружными или имплантируемыми протезами из синтетических материалов. В настоящее время появилось много сообщений об отрицательных сторонах пластики молочных желез имплантируемыми силиконовыми протезами. Предпочтение отдают пластике молочных желез перемещением на место удаленной железы миокутанных лоскутов. Для этих целей перемещают одну или обе прямые мышцы живота вместе с жировой тканью и кожей ги-погастрия или перемещают лоскут из широчайшей мышцы спины вместе с кожей, сочетая с имплантацией синтетического протеза. Адъювантная терапия рака молочной железы Химиотерапия. Химиотерапетическое лечение, проводимое до операции, принято называть неоадъювантным. Послеоперационная химиотерапия, предотвращающая развитие метастазов и рецидива, называется адъювант-ной, или дополнительной. Химиотерапию, проводимую для лечения выявленных метастазов, называют лечебной. Удаление опухоли даже при паллиативных операциях усиливает эффективность метода. Поэтому сочетание оперативного удаления опухоли с последующей химиотерапией или комбинированными методами называют циторедуктивной терапией. Различают моно- и полихимиотерапию с различным сочетанием препаратов. Полихимиотерапия на 10—30% улучшает эффективность лечения по сравнению с монотерапией. Это объясняется различной чувствительностью опухоли к некоторым препаратам и разным механизмом действия некоторых из них. Наиболее часто применяют циклофосфан, фторурацил, адриамицин, метот-рексат, фарморубицин и др. Схемы полихимиотерапии с адриамицином (адриобластином, доксорубицином, ростоцином) считают наиболее эффективными. Список препаратов для химиотерапии быстро пополняется все более действенными средствами. Цель химиотерапии — подавить развитие метастазов, добиться уменьшения размеров опухоли Многочисленными исследованиями доказано, что химиотерапия значительно увеличивает продолжительность жизни. У пациенток, находящихся в периоде постменопаузы, при наличии метастазов в регионарные лимфатические узлы и положительных эстрогенрецепторах тамоксифен значительно увеличивает продолжительность жизни. Для этой группы оперированных больных такая схема считается стандартной. Для женщин в пременопаузе при метастазах в регионарные лимфатические узлы независимо от состояния эстрогенрецепторов показана комбинированная химиотерапия. При отсутствии метастазов в регионарные лимфатические узлы химиотерапия не рекомендуется Схемы химиотерапии многочисленны. Наиболее часто применяются следующие: 1) FAC (фторурацил, адриамицин, циклофосфан); 2) FEC (фтору-рацил, эпирубицин, циклофосфан); 3) CAF (циклофосфан, адриамицин, фторурацил); 4) CMF (циклофосфан, метотрексат, фторурацил). Состав компонентов зависит от многих факторов: принятой в данном учреждении схемы, участия в клинических испытаниях новых препаратов и схем лечения, наличия нужных препаратов. С появлением новых препаратов появляются новые схемы. Гормонотерапия предпринимается для снижения концентрации эстрогенов или блокирования их влияния на организм. Этот метод применяют преимущественно при опухолях с положительными эстрогенрецепторами. Гормональную терапию некоторые авторы рекомендуют проводить до химиотерапии, чтобы убедиться в гормональной чувствительности опухоли. Препараты для гормональной терапии применяют в определенной последовательности. Сначала назначают антиэстрогены (тамоксифен и его аналоги), затем ингибиторы ароматазы (аминоглютатимид), прогестины, андро-гены (тестостерон, сустанон, тестолактон и др.). Для каждой больной необходимо составлять индивидуальный план лечения, при котором возможно сочетание разных компонентов. Сочетание различных методов лечения называют комбинированной, или комплексной, терапией. Удаление яичников (оофорэктомия, кастрация), часто применявшееся ранее, теперь вызывает у большинства онкологов негативное отношение. Специальные сравнительные исследования показали, что у больных с поздними формами рака (III—IV стадия) в период пременопаузы кастрация и применение тамоксифена дали одинаковые результаты. Тамоксифен практически вытеснил кастрацию. Кастрацию в настоящее время применяют в случаях безуспешного применения тамоксифена, хотя в этих случаях иногда удается получить улучшение и от применения более высоких доз тамокси-фена. Лучевая терапия предусматривает облучение области тела, пораженной раком. При раке молочной железы облучают железу и регионарные лимфатические узлы. В ряде учреждений нашей страны проводят предоперационную и послеоперационную лучевую терапию. Большинство специализированных клиник предпочитает только послеоперационное облучение. Цель предоперационного облучения — снизить степень злокачественности первичной опухоли за счет гибели низкодифференцированных элементов, уменьшить диссеминацию раковых клеток во время операции и опасность рецидивов. Иногда уменьшение опухоли под влиянием лучевой терапии позволяет перевести иноперабельную опухоль в операбельную. Показания к предоперационной лучевой терапии: большие опухоли (более 5 см), диффузные формы рака и отек молочной железы, наличие метастазов в регионарные лимфатические узлы. Облучение проводится в течение 5 дней (разовая доза 4—5 Гр, суммарная — 25 Гр). Послеоперационная лучевая терапия имеет целью уменьшение местных рецидивов после лампэктомии, модифицированной радикальной мастэктомии, при обнаружении метастазов в регионарные лимфатические узлы после операции, при неполном удалении лимфатических узлов (разовая доза на очаг 2 Гр, суммарная очаговая доза 46—48 Гр и на оставшуюся после лампэктомии железу или на рубец после модифицированной радикальной мастэктомии до 50 Гр). Лучевая терапия применяется и как самостоятельный метод или в сочетании с химиотерапией при наличии противопоказаний для оперативного лечения. Лучевая терапия наряду с раковыми клетками повреждает и здоровые, она не может оказать воздействие на раковые клетки за пределами зоны облучения. Поэтому по мере повышения эффективности химиопрепара-тов показания к лучевой терапии суживаются. Адреналэктомия и гипофизэктомия, применявшиеся у некоторых групп пациентов с целью более полного снижения уровня эстрогенов и эс-трогеноподобных гормонов, в настоящее время практически не применяются. Это связано с появлением новой группы препаратов — ингибиторов ароматазы, угнетающих продукцию стероидных гормонов и не вызывающих заметных побочных эффектов. Вопрос о целесообразности применения указанных оперативных вмешательств продолжает дебатироваться. Необходимы дальнейшие клинические испытания, для того чтобы подтвердить эффективность и целесообразность применения медикаментозной терапии вместо опасных для жизни ослабленных больных тяжелых оперативных вмешательств. 5.6.2.3. Рак молочной железы у мужчинОпухоль встречается у мужчин в 1 0 0 раз реже, чем у женщин. Безболезненна, расположена центрально в глубине сосково-ареолярной области. В связи с отсутствием болей пациенты поздно обращаются к врачу. Использовать маммографию для диагностики трудно, поэтому рак распознается преимущественно в стадии ТЗ—Т4. Некоторую помощь в диагностике может оказать УЗИ. Выживаемость больных мужчин ниже, чем женщин, что объясняется не особенностями рака у мужчин, а поздней диагностикой. Лечение рака молочной железы у мужчин практически не отличается от методики, применяемой у женщин. Наиболее частой операцией является модифицированная радикальная мастэктомия, за исключением случаев прорастания опухоли в большую грудную мышцу. Принципы химиотерапии при раке молочной железы те же, что и у женщин. Используют те же схемы проведения химио- и гормональной терапии. Процент эстрогенпо-зитивности рака у мужчин (89%) выше, чем у женщин (64%), поэтому кастрация часто дает положительный эффект при появлении метастазов или рецидива. Применение тамоксифена, или "кастрации" медикаментозными средствами, столь же эффективно, как удаление яичек, поэтому кастрацию производят редко. При раке 1 стадии наблюдается 100%выздоровление. Разделение рака молочной железы по стадиям у мужчин такое же, как у женщин. Однако исходы оперативного и других методов лечения у мужчин хуже, что обусловлено поздней диагностикой и преобладанием III—IV стадии рака. После операции радикальной мастэктомии по Пэйти при непальпируе-мом раке (Tis; T O ) пятилетняя выживаемость составляет 98,5%, десятилетняя _ 94,5%; при раке I, Па стадии (T1N0M0; Т1—2N0M0) — соответственно 93 и 84%; при Пб стадии (Т1— 2N1M0) — 60—65%, а при III стадии (Tl-3N2-3M0)-35-40 %. Таким образом, чисто хирургический метод лечения рака молочной железы у мужчин можно считать адекватным. При применении радикальной мастэктомии по Пэйти пятилетняя выживаемость выше, чем при других типах операций. 5.6.2.4. Саркома молочной железыСаркома молочной железы — неэпителиальная злокачественная опухоль (около 1% всех злокачественных опухолей этого органа), выявляющаяся в молочной железе при пальпации в виде плотного практически безболезненного узла с четкими границами, длительное время остающимися четкими. В поздние сроки опухоль прорастает в окружающие ткани, становится интимно спаянной с соском, большой грудной мышцей и кожей. Появляются метастазы в регионарные лимфатические узлы. Саркомы достигают большой величины, состоят из одного или нескольких узлов, как бы сливающихся вместе. Цитологическое исследование пунктата подтверждает диагноз. Лечение. Применяют обычно комплексное лечение, сочетая радикальную мастэктомию с лучевой и химиотерапией. При проведении лечения соблюдают те же принципы, что и при лечении рака молочной железы. |
