ПОСОБИЕ МОДУЛЬ 1. Методическая разработка к лабораторно практическому занятию для студентов медицинских специальностей Саратов 2013
 Скачать 2.05 Mb. Скачать 2.05 Mb.
|
|
Роль осмоса и осмотического давления в биологических системах. 1. Осмос регулирует поступление воды в клетки и межклеточные структуры. Если бы вода просачивалась в ткани, то это вызывало бы отек различных органов и подкожной живой клетки. Это наблюдается при механических повреждениях различных органов. 2. Упругость клеток (тургор), эластичность тканей, сохранение определенной формы органов обусловлены осмотическим давлением. Клетки некоторых растений развивают давление 4-20 атм. Прорастающие ростки деревьев поднимают асфальт. 3. Растворы, имеющие одинаковое осмотическое давление называются изотоническими. Например, используются в медицине такие растворы как 0,9%-ный р-р NaCl и 5%-ный р-р глюкозы, которые изотоничны крови (т.е. имеют такое же осмотическое давление). Растворы с более высоким осмотическим давлением называются гипертоническими, а с более низким – гипотоническими. Осмотическое давление плазмы крови человека при 370С составляет около 7,6 атм, это давление создает электролитный состав крови: 60% этого давления создает NaCl, затем глюкоза и др. Часть осмотического давления (около 0,03 атм) обусловлено белками (альбумины). Это давление называется онкотическим. 4. Помещая клетку в дистиллированную воду, наблюдается эндосмос (молекулы воды проникают во внутрь клетки), происходит набухание, а затем и разрыв оболочки и вытекание клеточного содержимого. Это явление называется лизисом. В случае эритроцитов – гемолизом. В концентрированных растворах солей отмечается сморщивание клеток - плазмолис,связанный с потерей воды, или экзосмосом. 5. Человеческий организм характеризуется постоянством осмотического давления, колебания его незначительны. Поэтому при различных процедурах в кровь человека в больших количествах можно вводить только изотонические растворы. При больших потерях крови (операции, травмы) больным вводят по несколько литров изотонического раствора NaCl (0,9%) для возмещения потери жидкости с кровью. Но следует помнить, что изотонический раствор кровь не заменяет! 6. В хирургии применяют гипертонические растворы, например 10%-ный р-р NaCl. Смоченную в таком растворе повязку накладывают на рану для очистки от гноя, микроорганизмов и продуктов распада. 7. Горькая соль MgSO4 *7H2O и глауберова соль Na2SO4*10 H2O являются сильными слабительными средствами. Это их свойство основано на осмосе: эти соли плохо всасываются желудочно-кишечном тракте, гипертонические растворы MgSO4 *7H2O и Na2SO4*10 H2O заставляют устремляться в просвет кишечника большое количество воды, что приводит к послабляющему эффекту. 8. Почка – эффективный осмотический аппарат. Основная функция ее заключается в удалении продуктов обмена из крови: в более концентрированный раствор – мочу - через полупроницаемую мембрану. 9. Одним из основных механизмов поступления минеральных веществ в эмаль зубов следует считать осмотическое давление. Если эмаль покрыть высококонцентрированным раствором сахара, то осмотическое давление достигает 50 атм. Поэтому малые по размеру ионы, включая Н+, будут интенсивно проникать в эмаль, что в конечном итоге приведет к кариесу. Вопросы для самоконтроля.
Ответ: 309,6 кПа. Тесты для самоконтроля Тест 1
а) эндотермический б) экзотермический в) сбалансированный г) атермический.
а) 28,37, б) 40,12, в) 48,24, г) 56,74.
а) диффузия, б) тепловой эффект, в) контракция, г) изменение окраски раствора. 4. Осмотическое давление рассчитывается по формуле: а) πосм = СRT б) πосм = СT в) πосм = МRT г) πосм = К2С, 5. Криоскопической константой Кзам, называется: а) понижение температуры замерзания раствора, обусловленное 1 молем вещества, растворённого в 1000 г растворителя, б) повышение температуры замерзания раствора, обусловленное 1 молем вещества, растворённого в 1000 г растворителя, в) понижение температуры замерзания раствора, обусловленное 1 молем вещества, растворённого в 100 г растворителя, г) повышение температуры замерзания раствора, обусловленное 1 молем вещества, растворённого в 100 г растворителя, Тест 2
а) раствор, образование которого не сопровождается химическим взаимодействием, изменением объёма и тепловым эффектом (∆Нсмеш. = 0), б) раствор, образование которого сопровождается химическим взаимодействием, изменением объёма и тепловым эффектом (∆Нсмеш.> 0), в) раствор, образование которого сопровождается химическим взаимодействием, изменением объёма и тепловым эффектом (∆Нсмеш. < 0), г) раствор, образование которого не сопровождается химическим взаимодействием, изменением объёма и тепловым эффектом (∆Нсмеш. > 0).
а) экзотермический, б) атермический, в) эндотермический, г) сначала идет с выделением тепла, а затем с поглощением.
а) ниже температура кипения, б) выше температура кипения, в) температура равна 00С, г) сначала идет повышение температуры, а затем понижение.
а) повышение температуры кипения, которое происходит при растворении 1 моля вещества в 1000 г растворителя, б) понижение температуры кипения, которое происходит при растворении 1 моля вещества в 1000 г растворителя, в) повышение температуры кипения, которое происходит при растворении 1 моля вещества в 100 г растворителя, г) понижение температуры кипения, которое происходит при растворении 1 моля вещества в 100 г растворителя,
а) СН3ОН б) С3Н8О3, в) С2Н5ОН г) СН3СОСН3 Тест 3
а) экзосмосом б) эндосмосом в) тургором г) диффузией.
а) Шредингера б) Гейзенберга в) Вант Гоффа г) Рауля.
а) вода + бензол б) вода + этиловый спирт, в) вода + сахароза г) гексан + гептан. 4. Повышение температуры кипения ΔТ, разбавленных растворов неэлектролитов прямо пропорционально: а) молярной концентрации раствора б) мольной доле растворителя в) нормальной концентрации раствора г) моляльной концентрации раствора
а) диффузия б) тепловой эффект, в) контракция г) изменение окраски раствора. Тест 4
а) эндосмосом б) экзосмосом в) диффузией, г) растворением.
а) эндоосмоса б) экзосмоса в) диффузии г) нагревания.
а) легкие б) печень и поджелудочная железа в) почки г) кровь.
а) ниже температура кипения б) выше температура кипения, в) температура равна 00С, г) сначала идет повышение температуры, а затем понижение.
а) эндотермический б) экзотермический в) сбалансированный г) атермический. Тест 5 1. В биологических жидкостях (моча, кровь, плазма, слюна) в больших количествах содержатся неорганические и органические вещества в виде молекул, ионов и коллоидных частиц. Их суммарная концентрация называется: а) молярной концентрацией б) осмотической концентрацией в) нормальной концентрацией г) титрованной концентрацией
а) р - р0 / р0= х1 б) р0 – р / р0 = х2 в) р - р0 / р= х1 г) р0 – р / р0 = х1
а) молярной концентрации раствора б) мольной доле растворителя в) нормальной концентрации раствора г) моляльной концентрации раствора
а) свойства, которые не зависят от природы растворенного вещества, а зависят только от количества частиц б) свойства, которые зависят от природы растворителя и растворенного вещества в) свойства, которые зависят от температуры г) свойства, которые не зависят от количества частиц. 5. Изотоническими растворами называются растворы, у которых: а) осмотическое давление одинаково, б) осмотическое давление неодинаково, в) концентрации растворов равны между собой, г) осмотическое давление равно 0. Ответы к тестам для самоконтроля
Занятие 4. Буферные растворы Цель занятия: Сформировать у студентов системные знания о буферных растворах, их свойствах, механизме действия, их взаимосвязи и роли в поддержании кислотно – основного гомеостаза организма, наиболее важных показателях кислотно – основного гомеостаза, механизмах его поддержания. Студент должен знать: Механизм действия буферных систем организма, их взаимосвязь и роль в поддержании кислотно-основного состояния организма. Классификацию буферных растворов, зона буферного действия, буферную емкость и факторы, ее определяющие. Расчет рН протолитических систем. Буферные системы крови. Студент должен уметь: Прогнозировать влияние различных факторов на величину рН и буферной ёмкости буферных систем и биологических жидкостей и механизмы действия буферных растворов в зависимости от их типа, количественно рассчитывать величину рН буферных растворов и буферной ёмкости.
Одним из основных свойств живых организмов является поддержание кислотно-основного гомеостаза на определенном уровне. Протолитический гомеостаз – постоянство рН биологических жидкостей, тканей и органов. Это находит выражение в достаточно постоянных значениях рН биологических сред (крови, слюны, желудочного сока и т.д.) и способности организма восстанавливать нормальные значения рН при воздействии протолитов. Система, поддерживающая протолитический гомеостаз, включает в себя не только физиологические механизмы (легочную и почечную компенсацию), но и физико-химические: буферное действие, ионный обмен и диффузию. Обеспечение постоянства рН крови и других органов и тканей является одним из важнейших условий нормального существования организма. Это обеспечение достигается наличием в организме многочисленных регулирующих систем, важнейшими из которых являются буферные системы. Последние играют основную роль в поддержании КОР в организме. Кроме того, материал данной темы необходим для изучения последующих тем предмета (потенциометрия, свойства растворов ВМС и т.д.) и таких дисциплин как биохимия, микробиология, гистология, гигиена, физиология, в практической деятельности врача при оценке типа и тяжести нарушений КОР. Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания. Протолитические буферные растворы представляют смеси электролитов, содержащие одноимённые ионы. Различают в основном протолитические буферные растворы двух типов:
СН3СООН + Н2О ↔ Н3О+ + СН3СОО- избыток сопряженного кислота основания СН3СООNa → Na+ + CH3COO-
NH3 + H2O ↔ OH- + NH4+ избыток сопряженной основание кислоты NH4Cl → Cl- + NH4+ Уравнение буферной системы рассчитывается по формуле Гендерсона-Гассельбаха: рН = рК + ℓg где рК = -ℓg КД. С – молярная или эквивалентная концентрация электролита (C = V N) Механизм действия буферных растворов Рассмотрим его на примере ацетатного буфера: СН3СООН + СН3СООNa Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде.
CH3COO ‾ +H + ↔ CH3COOH (1) Из уравнения (1) видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н+ в буфере увеличивается, но очень незначительно. рН сохраняется постоянным. При добавлении кислоты к буферу рН определяется по формуле: рН = рК + ℓg 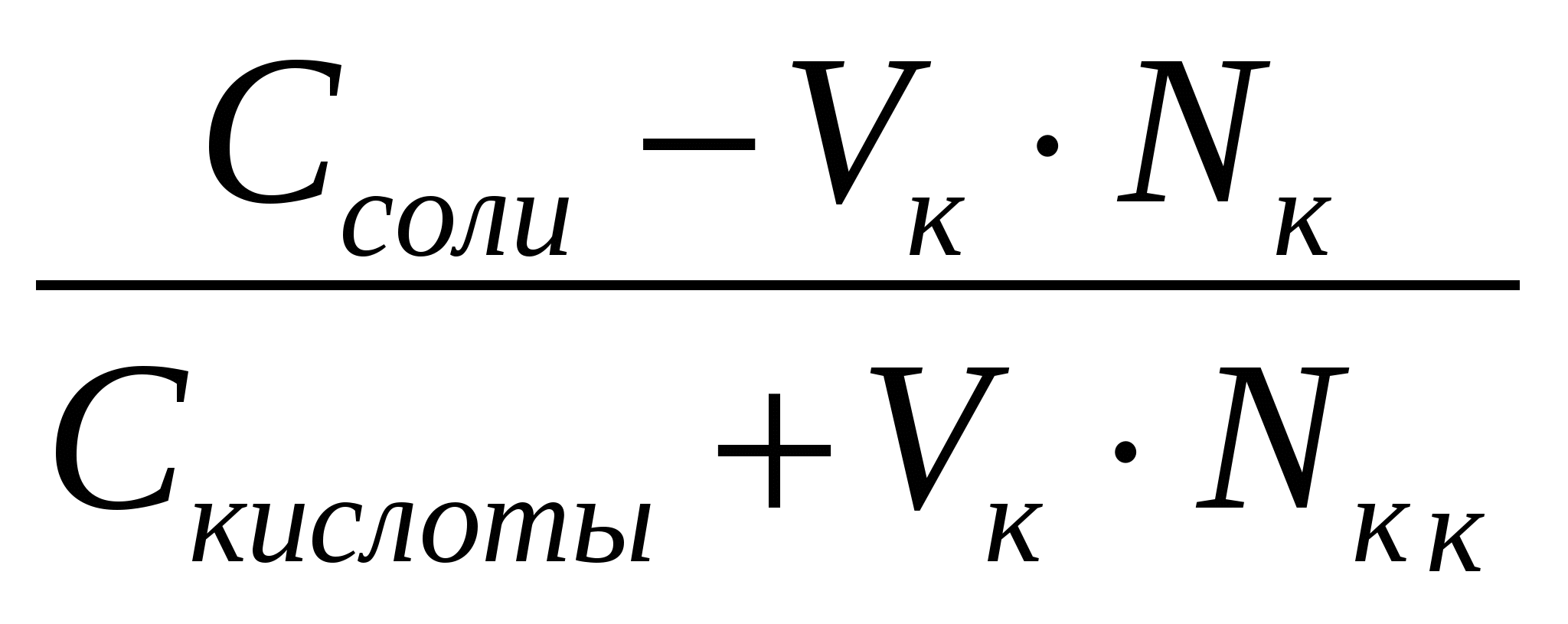
CH3COOН + OH ‾ ↔ CH3COO ‾ + H2O (2) В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В. Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н+ практически не изменяется. рН остаётся постоянным. При добавлении щелочи рН определяется по формуле: рН = рК + ℓg
Таким образом, рН буфера зависит от: константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. рН буфера будет наибольшим при соотношении компонентов равным единице. Для количественной характеристики буфера вводится понятие буферной ёмкости. | |||||||||||||||||||||||||||||||||||||||||
