ПОСОБИЕ МОДУЛЬ 1. Методическая разработка к лабораторно практическому занятию для студентов медицинских специальностей Саратов 2013
 Скачать 2.05 Mb. Скачать 2.05 Mb.
|
|
Применение реакции нейтрализации в фармакотерапии. Для проведения коррекции кислотно-основного состояния необходимо выявить, какое звено в его регулировке нарушено. Для этого необходимо определить значения рН биологических жидкостей и содержание буферных оснований. В основе фармакологических действий лежит реакция нейтрализации. Например, в качестве экстренной меры при ацидозе применяется внутривенное вливание раствора гидрокарбоната натрия 4,5%, а в острых случаях – 8,4%. Второе эффективное средство – трисамин 3,66%, который связывает избыточные протоны. Он эффективен только при внутривенном введении. Также в качестве средства, коррегирующего ацидоз, используют лактат натрия 11% раствор. Для устранения явления алкалоза в некоторых случаях используют раствор аскорбиновой кислоты 5%. В гастроэнтерологии применяют средства, нормализующие секреторную функцию желудка. При пониженной кислотности желудочного сока назначают разбавленную соляную кислоту, при повышенной кислотности – различные антацидные препараты: оксид магния, основной карбонат магния, карбонат кальция, гидрокарбонат натрия. Примеры решения задач Задача 1. Рассчитать рН аммиачного буферного раствора, содержащего 0,02 М раствора NH4ОН и 0,2М раствора NH4Сl. рК(NH4ОН)=4,75, рОН = 4,74 + 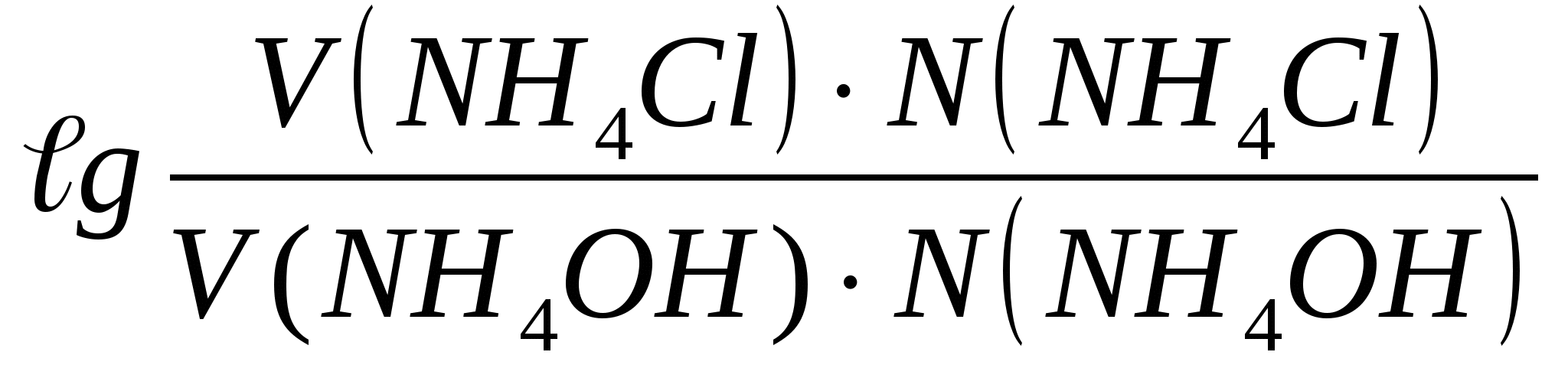 Задача 2. Можно ли приготовить аммиачный буфер с рН = 4,7, когда КД (NH4OH) = 1,8 · 10-5 ? Решение: 1. Определяем рК NH4OH: КД (NH4OH) = 1,8 · 10-5 рК = -ℓg КД = - ℓg 1,8 · 10-5 = -(ℓg 1,8 - ℓg 10-5) = -0,26 = 5 = 4,74. 2. Определяем интервал буферного действия по формуле: рОН = рК ± 1. рОН = 4, 74 ± 1; рН = 3,74 -5,74. Ответ: значение рОН = 4,74 входит в интервал рК 3,74 – 5,74, поэтому такой аммиачный буфер можно приготовить. Задача 3. Для приготовления буфера взяты 70 мл 2 N р-ра NH4OH и 140 мл 0,1 N р-ра NH4С1. Как изменится рОН этого раствора, если: а) этот раствор разбавить в 10 раз, б) добавить к нему 10 мл 0,1 N р-ра NaОН ? КД (NH4OH) = 1,8 · 10-5 Решение: 1. Определяем рК NH4OH: рК = -ℓg КД = - ℓg 1,8 · 10-5 = 4,74 (см. предыдущую з-чу) 2. Определяем начальное значение рОН: рОН = 4,74 + 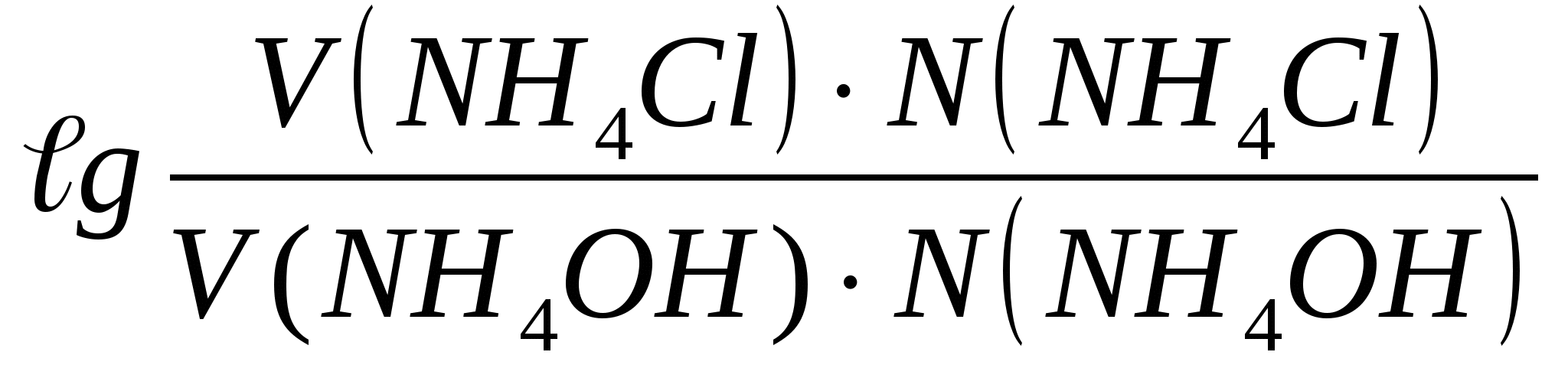 при разбавлении и добавлении NaOH рОН=4,74+ℓg
рОНК = рК +ℓg + рОНК = 4,74 +ℓg +
Ответ: рОН не изменяется при разбавлении буфера в любое число раз, так как при этом не изменится соотношение концентраций компонентов буфера; ΔрОН = 0,08 Задача 4. Какова буферная ёмкость фосфатного буфера, если при добавлении 3 мл 0,01N раствора НС1 к 20 мл этого буфера рН меняется от 7,4 до 7,1? Решение: 1. Определяем (ΔрН): Δ рН = рНН – рНК, Δ рН = 7,4 – 7,1 = 0,3 2. Определяем буферную ёмкость по формуле: В = Ответ: В = 0,005 мэ/л. Вопросы для самоконтроля
Лабораторные работы Работа 1. Определение буферных свойств биологических жидкостей Опыт 1 В четыре одинаковые пробирки с помощью пипетки отмеряют по 1 мл сыворотки крови. Первую пробирку оставляют для контроля, во вторую добавляют 5 кап. 0,025 N раствора NаОН, в третью - 0,025 N раствора НСl, в четвёртую – 5 кап. воды. Затем во все пробирки добавляют по 1-2 капли универсального индикатора и по цветной шкале универсального индикатора определяют приблизительное значение рН. Опыт 2. В четыре одинаковые пробирки с помощью пипетки отмеряют по 1 мл ацетатного буфера. Первую пробирку оставляют для контроля, во вторую добавляют 5 кап. 0,025 N раствора NаОН, в третью - 0,025 N раствора НСl, в четвёртую – 5 кап. воды. Затем во все пробирки добавляют по 1-2 капли универсального индикатора и по цветной шкале определите приблизительное значение рН. Опыт 3. В две одинаковые пробирки с помощью пипетки отмеряют: в первую – 5 кап. воды, во вторую 5 кап. слюны. Добавляют в каждую пробирку по 1-2 капли универсального индикатора и определяют примерное значение рН. Затем добавляют в обе пробирки по 1 капли 0,01 N раствора НСl. Что наблюдаете? Охарактеризуйте буферные свойства слюны. Результаты опытов заносят в таблицу № 1. Таблица № 1.
Зависимость рН буферных растворов от соотношения компонентов Опыт 1. В три пробирки с помощью пипетки отмеряют 0,2 N Nа2НРО4 и 0,2 N NаН2РО4 в количествах, указанных в таблице № 2. Добавляют в каждую пробирку по две капли универсального индикатора и определите рН по цветной шкале универсального индикатора. Вычисляют рН исследуемых растворов по формуле Гендерсона – Гассельбаха: рН = рК + ℓg Делают вывод зависимости рН от соотношения концентраций компонентов буферной смеси. Таблица № 2.
Тесты для самоконтроля. Тест 1
а) HNO3 и КОН, б) СН3СООН и NaOH, в) HCl и KNO3, г) NH4OH и H2S
а) 1000 мл, б) 100 мл, в) 10 мл, г) 1,0 мл сыворотки крови.
а) моль/экв сильной кислоты или основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его рН на единицу; б) моль/л сильной кислоты или основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его рН на единицу; в) числом мл слабой кислоты или основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его рН на единицу; г) числом мл сильной кислоты или основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его рН.
а) концентрации компонентов, б) объёма буфера, в) разведения г) соотношения концентрации компонентов.
а) 1:20, б) 20:1 в) 1:1 г) 1:5 Тест 2
а) рН = 7,4, щелочной резерв 55 объемных %, б) рН = 7,2, щелочной резерв 70 объемных %, в) рН = 7,4, щелочной резерв 70 объемных %, г) рН = 7,4, щелочной резерв 40 объемных %.
а) объёма буфера, б) концентрации компонентов, в) разведения, г) соотношения концентраций компонентов
а) бикарбонатная, б) фосфатная, в) гемоглобиновая, г) ацетатная. 4. Щелочной резерв крови – это количество мл СО2, находящегося в 100 мл сыворотки крови. В норме оно равно: а) 24%, б) 55%, в) 35%, г) 76%. 5. При разведении буферная ёмкость уменьшается, так как: а) не изменяется соотношение компонентов, б) увеличивается объём, в) уменьшается концентрация, г) изменяется соотношение компонентов. Тест 3
а) HCl и KOH, б) NH4OH и HCl, в) NH4OH и H2S г) KOH и H2SO4 2. При добавлении к аммиачному буферу НСl рН не меняется так как, в соответствии с законом разбавления Оствальда степень диссоциации слабого электролита: а) увеличивается, б) уменьшается, в) не изменяется, г) сначала увеличивается, а затем уменьшается. 3. Константа диссоциации NH4OH равна 1,8 · 10-5. Зона буферного действия будет находится в интервале рОН : а) 3,8 – 5,8, б) 2 – 4, в) 4,8 – 5,8, г) 2,8 – 4,8 4. При разведении в 10 раз буферного раствора рН: а) уменьшается, б) увеличивается в) не изменяется, г) сначала уменьшается, а затем увеличивается 5. В норме парциальное давление равно: а) 60 мм рт.ст, б) 20 мм рт.ст, в) 50 мм рт.ст, г) 40 мм рт.ст Тест 3
а) HNO3 и КОН, б) СН3СООН и NaOH, в) HCl и KNO3, г) NH4OH и H2S
а) 1000 мл, б) 100 мл, в) 10 мл, г) 1,0 мл сыворотки крови. 3. Константа диссоциации СН3СООН равна 1,8 · 10-5. Зона буферного действия будет находится в интервале рОН : а) 3,8 – 5,8, б) 2 – 4, в) 4,8 – 5,8, г) 2,8 – 4,8
а) бикарбонатная, б) фосфатная, в) гемоглобиновая, г) ацетатная.
а) рН = 7,4, щелочной резерв 55 объемных %, б) рН = 7,2, щелочной резерв 70 объемных %, в) рН = 7,4, щелочной резерв 70 объемных %, г) рН = 7,4, щелочной резерв 40 объемных %. Тест 5 1. При добавлении к ацетатному буферу NaOH рН не меняется так как, в соответствии с законом разбавления Оствальда степень диссоциации слабого электролита: а) увеличивается, б) уменьшается, в) не изменяется, г) сначала увеличивается, а затем уменьшается
а) HCl и KOH, б) NaOH и H3PO4, в) NH4OH и H2S, г) KOH и H2SO4 3. В норме парциальное давление равно: а) 60 мм рт.ст, б) 20 мм рт.ст, в) 50 мм рт.ст, г) 40 мм рт.ст 4. При разведении в 100 раз ацетатного буферного раствора рН: а) уменьшается, б) увеличивается в) не изменяется, г) сначала уменьшается, а затем увеличивается 5. Щелочной резерв крови – это количество мл СО2, находящегося в 100 мл сыворотки крови. В норме оно равно: а) 24%, б) 55%, в) 35%, г) 76%. Ответы к тестам для самоконтроля
Занятие 5. Реакции замещения лигандов Цель занятия: Сформировать у студентов системные знания о строении и свойствах комплексных соединений. Научить студентов получать комплексные соединения и на основании поведения комплексных соединений в растворах делать выводы об их устойчивости. Студент должен знать: строение и классификацию комплексных соединений. Константу нестойкости комплексного иона. Устойчивость в растворах. Представления о строении металлоферментов и других биокомплексных соединений. Механизм токсического действия тяжелых металлов. Студент должен уметь: давать названия комплексных соединений, записывать константу нестойкости, схематически представлять активные центры гемоглобина, хлорофилла. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
