МЕТОДИЧКА Муковисцидоз. Современные достижения и проблемы. Методические рекомендации. 2001г.. МЕТОДИЧКА Муковисцидоз. Современные достижения и проблемы. Метод. Методические рекомендации Н. И. Капранов, Шабалова Л. А., Каширская Н. Ю., Воронкова А. Ю., Блистинова З. А., Лубская Т. В., Осипова И. А., Капранов А. Н
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
|
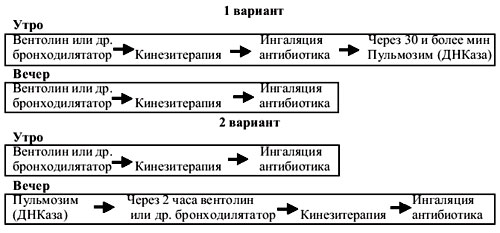
7.1.4. Ингаляционная терапия Ингаляционная терапия (аэрозольтерапия) - лечение вдыханием лекарственных веществ. Мелкая дисперсия лекарственного препарата обеспечивает его глубокое проникновение в дыхательные пути. Ингаляционное применение муколитиков позволяет оказать максимальное лечебное действие на слизистую оболочку дыхательных путей и улучшить реологические свойства вязкой мокроты. Аэрозоли антибиотиков применяются в дополнении к системно проводимой антибиотикотерапии при МВ для достижения более высокой концентрации препаратов в бронхиальном секрете. В нашей клинике применяются следующие рекомендации по проведению ингаляционной терапии в комплексе с кинезитерапией:
 7.1.5. Антибиотикотерапия С рождения больные с МВ предрасположены к развитию бактериальной инфекции дыхательных путей. В ее основе лежит биологический механизм, связанный с генетически обусловленным дефектом синтеза МВТР. Вирусная инфекция повышает риск и обычно ускоряет развитие бактериальной инфекции. Спектр бактериальных патогенов при МВ остается на удивление ограничен. В классическом варианте в раннем возрасте развивается стафилококковая, а в последующем инфекция, обусловленная H. influenzae и P. aeruginosa. В последнее время возросла роль B. cepacia и обсуждается роль Stenotrophomonas maltophilia. В настоящее время средняя продолжительность жизни больных МВ увеличилась по сравнению с прошлыми десятилетиями и составляет 32 года, но она значительно ниже, чем у людей без МВ. Основной причиной смерти являются дыхательные расстройства, вызванные хронической легочной инфекцией. У большинства больных эта инфекция впервые появляется в раннем возрасте. Продолжительность жизни очевидно больше у больных без хронической легочной инфекции. В США в случае отсутствия высева патогенных микроорганизмов из бронхиального секрета (в этом случае можно предположить отсутствие бактериальной инфекции) продолжительность жизни в среднем составляет 39 лет, у больных с хронической синегнойной инфекцией - 28, при высеве Burkholderia cepacia (B. Cepacia) - 6 лет. Прогрессирование бронхолегочного процесса нарастает после развития хронической синегнойной инфекции. Медленное (около 4% в год) снижение показателей функции внешнего дыхания характерно для больных МВ, однако у многих больных без хронической легочной инфекции показатели легочной функции остаются стабильными в течение многих лет. Можно считать установленным, что применяемые в настоящее время различные режимы оральной, ингаляционной и внутривенной антибиотикотерапии (АТ) могут предупредить или задержать развитие хронической инфекции нижних дыхательных путей. При развившейся легочной инфекции применение адекватных режимов АТ позволяет замедлить темп прогрессирования легочных расстройств. Показания для назначения антибиотиков при МВ До настоящего времени нет единого мнения о том, как долго и как часто следует применять антибиотики у больных МВ. Однако в последние годы в тактике антибактериальной терапии МВ наметилась отчетливая тенденция к более раннему (при появлении первых признаков обострения бронхолегочного процесса) назначению антибиотиков и более длительному их применению, а также их применению с профилактической целью. Основными клиническими симптомами обострения у больных МВ являются: изменение характера кашля, появление ночного кашля, увеличение количества мокроты и изменение ее характера, нарастание одышки, лихорадка, учащение пульса, ухудшение аппетита, падение веса, снижение толерантности к физической нагрузке, цианоз, ухудшение физикальной и рентгенологической картины в легких, показателей ФВД, признаки воспаления по данным лабораторных методов исследования. Важным является мнение врача, постоянно наблюдающего данного ребенка с МВ, о появлении у больного признаков обострения бронхолегочного процесса. Выбор антибиотика определяется видом микроорганизмов, выделяемых из бронхиального секрета больного МВ, и их чувствительностью к антибиотикам. Забор бронхиального секрета для бактериологического исследования осуществляется при откашливании мокроты в стерильную посуду или при невозможности откашливания берется мазок из глубоких отделов задней стенки глотки. Микробиологический анализ мокроты у больных МВ следует проводить не реже, чем 1 раз в 3 месяца. Особенности фармакокинетики антибиотиков при МВ (увеличение системного клиренса, ускорение метаболизма в печени и увеличение почечного клиренса, максимальная концентрация антибиотиков в сыворотке крови у больных МВ ниже, чем при введении той же дозы препарата больным с другой патологией), внутрибронхиальное расположение микроорганизмов, плохое проникновение в мокроту большинства антибиотиков, часто встречающаяся у больных МВ антибиотикоустойчивость микроорганизмов, обусловливает необходимость введения высоких разовых и суточных доз антибиотиков. Антибактериальная терапия при высеве из бронхиального секрета Staphylococcus aureus Staphylococcus aureus является ведущим микробным агентом, высеваемым из бронхиального секрета больных МВ первых лет жизни. Имеются данные о том, что длительное профилактическое назначение оральных противостафилококковых антибиотиков (флуклоксациллина, диклоксациллина) детям с МВ позволяет приостановить развитие ранних проявлений поражения дыхательных путей. Это лежит в основе тактики постоянного профилактического применения противостафилококковых антибиотиков у детей первых лет жизни в ряде центров МВ Америки и Западной Европы. В других же центрах МВ с целью санации мокроты профилактически противостафилококковые антибиотики назначаются курсами по 2 и более недели только при высеве из бронхиального секрета Staphylococcus aureus. При лечении обострения бронхолегочного процесса при МВ, вызванного Staphylococcus aureus, частота курсов антибиотикотерапии продолжительностью обычно до 2 недель у разных больных может варьировать от 1-2 в год до очень частых повторных курсов с короткими интервалами между ними. Чаще применяются противостафилококковые оральные антибиотики (флуклоксациллин, оксациллин, цефалоспориновые антибиотики 1-2 поколения, макролиды, ко-тримоксазол, клиндамицин, фузидиевая кислот, рифампицин). При тяжелом обострении бронхолегочного процесса стафилококковой этиологии широко применяются флуклоксациллин, цефалоспориновые антибиотики 1-2 поколения парентерально (табл.8). Антибактериальная активность против стафилококка и палочки инфлюэнции, фармакокинетические особенности лежат в основе успешного лечения тяжелого обострения бронхолегочного процесса введением цефтриаксона (роцефина) внутримышечно или внутривенно в дозе 50-80 мг/кг 1-2 раза в сутки. При обострении бронхолегочного процесса вызванного метициллинорезистентным стафилококком применяется ванкомицин внутривенно капельно медленно. Таблица 8. Антибиотики, применяемые у больных муковисцидозом при высеве из бронхиального секрета Staphylococcus aureus и Haemophilus influenzae
Антибактериальная терапия при высеве из бронхиального секрета Haemophilus influenzae Haemophilus influenzae (палочка инфлюэнции) может приводить к выраженным дыхательным расстройствам у больных МВ. Высев ее может быть затруднен, т.к. для ее роста необходимы специальные питательные среды. Наличие Haemophilus influenzae можно предположить при выявлении в мазках мокроты большого числа Грам "-" микроорганизмов при отсутствии их роста на обычных питательных средах. Бактериальная инфекция, обусловленная H. influenzae, часто развивается на фоне ОРВИ. АТ препаратами, активными в отношении H. influenzae, рекомендуется проводить профилактически при ОРВИ, при высеве H. influenzae из мокроты у больных МВ без признаков обострения бронхолегочного процесса и при обострении бронхолегочного процесса, вызванного H. influenzae. Длительность курса АТ обычно составляет 14 дней. Применяется, согласно антибиотикограмме, один из перечисленных ниже антибиотиков: амоксициллин, цефаклор, цефиксим, кларитромицин, азитромицин, ко-тримоксазол. Реже, при сохранении признаков обострения бронхолегочного процесса и повторном высеве H. influenzae, рекомендуется проведение курса АТ внутривенно (цефтриаксон и др. цефалоспориновые антибиотики 2-го поколения). Антибактериальная терапия при высеве из бронхиального секрета Pseudomonas aeruginosa В настоящее время не вызывает сомнения, что продолжительность жизни и ее качество у больных МВ значительно улучшились с появлением новых антибиотиков (аминогликозидов, пенициллинов, цефалоспоринов 3-4-го поколений, фторхинолонов, карбапенемов), активных против P. aeruginosa (табл.9). Таблица 9. Антибиотики, применяемые у больных муковисцидозом при высеве из бронхиального секрета Pseudomonas aeruginosa
Антибиотикотерапия МВ при высеве из бронхиального секрета P. aeruginosa проводится:
Большинство антибиотиков, применяемых для лечения синегнойной инфекции, вводятся парентерально, обычно внутривенно. При внутривенной АТ больных с хронической синегнойной инфекцией следует руководствоваться следующими правилами:
В ряде центров МВ, в том числе и нашем, достигли хороших результатов лечения хронической синегнойной инфекции больных муковисцидозом при проведении профилактических курсов внутривенной АТ препаратами, активными по отношению к синегнойной палочке. При этом удается увеличить продолжительность жизни больных, без значимого нарастания антибиотико-резистентности микрофлоры. Учитывая высокую стоимость лечения хронической синегнойной инфекции, возможно начинать проведение профилактических курсов АТ при появлении прогрессивного (каждые 3 месяца) падения показателей функции внешнего дыхания. С 1996г в Российском Центре муковисцидоза (г. Москва) проводится внутривенная АТ детям в домашних условиях. Этот режим в последние годы широко применяется во всех специализированных центрах муковисцидоза Европы и Северной Америки. Преимуществами переноса лечения из больницы в дом пациента являются: отсутствие риска перекрестной и суперинфекции, снятие психоэмоциональных проблем, связанных с госпитализацией, экономическая целесообразность. Возможность проведения внутривенной АТ на дому обсуждается родителями больного ребенка с лечащим врачом и медсестрой. Учитываются различные факторы: состояние ребенка, место жительства семьи, возможность поддержки специалистами Центра, возможности семьи в проведении курса на дому (обеспечение необходимым оснащением), уровень коммуникабельности и образованности родителей ребенка. При проведении внутривенной АТ терапии на дому главным залогом успешности лечения становится правильный уход за катетером, который осуществляют родители ребенка, обученные в Центре муковисцидоза. Занятие по обучению технологии процедуры - разведению и введению антибиотиков, а также правилам ухода за катетером, проводится медсестрой с высшим образованием с каждой семьей индивидуально. Иногда требуется несколько занятий. Тщательная подготовка приносит большую пользу. Главная цель обучения - уверенность в компетентности родителей перед началом курса. Во время обучения некоторые родители решают, что предлагаемая методика слишком сложна, тогда предпочтение отдается стационарному лечению. Если же обучение было успешным, начинается подготовка всего необходимого. Родители закупают или получают по рецептам необходимое оборудование, согласно методическим рекомендациям (памятке), которую они получают в Центре муковисцидоза. Родителям даются номера телефонов Центра и медсестры, по которым всегда можно получить ответы на возникающие вопросы. Родители получают объективную информацию о возможных местных осложнениях катетеризации и путях их решения. Перед курсом внутривенной терапии больной вместе с родителями приглашается в Центр, где наряду с осмотром проводится обязательное первичное обследование (антропометрия, определение функции внешнего дыхания, пульсоксиметрия, микробиологическое исследование мокроты, клинический анализ крови), ставится периферический венозный катетер. Первое введение препарата проводится под наблюдением специалиста Центра муковисцидоза. Патронаж медсестрой Центра проводится в среднем 3 раза за 2 недели стандартного курса лечения. Наблюдение фиксируется в специально разработанном листе патронажа. Во время лечения больные ведут процедурный лист, копия которого направляется в районную поликлинику по месту жительства. По окончании лечения проводятся повторный врачебный осмотр, необходимые обследования и удаляется катетер. За период 1996 - 2001 г.г. специалистами Российского Центра муковисцидоза было проведено 189 курсов внутривенной АТ терапии на дому 44 больным. У всех больных лечение было успешно закончено. Ни у одного больного не было необходимости в госпитализации с целью продолжения терапии. Нами отмечен один случай побочной реакции в виде аллергической сыпи на назначенный антибиотик. Родители, среди которых не было ни одного медицинского работника, правильно проводили манипуляции. Все больные и их родители приветствовали эту стационарозамещающую технологию и высказали заинтересованность в продолжение такой практики. Для обеспечения частых курсов внутривенной терапии у больных муковисцидозом в России используются периферические венозные катетеры. Материал, из которого изготовлен катетер, имеет существенное значение при внутривенной терапии. Отечественные (российские) катетеры делают только из полиэтилена. Это самый простой в обработке материал, но он обладает повышенной тромбогенностью, вызывает раздражение внутренней оболочки сосудов, из-за своей жесткости способен перфорировать сосудистую стенку. При выборе оборудования для катетеризации вен предпочтение отдается полиуретановым катетерам, применение которых существенно снижает частоту тромбозов и перфорацию сосуда. В Российском центре муковисцидоза (г. Москва) в течение последних 1,5 лет для проведения внутривенных курсов антибактериальной, а также муколитической терапии (в стационаре, в амбулаторных условиях, а также на дому) у детей от 0 до 18 лет, страдающих муковисцидозом, используются периферические внутривенные катетеры на игле "Джелко", "Джелко-2" и "Оптива-2" производства фирмы "Джонсон и Джонсон медикал" размерами 22G и 24G. Настоящие катетеры выполнены из высококачественных материалов и соответствуют всем требованиям, предъявляемым периферическим внутривенным катетерам. Катетеры удобны и безопасны в применении для медицинского персонала, хорошо зарекомендовали себя при продолжительной внутривенной терапии и при качественном уходе за ними в процессе проведения терапии практически не вызывают осложнений. Наиболее частой в нашей клинике при лечении хронической синегнойной инфекции является комбинация цефтазидима с аминогликозидом (тобрамицин, гентамицин, амикацин). Фортум (Ceftazidime) фирма Glaxosmithkline (Великобритания) - цефалоспориновый антибиотик 3-го поколения для парентерального применения. Широкого спектра действия, активный в отношении грамотрицательных бактерий, включая P. aeruginosa. Действует бактерицидно, нарушая синтез клеточной стенки микроорганизмов, устойчив к действию большинства лактамаз, является одним из основных антибиотиков, применяемых в лечении хронической синегнойной инфекции у детей с МВ. В нашей клинике проводилось исследование по изучению фармакокинетикии цефтазидима при различных способах его введения больным МВ. Изучалась сравнительная эффективность 3 способов применения цефтазидима у детей с МВ. 95 детям с обострением бронхолегочного процесса цефтазидим вводили в/в струйно из расчета 150 мг/кг массы тела в сутки, из них 63 цефтазидим вводили 2 раза в сутки (разовая доза 75 мг/кг массы тела) (1 группа) и 32 (2 группа) - 3 раза в сутки (разовая доза 50 мг/кг массы тела). 12 детей владеющие техникой дыхательной гимнастики, со средне-тяжелым течением МВ при нетяжелом обострении бронхолегочного процесса получали цефтазидим ингаляционно 1 раз в сутки (3 группа). Ингаляции цефтазидима в дозе 1,5г независимо от массы тела (в среднем 50 мг/кг) проводились с помощью компрессионных ингаляторов фирмы "Pari-Boy"(фирмы PARI, Германия), после сеанса кинезитерапии с использованием специальной респираторной техники. Определение концентрации цефтазидима в сыворотке крови и бронхиальном секрете проводили методом диффузии в агар с использованием стандартной методики. Фармакокинетические исследования проводились совместно с кафедрой клинической фармакологии РГМУ (заведующий кафедрой - проф. Ю.Б.Белоусов). Клиническая эффективность АТ оценивалась по исчезновению клинических симптомов обострения бронхолегочного процесса (уменьшению кашля, количества мокроты, одышки, лихорадки, тахикардии, улучшению аппетита, прибавке веса, увеличению толерантности к физической нагрузке, увеличению уровня Sat O2, показателей функции внешнего дыхания (ФВД), улучшению физикальной и рентгенологической картины в легких) у больных МВ (хороший клинический эффект) или их уменьшению (частичный клинический эффект) сразу после окончания курса лечения. При в/в струйном введении цефтазидима хороший и частичный клинический эффект отмечен у 92% детей 1 группы и 84% детей 2 группы. Стойкость клинического эффекта оценивалась через 28-35 дней после окончания курса лечения цефтазидимом у 48 детей. При этом клинический эффект был сохранен у 72 и 44%% детей 1 и 2 группы соответственно. При ингаляционном применении цефтазидима у всех детей получена положительная клиническая динамика. Концентрация цефтазидима в сыворотке крови и бронхиальном секрете определялась у 36 детей (по 12 детей из каждой группы) до первого введения антибиотика, через 30 мин - 1-2-4-8 час после окончания 1-го введения препарата. У больных 2 группы концентрация цефтазидима в сыворотке крови и бронхиальном секрете определялась также через 12 часов после введения, а у больных 3 группы через 12-24 часа после первого введения цефтазидима. Концентрация цефтазидима в сыворотке крови и бронхиальном секрете определялась у всех больных на 5-е и 14-е сутки перед введением очередной дозы препарата. Основные фармакокинетические параметры при различных способах введения цефтазидима представлены в таблице. Фармакокинетические параметры при различных способах введения цефтазидима
При анализе полученных данных выявлено, что при увеличении разовой дозы цефтазидима до 75 мг/кг (при 2-х кратном в течение суток введении препарата) увеличивалось время сохранения в сыворотке крови концентрации препарата, превышающей МПК90 для синегнойной палочки до 9,5 часов, по сравнению с 7,5 час при разовой дозе цефтазидима 50 мг/кг (при 3-х кратном в течение суток его ведении). При этом в мокроте достигалась более высокая концентрация цефтазидима, превышавшая МПК для синегнойной палочки в 2 раза. При 2-х кратном введении цефтазидима в суточной дозе 150 мг/кг длительность сохранения концентраций препарата в мокроте, превышающих МПК90 для синегнойной палочки, составляла 8 часов, по сравнению с 4 часами при 3-х кратном введении той же суточной дозы. При этом отмечалось и 2-х кратное увеличение площади под фармакокинетической кривой в сыворотке крови и мокроте при 2-х кратном, по сравнению с 3-х кратным введении той же суточной дозы препарата. При ингаляционном введении 1500 мг цефтазидима в мокроте больных МВ определялись концентрации препарата, превышающие МПК90 для синегнойной палочки в 100-150 раз, при этом концентрации препарата, превышающие МПК для синегнойной палочки сохранялись в мокроте до 24 часов, а площадь под фармакокинетической кривой в мокроте в 20 раз превышала соответствующий показатель при в/в введении цефтазидима. Соотношение AUC / MIC Ps.aer. (AUIC) в 1-2-3 группах больных составило 8,7: 22; 420, Cmax / MICPs.aer. 1,6; 2,2; 140, AUCsputum / AUCserum % 14±4; 18±8; 703±17 соответственно. На основании полученных результатов можно сделать заключение о преимуществе 2-х кратного по сравнению с 3-х кратным в/в введении той же суточной дозы цефтазидима. Фармакокинетические параметры свидетельствуют о высокой эффективности ингаляционного применения цефтазидима у больных МВ, позволяющего доставить антибиотик в локус инфекции и создать там концентрации, превышающие MICPs.aer., недостижимые при системном введении препарата. Однако необходимо учитывать, что эффективность ингаляционной терапии, доза вдыхаемого антибиотика у детей зависит от владения и соблюдения техники дыхания, степени выраженности дыхательной недостаточности у ребенка. Кроме того, не вполне ясно насколько равномерно распределяется цефтазидим при его ингаляционном введении по всему бронхиальному дереву. Можно предположить, что концентрации препарата в условиях выраженной бронхообструкции в плохо вентилируемых отделах легких не являются столь высокими. Учитывая снижение чувствительности P. aeruginosa к цефтазидиму, особое значение приобретает внедрение в практику лечения больных МВ новых антибактериальных препаратов, цефалоспоринового ряда и других групп (карбапенемы, пенициллины, активные по отношению к P. aeruginosa). Максипим (Cefipime), фирма Bristol-Myers squibb, США- полусинтетический цефалоспориновый антибиотик 1V поколения. Обладает широким спектром действия в отношении грамположительных и грамотрицательных бактерий, штаммов резистентных к амногликозидам или цефалоспориновым антибиотикам III поколения, таким как цефтазидим. Высокоустойчив к гидролизу большинства -лактамаз, обладает малым сродством в отношении -лактамаз, кодируемых хромосомными генами, и быстро проникает в грамотрицательные бактериальные клетки, оказывает бактерицидное действие на чувствительные к нему микроорганизмы. Его применяли у 23 (39 курсов) больных с хронической колонизацией синегнойной палочки в возрасте от 4 до 14 лет с тяжелым и среднетяжелым течением МВ во время обострений хронического бронхолегочного процесса. Препарат вводился внутривенно струйно или капельно в дозе 150 мг/кг/сутки в 2-3 введения, средняя продолжительность курса составила 17 дней (14-21). Максипим применялся как в монотерапии, так и в комбинации с аминогликозидами. У всех больных, в том числе и у 12 больных при повторных курсах получен отчетливый клинический эффект уже на 5-6 день от начала терапии в виде улучшения клинических параметров и показателей функции внешнего дыхания. Меронем (Meropenem) фирмы Astrazeneca (Великобритания) относится к классу карбапенемов. Бактерицидное действие обусловлено воздействием препарата на синтез клеточной стенки бактерий. Хорошее проникновение через клеточную стенку бактерий, высокий уровень стабильности к большинству -лактамаз, значительная аффиность к белкам, связывающим пенициллин (PBSs), объясняют мощное бактерицидное действие Меронема против широкого спектра аэробных и анаэробных бактерий. Бактерицидные концентрации Меронема обычно соответствуют минимальным ингибирующим (МИК). Некоторые микроорганизмы (метициллинрезистентные стафилококки, Enterococcus faecium, Stenotrophomonas maltophilia) обладают природной устойчивостью к карбапенемам. В нашей клинике Меронем применялся в виде монотерапии у 9 тяжелых больных, в случаях неэффективности традиционных антибиотиков, но в крайне тяжелых случаях назначалась комбинация с аминогликозидами (2 больных). Меронем вводили в разовой дозе 20-40 мг/кг, в три введения внутривенно капельно. Было проведено 26 курсов у 22 больных в возрасте от 6 до 16 лет, средняя продолжительность курса составила 15 дней, при этом не было выявлено побочных эффектов или случаев непереносимости препарата. У всех детей было зафиксировано улучшение со стороны физикальной картины в легких, купирование симптомов интоксикации, достоверное повышение показателей функции внешнего дыхания (как объемных, так и скоростных) в среднем на 15±6% от исходных цифр, что является объективным показателем эффективности лечения у тяжелых больных. Колимицин (полимиксин Е) - разрушает архитектуру клеточной стенки бактерии путем тесного связывания липосахаридными остатками и замещения ионов магния, необходимых для стабильности наружной мембраны, проникает в клетку через цитоплазматическую мембрану и вызывает необратимую утечку содержимого клетки и ее гибель. Отличается от полимиксина -А и -Д аминокислотным состоянием и жирно-кислотным остатком на трипептидной боковой цепи, что уменьшает его токсичность. В условиях формирования резистентности P. aeruginosa ко многим антибактериальным препаратам практически универсальная чувствительность ее к колимицину делает применение колимицина привлекательной альтернативой для внутривенной антибактериальной терапии. Причем мукоидные штаммы сохраняют чувствительность к колимицину нередко больше, чем немукоидные. Мы применяли колимицин в сочетании с ципрофлоксацином и в виде монотерапии в дозе 50 мг/кг/сутки в три введения в/в капельно у 5 тяжелых больных с резистентной к другим группам антибиотиков (цефалоспоринам, аминогликозидам) синегнойной палочкой и получили отличный клинический эффект в виде быстрого купирования симптомов тяжелого обострения хронического бронхолегочного процесса при отсутствии побочных эффектов или с их минимальными проявлениями в виде неврологической симптоматики, которая купировалась самостоятельно после отмены препарата. Случаев формирования резистентности при повторных курсах нами не выявлено. Таким образом, колимицин в/в может применяться с успехом у тяжелых больных для лечения обострений бронхолегочного процесса при условии мониторирования функции почек и неврологического статуса. Колимицин в ингаляциях может быть эффективен для эрадикации P. aeruginosa при первых ее высевах и для улучшения течения респираторного процесса у больных с хронической колонизацией P. aeruginosa Тиментин (Ticarcillin, Clavulanic acid) - комбинированный полусинтетический антибиотик, содержащий натриевую соль тикарциллина - карбоксипенициллина с широким спектром бактерицидной активности и калиевую соль клавулановой кислоты - ингибитора бета-лактамаз с прогрессивно усиливающимся и необратимым действием. Действия бета-лактамаз, продуцируемых многими Грам "+" и Грам "-" бактериями, может привести к разрушению некоторых антибактериальных препаратов еще до начала их воздействия на бактериальную клетку. Калиевая соль клавулановой кислоты блокирует действие бета-лактамаз, что делает бактерии чувствительными к тикарциллину в концентрациях, которые быстро достигаются в организме больного. Тиментин - антибактериальный препарат широкого спектра действия, активный по отношению к P. aeruginosa, выпускается во флаконах по 3,2 грамма (в упаковке по 4 флакона). Фирма - производитель Glaxosmithkline (Великобритания). В Российском центре муковисцидоза проводились клинические исследования по эффективности и безопасности применения Тиментина в АТ 8 детей с тяжелым течением МВ, обострением бронхолегочного процесса по смешанному типу, высевом полирезистентной к антибиотикам Грам "-" флоры, чувствительной к карбенициллину. Препарат применялся в дозе 300 мг/кг/сутки в 4 введения, в/в капельно в сочетании с аминогликозидом в течение 14 дней. Эффективность АТ оценивалась по клиническим показателям (симптомы интоксикации, степень дыхательной и сердечной недостаточности, степень мукостаза и характер мокроты, аускультативной картины в легких), а также показателям пикфлоуметрии, сатурированному кислороду, рентгенологической динамики, ФВД. На фоне комбинированной антибактериальной терапии выявлена стабилизация течения бронхолегочного процесса, улучшение физикальной картины в легких, умеренное улучшение показателей ФВД, уменьшение симптомов интоксикации. Применение Тиментина оправдано при наличии чувствительности к нему микрофлоры мокроты в качестве препарата первого ряда, в комбинированной терапии синегнойной инфекции у детей со среднетяжелым и тяжелым течением муковисцидоза, в дозе 300-400 мг/кг/сутки. В таблицах 10 и 11 приводятся схемы профилактической АТ при хронической синегнойной инфекции и первых высевах P. аeruginosa из мокроты. Таблица 10. Схема АТ, применяемая при хронической синегнойной инфекции
* В Российском центре МВ чаще всего используется цифлоксинал (фирма ПРО.МЕД.ЦС, Прага) Таблица 11. Схема АТ для профилактики развития хронической колонизации P. aeruginosa
При проведении профилактических курсов АТ при первых высевах синегнойной палочки из бронхиального секрета частота перехода непостоянного носительства P. aeruginosa в хроническую синегнойную инфекцию снижается с 58% до 14%, а санация мокроты от P. aeruginosa составляет 80%. Антибактериальная терапия при высеве из бронхиального секрета Burkholderia cepacia Burkholderia cepacia (известная ранее под названием Pseudomonas cepacia) высевается на специальных средах, подавляющих рост P. aeruginosa. Инфекция, обусловленная B. cepacia вызывает большую озабоченность из-за ее мультирезистентности к антибиотикам и трансмиссивности некоторых ее штаммов. Течение Burkholderia cepacia инфекции при МВ различно. Примерно у 1/3 инфицированных больных отмечаются частые обострения бронхолегочного процесса, развивается так называемый cepacia синдром, проявляющийся фульминантной пневмонией, септицемией часто с плохим прогнозом, у других она видимо не влияет на течение заболевания. У больных с высевом Burkholderia cepacia более часто наблюдается суперинфекция, вызванная P. aeruginosa, St. aureus, H. Influenzae. При выборе антибиотика для лечения обострения бронхолегочного процесса необходимо ориентироваться на результаты микробиологического исследования и антибиотикограмму. При тяжелом обострении бронхолегочного процесса, вызванном Burkholderia cepacia,, рекомендуется комбинация из 2 или 3-х антибиотиков (например: фторхинолоны + цефалоспориновые антибиотики 3-4 поколения или карбопенемы или хлорамфеникол + цефтазидим). Цефтазидим, меропенем, имипенем, ципрофлоксацин применяются в дозах, рекомендованных для синегнойной инфекции. В случае нетяжелого обострения рекомендуется оральный прием хлорамфеникола (25 мг/кг х 4 р в день), котримоксазола, доксициклина (100-200 мг) 1раз в день для детей старше 12 лет, ингаляции цефтазидима. Эффективным препаратом может оказаться Флуимуцил антибиотик ит (фирмы Замбон Груп С.П.А., Италия), который включает в себя антибиотик тиамфеникол и муколитик флуимуцил. Поскольку заранее выявить пациентов, у которых развивается быстрое и тяжелое течение инфекции, вызванной Burkholderia cepacia, невозможно, а также учитывая антибиотикорезистентность возбудителя и связанные с этим трудности АТ, следует изолировать больных высевающих Burkholderia cepacia, из мокроты от других больных МВ. Иногда в качестве случайной находки высевается другая патогенная микрофлора - Klebsiella pneumonie, Escherichia coli, Serrata marcescens, Stenotrophomonas maltophilia и Proteus. Роль этих микроорганизмов окончательно не установлена. В случае обострения бронхолегочного процесса, вызванного указанными микроорганизмами, антибиотик подбирается на основании тестов на чувствительность или назначаются препараты, традиционно эффективные при данных формах инфекции. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
