Методические рекомендации по выполнению лабораторных и практических работ по учебной дисциплине ен. 01 Химия
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
ВВЕДЕНИЕМетодические рекомендации по выполнению лабораторных и практических работ по учебной дисциплине Химия являются частью основной профессиональной образовательной программы подготовки специалистов среднего звена (ППССЗ) по специальности СПО 43.02.15 Поварское и кондитерское дело (Базовый уровень подготовки) в соответствии с требованиями ФГОС СПО третьего поколения. Методические рекомендации по выполнению практических занятий и лабораторных работ адресованы студентам 2 курса очнойформы обучения. При выполнении лабораторных и практических работ студент должен знать: - основные понятия и законы химии; - теоретические основы органической, физической, коллоидной химии; - понятие химической кинетики и катализа; - классификацию химических реакций и закономерности их протекания; - обратимые и необратимые химические реакции, химическое равновесие, смещение химического равновесия под действием различных факторов; - окислительно-восстановительные реакции, реакции ионного обмена; - гидролиз солей, диссоциацию электролитов в водных растворах, понятие о сильных и слабых электролитах; - тепловой эффект химических реакций, термохимические уравнения; - характеристики различных классов органических веществ, входящих в состав сырья и готовой пищевой продукции; - свойства растворов и коллоидных систем высокомолекулярных соединений; - дисперсные и коллоидные системы пищевых продуктов; - роль и характеристики поверхностных явлений в природных и технологических процессах; - основы аналитической химии; - основные методы классического количественного и физико-химического анализа; - назначение и правила использования лабораторного оборудования и аппаратуры; - методы и технику выполнения химических анализов; - приемы безопасной работы в химической лаборатории. Уметь: - применять основные законы химии для решения задач в области профессиональной деятельности; - использовать свойства органических веществ, дисперсных и коллоидных систем для оптимизации технологического процесса; - описывать уравнениями химических реакций процессы, лежащие в основе производства продовольственных продуктов; - проводить расчеты по химическим формулам и уравнениям реакции; - использовать лабораторную посуду и оборудование; - выбирать метод и ход химического анализа, подбирать реактивы и аппаратуру; - проводить качественные реакции на неорганические вещества и ионы, отдельные классы органических соединений; - выполнять количественные расчеты состава вещества по результатам измерений; - соблюдать правила техники безопасности при работе в химической лаборатории. I.ТРЕБОВАНИЯ К ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ И ПРАКТИЧЕСКИХ РАБОТ Для проведения лабораторно-практических работ по химии необходимо оборудовать рабочее место: рабочий стол, лабораторно-учебное оборудование, инструменты и реактивы. Результаты выполнения лабораторных и практических работ заносятся студентами в тетрадь. Оформление отчетов по лабораторным и практическим работам нужно осуществлять в соответствии с требованиями к оформлению аналитического лабораторного журнала. Форма записи экспериментальных данных должна содержать ряд обязательных сведений и быть более-менее унифицированной. 1. В тетради необходимо обязательно указать дату выполнения, тему, цель работы, перечень необходимых материалов и оборудования. 2. Все записи нужно вносить в тетрадь сразу же, не надеясь на память. Не нужно вести черновиков. Рекомендуется ничего не исправлять и не стирать. В случае ошибки или неправильных расчетов справа можно написать: «Неправильный расчет», или «Повторный результат», с указанием причины исправления. 3. Результаты можно сводить в таблицы, в которых отражать все исходные, справочные данные и полученные измерения, применяемые формулы и расчеты. Уравнения химических реакций можно записывать отдельными строками. Графики нужно строить с точным обозначением величин на осях координат и их единиц измерения, при этом можно пользоваться клетками тетради или оформить диаграмму на компьютере в Excel и вклеить ее в тетрадь (эту часть отчета выполняется самостоятельно, как домашнее задание). 4. После оформления лабораторно-практической работы необходимо сформулировать ответы на контрольные вопросы и общий вывод по работе. 1. Правила выполнения лабораторных и практических работ 1. Студент должен прийти на лабораторное, практическое занятие подготовленным по данной теме. 2. Каждый студент должен знать правила по технике безопасности при работе в химической лаборатории (и при работе с реактивами в данной работе). 3.После проведения работы студент представляет письменный отчет. 4. Отчет о проделанной работе следует выполнять в журнале лабораторных работ на листах формата А4 с одной стороны листа или в лабораторных тетрадях. Содержание отчета указано в описании лабораторной работы, результаты работы указываются в выводах. 6. Таблицы и рисунки следует выполнять карандашом, записи - синим цветом пасты или чернил. Рисунки выполняются в левой половине листа, наблюдения и выводы в правой части листа. Уравнения реакций записываются во всю строку (после наблюдений и выводов). 7. Зачет по данной лабораторной, практической работе студент получает при положительных оценке за отчет, общий зачет - при наличии зачетов по всем лабораторным работам, практическим работам. 2. Правила по технике безопасности при проведении лабораторных работ -Работая в химической лаборатории, необходимо соблюдать большую осторожность. - Приступать к выполнению задания после указания преподавателя. -Химические реакции выполнять с такими количествами и концентрациями веществ, в таких приборах и посуде, как указано в описаниях работ. - Внимательно прочесть надпись на этикетке, прежде чем взять вещество для опыта, производить опыты в чистой посуде. -Все опыты с выделением ядовитых, летучих и неприятно пахнущих веществ (выпаривание, кипячение растворов кислот, содержащих галогены, аммиак, сероводород) проводить только в вытяжном шкафу. - Выполнять опыты с взрывчатыми, легковоспламеняющимися веществами или кислотами и щелочами с соблюдением мер предосторожности, работая стоя. Поджигать газы и пары после проверки их на чистоту, смесь горючего газа с воздухом взрывается. - Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе. -Реактивы не пробовать на вкус, так как большинство из них ядовиты. -Держать дальше от огня легко воспламеняющиеся вещества: эфир, бензин, спирт, бензол и др. Если эти вещества воспламеняются, накрыть пламя брезентом или засыпать песком. Не зажигать спиртовку, наклоняя ее к другой горящей спиртовке. Гасить спиртовку, накрывая ее колпачком. -В случае возникновения пожара в лаборатории вызвать пожарную охрану, а до прибытия гасить огонь песком, огнетушителем. -В случае ожога лица, рук кислотой или щелочью необходимо оказать пострадавшему помощь. 3. Инструкция по охране труда для студентов при работе в кабинетах (лабораториях) химии 1. Соблюдение требований настоящей Инструкции обязательно для студентов, работающих в кабинете химии. 2. Допуск посторонних лиц в кабинет в момент проведения эксперимента разрешается только с ведома преподавателя химии. 3. Во время работы в кабинете студенты обязаны быть в халатах и пользоваться средствами индивидуальной защиты (по указанию преподавателя), поддерживать порядок на рабочем месте. 4. Прежде чем приступить к выполнению работы, необходимо изучить по учебнику или данному пособию порядок ее проведения. Следует соблюдать указания преподавателя по безопасному обращению с реактивами и растворами, методами нагревания, наполнению сосудов и т.д. 5. Подготовленный к работе прибор необходимо показать преподавателю или лаборанту. 6. Запрещается проводить самостоятельно любые опыты, не предусмотренные данной работой. 7. Запрещается прием пищи и напитков в кабинете химии. 8. Запрещается загромождать проходы сумками. 9. При получении травмы (порезы, ожоги), а также при плохом самочувствии студенты должны немедленно сообщить об этом преподавателю или лаборанту. 10. Запрещается выносить из кабинета и вносить в него любые вещества без разрешения преподавателя. 11. Обо всех разливах жидкостей, а также о рассыпанных твердых реактивах нужно сообщить преподавателю или лаборанту. Самостоятельно убирать любые вещества запрещается. 12. Запрещается выливать в канализацию растворы и органические жидкости, они должны сливаться в специальные сосуды на рабочих местах. 13. Обо всех неполадках в работе оборудования, водопровода, электросети и т.д. необходимо ставить в известность преподавателя или лаборанта. Устранять неисправности студентами самостоятельно запрещается. 14. Запрещается оставлять без присмотра нагревательные приборы. 15. Уборка рабочих мест по окончании работы производится в соответствии с указаниями преподавателя. 16. По окончании практических и лабораторных работ студенты обязаны вымыть руки с мылом. 17. При возникновении в кабинете во время занятий аварийных ситуаций (пожар, появление сильных посторонних запахов) не допускать паники и подчиняться только указаниям преподавателя. ЧТОБЫ ОПЫТ ПОЛУЧИЛСЯ… …ознакомьтесь с каждым пунктом правил и старайтесь точно их выполнять. В химический кабинет заходите только после того, как разрешит преподаватель. Не трогайте и не переставляйте на столе приготовленные реактивы и оборудование – это может затруднить вашу дальнейшую работу. Прежде чем приступить к выполнению химических опытов, обязательно изучите описание лабораторной работы или практического занятия и внимательно выслушайте объяснения преподавателя. Проверьте, все ли необходимое для работы есть на вашем столе. В ходе выполнения работы координируйте свои действия с действиями группы. Разговаривайте шепотом, чтобы не мешать работать другим. Если возникнут какие-либо затруднения, которые вы не можете разрешить самостоятельно, обратитесь за помощью к преподавателю. Вещества берите только шпателем или ложечкой и в тех количествах, которые указаны в описании работы; если таких указаний нет, то объемы веществ не должны превышать 1 мл. (3-4 капли). Чтобы не перепутать пробки, не открывайте одновременно несколько склянок. Если вы случайно взяли вещества больше, чем нужно для данного опыта, лишнее вылейте в специальную склянку для слива веществ или, если вещество твердое, отсыпьте в коробку для мусора. В химической лаборатории (кабинете) очень важно быть предельно аккуратным во всем – тут нет мелочей. Прежде чем начать работать руками, продумайте, как разместить оборудование на столе, чтобы было удобно, и работать, и наблюдать за ходом эксперимента. Не забывайте, что за этим же столом с этими же реактивами и оборудованием будут работать студенты других групп, - не создавайте им дополнительных трудностей, оставив свое рабочее место в беспорядке. Отчет должен содержать следующие сведения: 1. Название работы или занятия. 2. Цель работы или занятия. 3. Номер и название опыта. 4. Краткое описание хода работы или занятия с указанием условий проведения опыта. 5. Рисунки и схемы используемых приборов, 6. Наблюдения и уравнения реакций. 7. Расчеты, таблицы, графики. 8. Вывод. 9.Ответы на контрольные вопросы Если в лабораторных работах или практических занятиях необходимо проводить расчёты. Следует иметь в виду, что излишняя точность в расчетах, значительно превышающая экспериментальную погрешность, не повышает точность результата. Для числовых значений рассчитываемых величин достаточно 3-4 значащие цифры (число знаков, стоящих после предшествующих им нулей). Число значащих цифр не следует путать с числом знаков после запятой. Так в числах: 101,3; 21,73; 0,4385; 0,004500 имеется четыре значащих цифры. В расчетах принято указывать значащие цифры и в том случае, когда это нули, стоящие в конце числа. Поэтому правильной будет запись с точностью до четвертой значащей цифры - 0,2500, а не 0,25. Результаты измерений неизбежно будут отклоняться от истинных значений соответствующих величин. Для определения ошибки необходимо получить 4-5 параллельных результатов измерений и найти среднее арифметическое значение, которое будет больше всего приближаться к истинному значению. При обработке результатов следует определять абсолютную и относительную ошибку измерения данной величины. Абсолютная ошибка показывает, на сколько данная измеряемая величина больше или меньше истинной величины. Отношение абсолютной ошибки к истинной величине, умноженное на 100 %, дает относительную ошибку определения (в процентах) или погрешность. 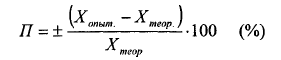 II. ЛАБОРАТОРНАЯ ХИМИЧЕСКАЯ ПОСУДА В химической лаборатории очень часто приходится работать с посудой из стекла и фарфора. Лабораторную посуду можно подразделить на следующие виды: 1. Посуду общего назначения; 2. Посуду специального назначения; 3. Мерную посуду; 4. Фарфоровую посуду. Посуда общего назначения Пробирки (рис.1.) используют для проведения химических опытов с небольшим количеством веществ. Пробирки могут быть цилиндрические и конические. Хранят пробирки в штативах. Перемешивание веществ в них проводят встряхиванием пробирки, нанося небольшой удар пальцем по нижней части пробирки. Моют пробирки с помощью ерша. Стаканы (рис.2.) могут быть разной вместимости (от 1 литра до 25 миллилитров), разной формы, разные по высоте и ширине, термостойкие и нетермостойкие. Колбы (рис.2.) бывают разной вместимости (от 1-2 литров до 25 миллилитров) и разной формы: плоскодонные, круглодонные, конические, колбы Вюрца. Воронки (рис.4.) бывают различной формы и размеров, и в зависимости от этого имеют разное назначение. 2. Посуда специального назначения Эксикаторы (рис.5.) применяют для хранения веществ, легко поглощающих влагу, и для высушивания веществ. Для этого в нижнюю часть эксикатора помещают вещества, которые способны поглощать воду: СаCl2 (безводный), H2SO4 (концентрированная), Р2О5. Промывные склянки (рис.6.) используют для промывания, очистки и высушивания газов. 3. Мерная посуда Мерная посуда (рис.7.) - мерной называют посуду, применяемую для измерения объема жидкости с разной точностью. Для измерения объема с небольшой точностью применяют мерные цилиндры и мензурки. Для точного измерения объема жидкости используют пипетки, бюретки и мерные колбы. Пипетки (рис.7.) используют для отмеривания и переноса, точно определенного объема жидкости. Обыкновенная пипетка представляет собой стеклянную трубку небольшого диаметра с расширением посередине или без него, если пипетка небольшой вместимости (от 0,1 до 2-5 мл). Нижний конец пипетки оттянут в капилляр, а на верхнем конце имеется метка, до которой набирают жидкость. Для отмеривания необходимого объема жидкости нижний конец пипетки, соответствующей вместимости, опускают в жидкость до дна сосуда и с помощью груши (или рта, если раствор не опасен) набирают жидкость, следя за тем, чтобы кончик пипетки все время находился в жидкости. Жидкость набирают выше метки на 2-3 см, затем быстро закрывают верхнее отверстие указательным пальцем, придерживаю пипетку большим и средним пальцами. Затем, слегка ослабив нажим указательного пальца, дают жидкости медленно вытекать из пипетки. Как только нижний мениск жидкости дойдет до метки, палец снова плотно прижимают к верхнему отверстию пипетки. Таким образом, с помощью пипетки отбирается необходимый объем жидкости. Затем пипетку вводят в колбу (или стакан), в которую нужно перенести жидкость, отнимают указательный палец от верхнего отверстия пипетки и дают жидкости стечь по стенке колбы. Оставшуюся при этом жидкость в пипетке не выдувают, так как объем пипетки рассчитан на свободное истечение жидкости. Мерная посуда может быть разной вместимости. В зависимости от объема, который должен быть измерен, подбирается посуда соответствующей вместимости. Мерная посуда градуируется в миллилитрах (мл) или литрах (л). 1 мл соответствует 1 см3, а 1 л - 1 дм3. При измерении объема жидкости мерный сосуд необходимо держать в вертикальном положении, а отсчёты вести по нижней части вогнутой Бюретки (рис.7.) применяют при титровании или для того, чтобы отмерить объем жидкости с точностью до 0,05 мл. Бюретка – стеклянная градуированная трубка, нижний конец которой оттянут и на него надета резиновая трубка со стеклянным шариком. Могут быть и бюретки с притертым стеклянным краном. Перед началом работы бюретки закрепляют в штативе. Заполняют бюретку жидкостью сверху через воронку так, чтобы внутри находился раствор без пузырьков воздуха. Для удаления пузырьков воздуха резиновую трубку изгибают таким образом, чтобы кончик капилляра был направлен вверх, и вытесняют жидкостью весь воздух. Затем бюретку заполняют до нулевой отметки. Мерные колбы (рис.7.) используют для приготовления растворов точной концентрации. Для этого в колбу вносят точную навеску сухого вещества или рассчитанный объем исходного раствора. Затем до половины объема колбы наливают дистиллированную воду. Раствор тщательно перемешивают и доливают дистиллированную воду до метки, (последние 1-2 мл лучше по каплям с помощью пипетки). Потом плотно закрывают колбу пробкой и тщательно перемешивают раствор, переворачивая колбу несколько раз. 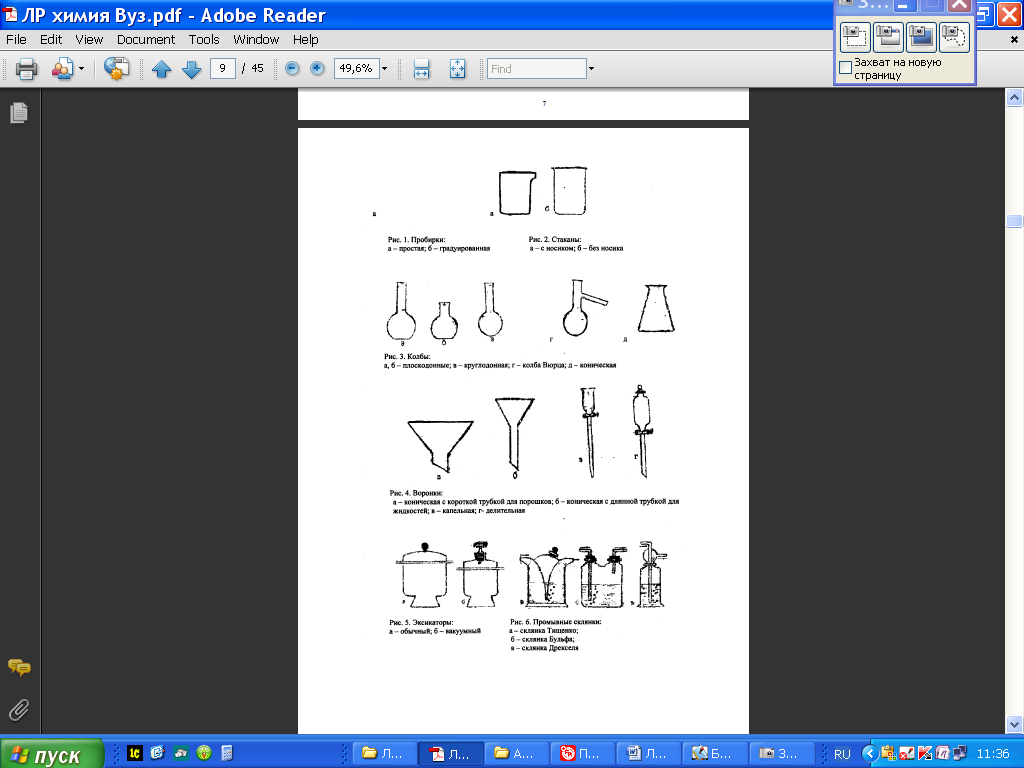 4. Фарфоровая посуда К фарфоровой посуде относят тигли, чашки, ступки, кружки, стаканы и т. д. (рис. 9). Чашки и тигли используют для выпаривания жидкостей и прокаливания твердых веществ. Они выдерживают температуру выше 1000°С. Для измельчения твердых веществ используют ступки. 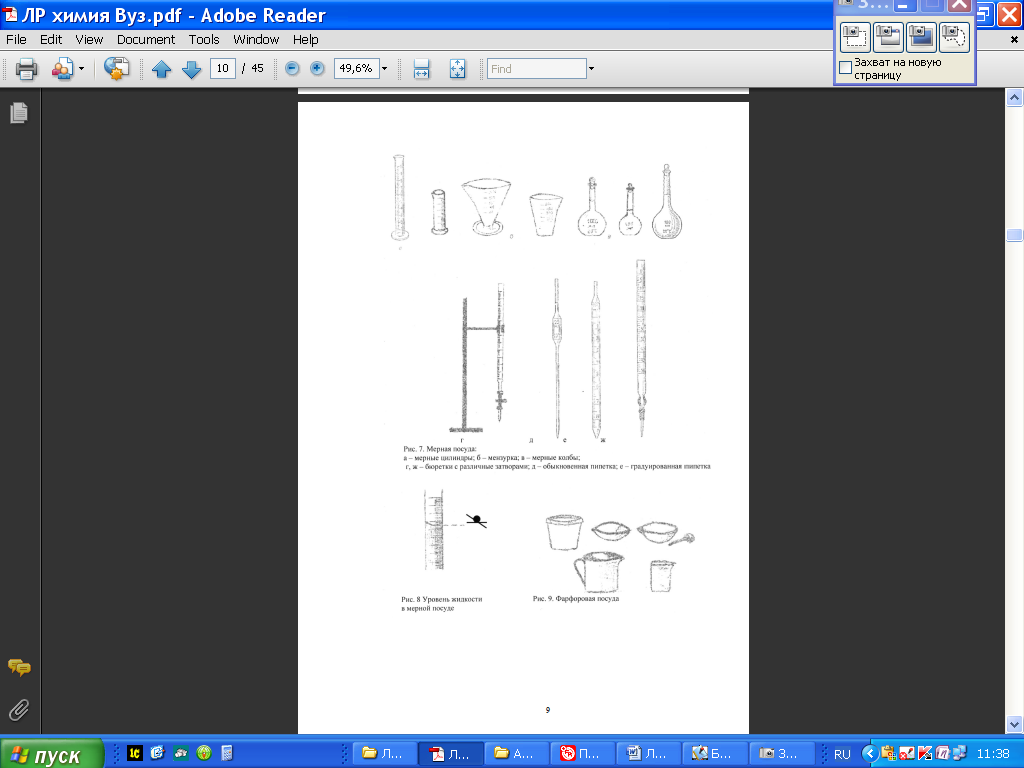 III. ПЕРВАЯ ПОМОЩЬ ПРИ НЕСЧАСТНЫХ СЛУЧАЯХ В лаборатории бывают случаи, требующие неотложной медицинской помощи, - порезы рук стеклом, ожоги горячими предметами, кислотами, щелочами. В особо серьезных случаях необходимо обратиться к врачу. Для оказания первой помощи в лаборатории имеется аптечка. 1. При ранении стеклом удалите осколки из раны, смажьте края раны раствором йода и перевяжите бинтом. 2. При ожоге рук или лица реактивом смойте реактив большим количеством воды, затем либо разбавленной уксусной кислотой (в случае ожога щелочью), либо раствором соли (в случае ожога кислотой), а затем опять водой. 3. При ожоге горячей жидкостью или горячим предметом обожженное место обработайте свежеприготовленным раствором перманганата калия, смажьте обожженное место мазью от ожога или вазелином. Можно присыпать ожог содой и забинтовать. 4. При химических ожогах глаз обильно промойте их водой, используя глазную ванночку, а затем обратитесь к врачу. IV. ЛАБОРАТОРНЫЕ РАБОТЫ Лабораторная работа № 1 Влияние различных факторов на скорость реакции и смещение химического равновесия Цель: Закрепить теоретические знания о скорости химической реакции и ее зависимости от различных факторов: концентрации, температуры, природы веществ, от площади соприкосновения реагирующих веществ, катализатора. Приобрести практические навыки работы с химическим оборудованием и реактивами. Оборудование и реактивы: штатив с пробирками, ступка с пестиком, спиртовка, спички, секундомер, химический стакан (100 мл), мерный цилиндр, мерные пипетки, стеклянная палочка, лучина; гранулированные цинк, алюминий, медь (проволока), карбонат кальция (мел) в кусочках, порошок оксида меди (II), вода горячая, растворы соляной кислоты (HСl), уксусной кислоты (CH3COOH), серной кислоты (H2SO4), тиосульфата натрия (Na2S2О3), перекиси водорода, концентрированная соляная кислота (НСl) (d = 1,19 г/см3), насыщенные растворы хлорида железа (III) (FeCl3), роданида аммония (NH4SCN), кристаллические NH4CI, оксид марганца (IV). Теоретическая часть Скорость химической реакции (υ)- определяется изменением концентрации одного из реагирующих веществ в единицу времени: υ = 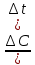 Гомогенные системы - реакции, компоненты которых находятся в одинаковом физическом состоянии - в газообразном или растворенном : аАгаз + вВгаз→сСгаз +dDгаз По закону действующих масс: Скорость прямой реакции равна: υ пр. = Кпр.∙ СА а ∙ СВ в Скорость обратной реакции равна: υ обр.= Кобр..∙ СС с ∙ СD d. К - константа скорости, величина постоянная; С - молярные концентрации (давление) реагентов Гетерогенные системы - реакции, компоненты которых находятся в разных физических состояниях - в газообразном, в растворенном, в твердом. Скорость реакции изменяется только в зависимости от концентрации газов и растворенных веществ: аАтверд.. + вВгаз→ сСжидк. Скорость прямой реакции равна: υ пр. = Кпр.∙СВ в Скорость обратной реакции равна: υ обр.= Кобр..∙ СС с Факторы, влияющие на скорость реакции Природа реагирующих веществ Концентрация реагирующих веществ. Чем выше концентрация веществ, тем больше скорость, протекающей реакции. Т 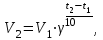 емпература - зависимость скорости реакции от температуры выражается правилом Вант-Гоффа: при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза, где V2 и V1 - скорости реакций при температурах t2 и t1; γ - температурный коэффициент скорости реакции. Поверхность реагирующих веществ. Ингибитор, катализатор. Изменение скорости реакции под действием катализаторов называют - катализом. Экспериментальная частьОзнакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ. Ход работы Опыт 1. Влияние природы реагирующих веществ на скорость реакции 1) Взять три пробирки и налить по 1 мл раствором кислот одинаковой концентрации: в первую – уксусной, во вторую – хлороводородной, в третью – серной. Во все пробирки внести по одинаковому кусочку гранулированного цинка. Отметить различную интенсивность выделения водорода. Написать уравнения реакций цинка с уксусной, хлороводородной и серной кислотами. Сделать вывод о влиянии природы реагирующих веществ на скорость реакции. 2) Налейте в три пробирки по 5 мл раствора соляной кислоты и одновременно в одну бросьте гранулу алюминия, в другую - цинка, в третью гранулу меди. В какой из пробирок реакция пошла и почему? Составьте уравнения реакций взаимодействия металлов с соляной кислотой. Сделайте вывод о зависимости скорости реакции от природы реагирующих веществ. Опыт 2. Влияние степени измельчения на скорость реакции в гетерогенной системе Взять два кусочка мела (карбонат кальция) приблизительно одинакового размера. Один из кусочков поместить в пробирку, а другой измельчить и порошок перенести в другую пробирку. В обе пробирки внести одновременно по 1 мл концентрированной хлороводородной кислоты. Сравнить время растворения мела в каждом случае. Составить уравнение реакции между карбонатом кальция и хлороводородной кислотой. Сделать вывод о влиянии степени измельчения твердых веществ на скорость реакции. Опыт 3. Влияние концентрации реагирующих веществ на скорость реакции в гомогенной системе (взаимодействие тиосульфата натрия с серной кислотой) Провести вначале качественный опыт. Для этого в пробирку внести 5-10капель раствора тиосульфата натрия и 3-5 капель раствора серной кислоты. Наблюдать появление слабой опалесценции и дальнейшее помутнение раствора от выпавшей свободной серы. Приготовить три раствора тиосульфата натрия различной концентрации. Для этого в три сухие пробирки внести: в первую - 4 капли раствора тиосульфата натрия и 8 капель воды, во вторую - 8 капель раствора тиосульфата натрия и 4 капли воды; в третью - 12 капель раствора тиосульфата натрия. Содержимое первых двух пробирок осторожным встряхиванием перемешать. В первую пробирку внести одну каплю раствора серной кислоты. По секундомеру измерить время от момента добавления кислоты до появления в растворе заметной опалесценции. Аналогично определить время течения реакции во второй и третьей пробирках. Вычислить скорость реакции в каждом опыте как величину, обратную времени протекания реакции. Результаты опыта занести в таблицу 1 по форме. Таблица 1
Построить график зависимости скорости реакции от концентрации реагирующих веществ и сделать вывод о характере этой зависимости. Реакция тиосульфата натрия с серной кислотой протекает по уравнению: Na2S2О3 + H2SO4 → Na2SО4 + S + SО2 +H2О. Опыт 4.Влияние температуры на скорость реакции В три пробирки налить по 3 мл раствора серной кислоты (одинаковой концентрации). В каждую пробирку поместить навеску порошка оксида меди (II). Первую пробирку оставить в штативе; вторую – опустить в стакан с горячей водой; третью – нагреть в пламени спиртовки. Составить уравнение реакции между оксидом меди (II) и серной кислотой. Сделать вывод о зависимости скорости реакции от температуры. Опыт 5. Влияние катализатора на скорость реакции Налейте в пробирку 1-2 мл раствора перекиси водорода (Н2О2). Поднесите тлеющую лучинку. Добавьте к перекиси водорода немного оксида марганца (IV). Отметьте, что произошло со скоростью реакции. Поднесите к отверстию пробирки тлеющую лучинку. Что наблюдаете? Оксид марганца (IV) (а также железо, хром, свинец, серебро, марганец и их соли) является в данной реакции катализатором - веществом, ускоряющим реакцию, но само при этом не расходующееся. Запишите наблюдения и соответствующее уравнение реакции. Опыт 6. Влияние концентрации реагирующих и образующихся веществ на химическое равновесие При взаимодействии хлорида железа (III) с роданидом аммония протекает обратимая реакция с образованием малодиссоциированного роданида железа (III), имеющего яркую кроваво- красную окраску: FeCl3 + 3 NH4SCN ↔ Fe(SCN)3 + 3NH4Сl Смещение равновесия легко наблюдать по изменению интенсивности окраски раствора. В стаканчик налить 20 мл воды и внести по 1-2 капли насыщенных растворов хлорида железа (III) и роданида аммония. Окрашенный раствор разлить поровну в четыре пробирки. В одну пробирку добавить 2-3 капли насыщенного раствора хлорида железа (III), во вторую - 2-3 капли насыщенного раствора роданида аммония, в третью внести шпателем немного кристаллического хлорида аммония. Сравнить окраску растворов в этих пробирках с окраской раствора в четвертой пробирке. Во 2-ой и 3-й пробирках окраска раствора усиливается. В четвертую пробирку прибавить сухую соль хлористого аммония и энергично перемещать стеклянной палочкой. Окраска раствора по мере растворения NH4CI заметно ослабляется. Данные опыта занести в таблицу 2. Таблица 2
По изменению интенсивности окраски определить направление смещения равновесия. На основании принципа Ле-Шателье, пользуясь выражением константы химического равновесия K 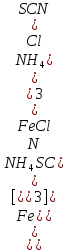 , объяснить изменение окраски растворов по 2-ой, 3-й и 4-й пробирках и влияние концентрации веществ на химическое равновесие. , объяснить изменение окраски растворов по 2-ой, 3-й и 4-й пробирках и влияние концентрации веществ на химическое равновесие.Оформите результаты лабораторной работы в тетради. Сделайте выводы. Контрольные вопросы Как называется раздел химии, изучающий скорость и механизм химических реакций? Что такое скорость химической реакции и в каких единицах она измеряется? От каких факторов зависит скорость химической реакции? Какие системы называются гомогенными и гетерогенными? Дать определение скорости химической реакции. Сформулировать закон действия масс. Каков физический смысл константы скорости химической реакции и от каких факторов зависит се величина. Сформулировать правило Вант-Гоффа. Какие химические процессы называются обратимыми и необратимыми? Привести примеры практически обратимых и совершенно необратимых процессов. Определить понятие химическое равновесие. Сформулировать принцип Ле - Шателье. Действием каких факторов можно сместить равновесие указанных реакций вправо? а) С + Н2О(пар) ↔ СО +Н2; ∆Н = 129,89 кДж б) N2 + 3Н2 ↔ 2NН3; ∆Н = -92,18 кДж От каких факторов зависит константа равновесия? Написать выражение константы равновесия для реакций: а) Ре3О4(К) + 4СО(Г) ↔ 3Fе(К) + 4СО2(Г) б) 2SO2(Г) + 02(Г) ↔ 2SO3(Г) в) РС15(Г) ↔ РСl3(Г) + С12(Г) Как зависит скорость химической реакции от концентрации реагирующих веществ? Напишите математические выражения закона действующих масс для скоростей реакций, протекающих по уравнениям: а) 4 NH3 + 5 O2 = 4 NO + 6 H2O б) 2 H2S + SO2 = 3 S + 2 H2O Лабораторная работа № 2 Приготовление растворов заданной концентрации. Расчеты концентрации растворов Цель: приобрести навыки приготовления растворов различной концентрации, проверить на практике действенность теоретических знаний о способах выражения концентрации веществ в растворе Оборудование и реактивы: весы, разновесы, мерные колбы объёмом 200, 500 мл, пипетки, конические колбы, мерные цилиндры, воронки, ложка-шпатель, химические стаканы, стеклянные палочки, кристаллический хлорид натрия, 20 % раствор соляной кислоты, дистиллированная вода, Теоретическая часть Концентрацией раствора называется весовое содержание растворённого вещества в определённом весовом количестве или в определённом объёме раствора. В химии применяют следующие способы выражения концентрации раствора: процентная, молярная, моляльная и нормальная. Процентная концентрация выражается числом граммов растворённого вещества, содержащимся в 100 г. раствора. Например, 20%-ный раствор поваренной соли – это раствор, в 100 г. которого содержится 20 г. соли и 80 г. воды. Молярная концентрация выражается количеством молей растворённого вещества, содержащимся в 1 л. раствора. Раствор, содержащий 1 моль растворённого вещества в литре, называется одномолярным (1 М раствор), содержащий 0,1 моля, называется децимолярным (0,1 М раствор) и т.д. Моляльная концентрация – концентрация растворённого вещества в молях на 1000 г. растворителя. Нормальная концентрация выражается числом грамм-эквивалентов растворённого вещества, содержащимся в 1 л. 1 г-экв. растворённого вещества, называется одномолярным (1 н. раствор), содержащий 0,1 г-экв. в 1 л. называется децинормальным (0,1 н. раствор) и т.д. Важнейшей характеристикой раствора является его состав или концентрация компонентов. Концентрация раствора – это количество растворённого вещества, которое содержится в определённом количестве растворителя или раствора. Рассмотрим способы выражения концентрации раствора, что наиболее применяются в химической практике. Процентная концентрация (массовая частица растворённого вещества) выражается числом граммов растворённого вещества, содержащимся в 100 г. раствора. Она определяется по формуле: W% = 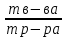 * 100% * 100%где W% - массовая доля растворённого вещества, безразмерная величина; mв-ва - масса растворённого вещества, г; mр-ра– масса раствора, г. Молярная концентрация – равна количеству вещества, которое содержится в 1 л раствора. 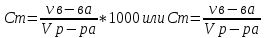 Где нв-ва– количество растворенного вещества, моль; Vр-ра – объём раствора, мл, л. Моляльная концентрация – равно количеству вещества, которое содержится в 1 кг растворителя. 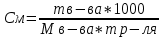 или или 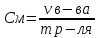 Где нв-ва – количество растворённого вещества, моль; Vр-ра– масса раствора, г, кг. Молярная концентрация эквивалента (нормальность) – равна количеству эквивалентов растворённого вещества, которое содержится в 1 л раствора. 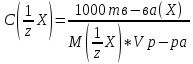 или или 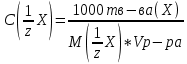 Где нв-ва– масса растворённого вещества, г; Vр-ра– объём раствора, мл, л. M 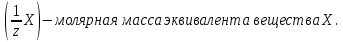 Экспериментальная часть Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ. Ход работы Задание 1. Приготовить 1 л раствора хлорида натрия с молярной концентрацией 0,155 М. Рассчитайте массу хлорида натрия. Для расчетов используйте формулы: C = ν : V; ν = C *V; m = ν *M; m = C *V* M Взвесьте на весах рассчитанную навеску. Перенести навеску соли в мерную колбу. Прилейте в колбу немного воды и перемешать стеклянной палочкой до полного растворения соли. Налейте в мерную колбу воды до метки. Чтобы не перелить воду, последние капли добавлять с помощью пипетки. Задание 2. Приготовить 0,5 л раствора соляной кислоты с молярной концентрацией 0,10 М из раствора с массовой долей соляной кислоты 20% (ρ = 1,1 г/см3). Рассчитайте объем раствора соляной кислоты, необходимые для приготовления раствора. Для расчетов используйте формулы: Cm = ν : V; ν = C *V; m = ν *M; m = Cm *V* M; m = ρV Взвесьте на весах рассчитанную навеску. С помощью мерного цилиндра отмерьте рассчитанный объем раствора соляной кислоты и перелейте его в мерную колбу. Затем налейте в мерную колбу воды до метки. Чтобы не перелить воду, последние капли добавлять с помощью пипетки. Оформите результаты лабораторной работы в тетради. Сделайте выводы. Контрольные вопросы Объясните, в чём сущность процесса растворения? Перечислите известные вам способы выражения концентрации раствора. Что такое нормальность и молярность раствора? Решите задачи на расчет концентрации растворов Вариант 1 1. Сколько граммов КCl следует растворить в 100 г воды для получения 5 %-ного раствора? 2. Чему равна молярность раствора, содержащего в 0,75 л 4,41 г поваренной соли? 3. К 700 г водного раствора этанола с массовой долей 20 % добавили 240 мл этилового спирта (ρ = 0,80 г/мл). Рассчитайте массу спирта в полученном растворе. 4. Определить молярную и нормальную (эквивалентную) концентрацию 16% - ного раствора NaOH (ρ = 1,18 г/мл) 5. Определите молярную концентрацию раствора Н3РО4, в 500 мл которого содержится Н3РО4 массой 9,8 г. Вариант 2 1. Сколько сахара и воды надо взять для приготовления 500 г 2,5 %-ного раствора? 2. Рассчитайте молярность 70%-го раствора серной кислоты объемом 1 л (ρ = 1,622 г/мл). 3. Чему равна процентная концентрация 2 М раствора КОН объемом 1 л (ρ = 1,08 г/мл) 4. Какой объём 20%-ной серной кислоты (ρ=1,14 г/мл) надо прибавить к 100 мл воды, чтобы получить 5%-ный раствор? 5. Сколько граммов Na2CO3 содержится в 0,1 М растворе объемом 200 мл? Лабораторная работа № 3 |
