Методические рекомендации по выполнению лабораторных и практических работ по учебной дисциплине ен. 01 Химия
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
Экспериментальная частьОзнакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ. Ход работы Опыт 1. Окислительные свойства солей железа (III). Налейте в пробирку 2—3 капли раствора хлорида или сульфата железа (III) и прибавьте такой же объем раствора иодида калия или натрия. Обратите внимание на изменение окраски раствора, которое может быть связано с образованием в нем свободного иода. Для обнаружения иода разбавьте несколько капель испытуемого раствора в отдельной пробирке трех-четырехкратным объемом воды, после чего добавьте 2—3 капли раствора крахмала. Отметьте окрашивание образующегося соединения иода с крахмалом. Напишите уравнение реакции. Составьте электронный баланс. Укажите окислитель и восстановитель. Опыт 2. Восстановительные свойства металлов. 1) Поместите в одну пробирку 1—2 кусочка цинка, в другую — железа и прибавьте немного раствора нитрата или ацетата свинца. Через несколько минут становится заметным образование блестящих кристаллов свинца на поверхности кусочков металла. Напишите уравнения реакции. Составьте электронный баланс. Укажите окислитель и восстановитель. 2) Поместите в пробирку 1—2 кусочка железа и прибавьте немного раствора сульфата меди (II). Как изменилась поверхность железа и цвет раствора? Напишите уравнение реакции. Составьте электронный баланс. Укажите окислитель и восстановитель. Опыт 3. Восстановительные свойства металлов по отношению к иону Н+. Поместите в две пробирки по 1—2 кусочка цинка и железа и прибавьте по 5—7 капель 10%-ного раствора соляной кислоты. Наблюдается выделение водорода? Какова интенсивность взаимодействия испытуемых металлов с кислотой и от каких факторов она зависит? Напишите уравнения реакций. Составьте электронный баланс. Укажите окислитель и восстановитель. Опыт 4. Поведение металлов в щелочной среде. Поместите в пробирку по 1—2 кусочка алюминия и в каждую добавьте по 5—7 капель 10%-ного раствора гидроксида калия или натрия. Дайте содержимому пробирок постоять 2—3 мин. Наблюдается ли выделение газа в пробирке? Напишите уравнения реакций. Составьте электронный баланс. Укажите окислитель и восстановитель. Опыт 5. Окисление сульфата железа (II) дихроматом калия. Налейте в пробирку 2—3 капли раствора дихромата калия и столько же 2 н. раствора H2SO4, после чего прилейте по каплям раствор сульфата железа (II) или соль Мора. Пока дихромат-ионы полностью не прореагируют, оранжевый цвет их в сочетании с цветом образовавшихся гидратированных ионов хрома (III) придает раствору бурое окрашивание. Поэтому добавление по каплям раствора сульфата железа (II) следует вести до достижения устойчивой окраски. В какой цвет окрашен раствор? Какую функцию выполняет в этой реакции сульфат железа (II)? Напишите уравнение реакции. Составьте электронный баланс. Укажите окислитель и восстановитель. Опыт 6. 1—2 кристалла железного купороса FeSО4*7H2О или соли Мора (NH4)2SО4*FeSО4*6H2О растворите в 3—4 каплях воды, подкислите таким же объемом разбавленной серной кислоты и полученный раствор по каплям приливайте к 2—3 каплям раствора перманганата калия в другой пробирке до обесцвечивания раствора. Напишите уравнения реакций. Составьте электронный баланс. Укажите окислитель и восстановитель. Какой реакцией можно обнаружить появление в растворе ионов железа (III)? Напишите уравнение реакции. Оформите результаты лабораторной работы в тетради. Сделайте выводы. Контрольные вопросы и задания: Для предложенных схем реакций составьте электронные уравнения. Расставьте коэффициенты методом электронного баланса. Для каждой реакции укажите, какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое - восстанавливается. HNО3+ Са → NH4NО3+ Ca(NО3)2+ Н2О H2S+ Сl2 + Н2О → H2SО4+ НС1 KClО3 + Na2SО3→KC1 + Na2SO4 Практическая работа № 7 Окислительные свойства перманганата калия Цель: Закрепить и углубить знания об окислительных свойствах перманганат-иона, закрепить умения определять его роль в ходе реакций, умения составлять электронный баланс, показывать переход электронов. Отработать навыки экспериментального проведения ОВР, соблюдая технику безопасности. Оборудование и реактивы: штатив с пробирками, растворы серной кислоты, гидроксида натрия, сульфита натрия, перманганата калия, дистиллированная вода. Теоретическая часть Для подбора коэффициентов в уравнениях окислительно-восстановительных реакций, протекающих в водном растворе при участии ионов, используют метод электронно-ионного баланса.Метод подбора коэффициентов с помощью электронно-ионного баланса складывается из следующих этапов: а) записывают формулы реагентов данной окислительно-восстановительной реакции K2Cr2O7 + H2SO4 + H2S и устанавливают химическую функцию каждого из них (здесь K2Cr2O7 - окислитель, H2SO4 - кислотная среда реакции, H2S - восстановитель); б) записывают (на следующей строчке) формулы реагентов в ионном виде, указывая только те ионы (для сильных электролитов), молекулы (для слабых электролитов и газов) и формульные единицы (для твердых веществ), которые примут участие в реакции в качестве окислителя (Cr2O72-), среды (Н+ - точнее, катиона оксония H3O+) и восстановителя (H2S): Cr2O72- + H+ + H2S в) определяют восстановленную формулу окислителя и окисленную форму восстановителя, что должно быть известно или задано (так, здесь дихромат-ион переходит катионы хрома(III), а сероводород - в серу); эти данные записывают на следующих двух строчках, составляют электронно-ионные уравнения полуреакций восстановления и окисления и подбирают дополнительные множители для уравнений полуреакций: полуреакция восстановления Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O 1 полуреакция окисления H2S - 2 e- = S(т) + 2H+ 3 г) составляют, суммируя уравнения полуреакций, ионное уравнение данной реакции, т.е. дополняют запись (б): Cr2O72- + 8 H+ + 3 H2S = 2 Cr3+ + 7 H2O + 3 S(т) д) на основе ионного уравнения составляют молекулярное уравнение данной реакции, т.е. дополняют запись (а), причем формулы катионов и анионов, отсутствующие в ионном уравнении, группируют в формулы дополнительных продуктов (K2SO4): K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4 е) проводят проверку подобранных коэффициентов по числу атомов элементов в левой и правой частях уравнения (обычно достаточно только проверить число атомов кислорода). Окисленная и восстановленная формы окислителя и восстановителя часто отличаются по содержанию кислорода (сравните Cr2O72- и Cr3+). Поэтому при составлении уравнений полуреакций методом электронно-ионного баланса в них включают пары Н+ / Н2О (для кислотной среды) и ОН- / Н2О (для щелочной среды). Если при переходе от одной формы к другой исходная форма (обычно - окисленная) теряет свои оксид-ионы (ниже показаны в квадратных скобках), то последние, так как они не существуют в свободном виде, должны быть в кислотной среде соединены с катионами водорода, а в щелочной среде - с молекулами воды, что приводит к образованию молекул воды (в кислотной среде) игидроксид-ионов (в щелочной среде): кислотная среда [O2-] + 2H+ = H2O щелочная среда [O2-] + H2О = 2 ОН- Недостаток оксид-ионов в исходной форме (чаще - в восстановленной) по сравнению с конечной формой компенсируется добавлением молекул воды (в кислотной среде) или гидроксид-ионов (в щелочной среде): кислотная среда H2O = [O2-] + 2H+ щелочная среда 2 ОН-= [O2-] + H2О Реакции окисления - восстановления могут протекать в различных средах: в кислой, нейтральной и щелочной. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления. Рассмотрим пример влияния среды на восстановление перманганат-иона MnO4-: 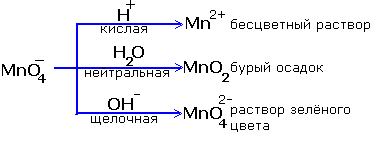 Обычно для создания в растворе кислой среды используют серную кислоту. Для создания щелочной среды применяются растворы гидроксидов калия или натрия. Рассмотрите примеры протекания реакции между нитритом калия KNO2 (восстановитель) c перманганатом калия KMnO4 (окислитель). Расставьте коэффициенты методом электронного баланса и методом полуреакций, укажите окислитель и восстановитель. 1) KMnO4 + H2SO4 + KNO2 = MnSO4 + KNO3 + K2SO4 + H2O 2) KMnO4 + H2O + KNO2 = MnO2 + KNO3 + KOH. 3) KMnO4 + NaOH + KNO2 = K2MnO4 + KNO3 + H2O |
