ҚМЖ. c3664229-7fa1-11e6-98d6-f6d299da70eeУММ АХ. Методические указания для проведения лабораторных занятий 23
 Скачать 494 Kb. Скачать 494 Kb.
|
|
Лекции № 8. Гидролиз и амфотерность Цель: ознакомиться с основными особенностями гидролиза различных солей. Основные вопросы: Гидролиз солей. Амфотерность. Краткое содержание: ГИДРОЛИЗ СОЛЕЙ. Гидролизом называется реакция обменного разложения между водой и растворенным в нем веществом, сопровождающаяся изменением величины рН раствора. Суммарный эффект гидролиза определяется природой образующихся в растворе катионов и анионов. В зависимости от состава солей различают три вида гидролиза: Гидролиз солей, образующих в растворе катионы, не обладающие поляризационными и акцепторными свойствами, и анионы с ясно выраженной донорной способностью. Количественно процесс гидролиза характеризуется константой и степенью гидролиза. Константой гидролиза называют отношение произведения концентраций продуктов гидролиза к концентрации негидролизованных ионов соли. Степенью гидролиза называют отношение концентрации гидролизованной части соли (моль/л) к общей ее концентрации в данном растворе. Для данного случая гидролиза: Кгидр = Кw/Ккисл. h 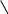 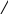  = Кw/Kкисл·ссоли = Кw/Kкисл·ссоли рН = 7 + 1/2lgKосн – 1/2lgссоли Гидролиз солей, образующих в растворе катионы-комплексообразователи и анионы-слабые доноры электронных пар. Кгидр = Кw/Kосн h 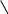 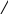  = Кw/Kосн·ссоли = Кw/Kосн·ссоли рН=7-1/2lgKкисл + 1/2lgcсоли 3. Гидролиз солей, образующих в растворе сильнополяризующие катионы-комплексообразователи и анионы – доноры электронных пар.    Кгидр = Кw/Kосн·Ккисл Кгидр = Кw/Kосн·Ккислh/(1-h) = Кw/Kосн·Kкисл рН=7-1/2lgKкисл+1/2lgКосн. АМФОТЕРНОСТЬ Способность ряда электролитов проявлять (в зависимости от условий) как кислотные, так и основные свойства называется амфотерностью. Амфотерность часто объясняется на основе электростатической теории химической связи, предложенной в 1916 г. В.Косселем. Лекции № 9-10. Окислительно-восстановительные процессы Цель: ознакомиться с основными особенностями протекания окислительно-восстановительных процессов. Основные вопросы: 1.Окислительно-восстановительные потенциалы и направленность окислительно-восстановительных реакций. 2. Составление уравнений реакций окисления восстановления с учетом влияния рН среды. Краткое содержание: ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ И НАПРАВЛЕННОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ. Металл, погруженный в раствор его соли, всегда приобретает некоторый потенциал по отношению к раствору. Поэтому металл, опущенный в раствор своей соли, можно рассматривать как электрод, обладающий отрицательным или положительным потенциалом. Потенциал металла, опущенного в 1н. раствор его соли, называется стандартным потенциалом. Электрохимический ряд напряжений металлов есть ряд нормальных электродных потенциалов, определенных по отношению к потенциалу стандартного водородного электрода. Окислительно-восстановительные потенциалы позволяют количественно судить об активности окислителя и восстановителя. Стандартным окислительно-восстановительным потенциалом называется потенциал системы, в которой все участники полуреакции находятся в стандартном состоянии, а растворенные вещества – в стандартном растворе. Реакция окисления-восстановления протекает в заданном направлении в том случае, когда разность между окислительно-восстановительными потенциалами окислителя и восстановителя будет величиной положительной, т.е. Е= Еокисл. – Евосст. > 0 При этом, чем больше разница потенциалов окислителя и восстановителя, тем больше вероятность протекания данной реакции окисления-восстановления. СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ ОКИСЛЕНИЯ ВОССТАНОВЛЕНИЯ С УЧЕТОМ ВЛИЯНИЯ РН СРЕДЫ. Существует несколько методов составления уравнений окислительно-восстановительных реакций. Основные из них следующие: метод электронного баланса. метод составления ионно-электронных уравнений. Подбор коэффициентов методом электронного баланса ведут по изменению степени окисления атомов или ионов окислителя и восстановителя, связанного с перемещением электронов. Так как при реакциях окисления-восстановления электроны только переходят от одних атомов или ионов к другим, то очевидно, что количество электронов, которые присоединит окислитель, должно быть равно количеству электронов, отданных восстановителем. Составляя на этом основании баланс электронов, находят коэффициенты участвующих в реакциях веществ. Подбор коэффициентов осуществляется в несколько стадий. В ионно-электронном методе подбор коэффициентов производится в несколько стадий. Сначала составляют общую ионную схему данной реакции, определяют восстановитель и окислитель. Затем составляют частные ионно-электронные уравнения отдельно для реакции окисления и реакции восстановления. После этого частные уравнения суммируют, находят общий наибольший делитель для числа отдаваемых и принимаемых электронов и получают полное ионно-электронное уравнение. Лекция №11. Образование коллоидных систем. Цель: ознакомиться с основными свойствами коллоидных систем. Основные вопросы: Коллоидное состояние вещества. Явление коагуляции и пептизации. Влияние концентрации, заряда ионов, температуры на коагулирующее действие электролитов. Краткое содержание: КОЛЛОИДНОЕ СОСТОЯНИЕ ВЕЩЕСТВА. ЯВЛЕНИЕ КОАГУЛЯЦИИ И ПЕПТИЗАЦИИ. Коллоидные системы состоят из нескольких фаз: дисперсной фазы, которую составляют частички коллоида, и дисперсионной среды – окружающего их вещества. Если дисперсионной средой является вода, то коллоидный раствор называют гидрозолем. Коллоидные растворы бывают двух типов: лиофильные и лиофобные. Процесс укрупнения частиц и выпадение их в осадок носит название коагуляции. Существование зарядов у частиц придает коллоидам определенную устойчивость. Коагуляция наблюдается при проведении реакций окисления-восстановления, обмена и гидролиза, приводящих к образованию труднорастворимых веществ. Основные понятия: коллоидная частица, коллоидное ядро, противоионы, мицелла (см. глоссарий). Процесс, противоположный коагуляции, называется пептизацией. ВЛИЯНИЕ КОНЦЕНТРАЦИИ, ЗАРЯДА ИОНОВ, ТЕМПЕРАТУРЫ НА КОАГУЛИРУЮЩЕЕ ДЕЙСТВИЕ ЭЛЕКТРОЛИТОВ. Наличие у коллоидных частичек заряда, одинакового по знаку, придает им свойство отталкиваться друг от друга и, таким образом, делает коллоидный раствор устойчивым. На процесс коагуляции также оказывает влияние температура и концентрация растворов электролитов. Лекция №12. Закон действия масс и комплексообразование. Цель: ознакомиться с особенностями применения комплексных соединений в аналитической химии. Основные вопросы: 1.Комплексные соединения, их состав и строение. 2. Маскировка мешающих ионов и разрушение комплексных ионов. Краткое содержание: КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ, ИХ СОСТАВ И СТРОЕНИЕ. Основные составляющие КС: центральный атом (комплексообразователь), лиганды, внутренняя сфера, внешняя сфера, координационное число. Константа ионизации комплексного иона характеризует его устойчивость и одновременно способность ионизировать на простые составляющие его ионы, вследствие этого она и получила название константы нестойкости. Величина, обратная константе нестойкости, называется общей константой устойчивости. Куст = 1/Кнест МАСКИРОВКА МЕШАЮЩИХ ИОНОВ И РАЗРУШЕНИЕ КОМПЛЕКСНЫХ ИОНОВ. В практике качественного анализа известно много примеров, когда одни ионы мешают открытию других. Во всех этих случаях мешающие ионы или удаляются, или же маскируются. Сущность маскирования сводится к связыванию их в тот или иной прочный комплекс, в результате чего обычные свойства мешающих ионов перестают проявляться. Лекции № 13. Анионы и анализ сухого вещества. Цель: ознакомиться с классификацией анионов и анализом сухого вещества. Основные вопросы: Классификация анионов, групповые реагенты. Анализ сухого вещества. Краткое содержание: КЛАССИФИКАЦИЯ АНИОНОВ, ГРУППОВЫЕ РЕАГЕНТЫ. К первой аналитической группе анионов относятся сульфат-, сульфит-, карбонат-, фосфат-, силикат- ионы. Групповым реагентом для данной группы анионов является хлорид бария в нейтральной и слабощелочной среде. Ко второй аналитической группе анионов относятся хлорид-, бромид-, иодид-, сульфид- ионы. Групповым реагентом на анионы второй группы является нитрат серебра в присутствии азотной кислоты. К третьей группе анионов относятся нитрат-, нитрит-, ацетат- ионы. Группового реагента на анионы третьей группы нет. АНАЛИЗ СУХОГО ВЕЩЕСТВА. Существуют различные варианты анализа сухого вещества: анализ вещества, растворимого в воде, анализ вещества, нерастворимого в воде. Лекции № 14-15. Методы разделения и концентрирования. Эмиссионная спектроскопия. Цель: ознакомиться с хроматографией, эмиссионным анализом, экстракцией. Основные вопросы: Сущность хроматографии. Ионообменные смолы. Сущность экстракции, понятие об эмиссионном анализе. Краткое содержание: СУЩНОСТЬ ХРОМАТОГРАФИИ. ИОНООБМЕННЫЕ СМОЛЫ. Хроматографический метод анализа позволяет исследовать как качественный, так и количественный состав веществ и их смесей. Основоположником является М.С. Цвет. Работы Цвета послужили основой для развития всех современных видов хроматографии. В настоящее время наибольшее распространение получила адсорбционная, ионообменная, осадочная, распределительная, окислительно-восстановительная и адсорбционно-комплексообразовательная хроматография. СУЩНОСТЬ ЭКСТРАКЦИИ, ПОНЯТИЕ ОБ ЭМИССИОННОМ АНАЛИЗЕ. Экстракция – метод разделения, который заключается в переведении соединения определяемого элемента из водного раствора в слой органического растворителя, не смешивающегося с водой. Экстракцию используют и как метод концентрирования: небольшие количества определяемых ионов, находящихся в водном растворе в присутствии преобладающих количеств других ионов, сначала переводят действием определенных реагентов в комплексные соединения, которые затем экстрагируют небольшим количеством органического растворителя. Эмиссионный спектральный анализ предполагает сжигание некоторого количества пробы в газовом пламени или в электрической дуге. При этом вещество испаряется, молекулярные соединения обычно диссоциируют на атомы, которые возбуждаются и дают свечение. Различают следующие виды эмиссионного спектрального анализа: визуальный, фотографический, фотоэлектрический, пламенная фотометрия. Количественный анализ (4 семестр). Лекция №1. Предмет и методы количественного анализа. Цель: ознакомиться с хроматографией, эмиссионным анализом, экстракцией. Основные вопросы: Предмет, значение, роль, основные разделы количественного анализа. Физические и физико-химические методы количественного анализа, ошибки анализа. Краткое содержание: ПРЕДМЕТ, ЗНАЧЕНИЕ, РОЛЬ, ОСНОВНЫЕ РАЗДЕЛЫ КОЛИЧЕСТВЕННОГО АНАЛИЗА. Предмет количественного анализа – изучение методов, позволяющих определять количественный состав вещества. Задача количественного анализа – определение количественного содержания химических элементов (или их групп) в соединениях. Методы количественного анализа разделяются на химические, физические и физико-химические. К химическим методам относятся гравиметрический (весовой), титриметрический (объемный) и газовый. В гравиметрическом анализе обычно судят о количестве составной части в соединениях или в смесях путем выделения ее в виде труднорастворимого осадка, по массе которого вычисляют количество искомой составной части. В титриметрическом анализе о количестве вещества судят по данным измерения объемов растворов двух веществ, вступивших в реакцию, причем концентрация одного из этих растворов должна быть известной. ФИЗИЧЕСКИЕ И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО АНАЛИЗА, ОШИБКИ АНАЛИЗА. Методы анализа, позволяющие определять состав вещества, не прибегая к использованию химических реакций, называют физическими методами анализа. Методы анализа, основанные на наблюдении физических явлений, происходящих при протекании определенных химических реакций, называют физико-химическими методами. Оптические методы: фотометрический, нефелометрический, эмиссионный, люминесцентный, рентгеноспектральный. Электрохимические: электрогравиметрические, потенциометрический, кондуктометрический, кулонометрический, полярографический. Также используют масс-спектральный, хроматографический, радиометрический методы количественного анализа. Лекции №2-3. Гравиметрический (весовой) анализ. Цель: ознакомиться с гравиметрическим методом количественного анализа. Основные вопросы: Сущность гравиметрического анализа. Осаждение. Краткое содержание: СУЩНОСТЬ ГРАВИМЕТРИЧЕСКОГО АНАЛИЗА. ПРАВИЛА ОБРАЩЕНИЯ С АНАЛИТИЧЕСКИМИ ВЕСАМИ. В основе гравиметрического анализа лежит закон постоянства состава, по которому отношение массы элементов, входящих в состав вещества, всегда одинаково, и закон эквивалентов, по которому массы элементов, участвующих в реакции, всегда обнаруживают постоянное и неизменное отношение друг к другу. Определение начинается с взятия навески анализируемого вещества и переведения его в раствор. Далее определяемый компонент осаждают из раствора в виде какого-либо малорастворимого соединения (осаждаемая форма), которое затем отделяют от маточного раствора, удаляют все посторонние примеси, адсорбировавшиеся на осадке, и переводят посредством высушивания или прокаливания в устойчивое соединение вполне определенного состава (весовая форма). Аналитические весы – точный физический прибор, требующий осторожного обращения. Перед взвешиванием необходимо проверить состояние весов, установить нулевую точку. Не следует перегружать весы сверх установленной нагрузки. Следует предварительно взвесить на технических весах. Необходимо убедиться нет ли загрязнений на внешней поверхности весов. Не сдвигать весы с занимаемого места. Ставить предметы или гирьки на чашки весов или снимать их можно только после предварительного арретирования весов. Поворачивать арретир следует медленно и осторожно. На чашки весов нельзя ставить горячих предметов. Взвешивание вещества необходимо производить в специальной посуде – в тигле, на часовом стекле, бюксе. При взвешивании следует пользоваться только боковыми дверцами. Гирьки следует брать только пинцетом. Все взвешивания производить на одних и тех же весах, пользуясь одним и тем же разновесом. ОСАЖДЕНИЕ. Количество осадителя определяется содержанием определяемого элемента в исследуемом веществе. Процесс кристаллизации характеризуется двумя стадиями: образование зародышевых центров кристаллизации; дальнейший их рост. Для получения кристаллических осадков необходимо способствовать протеканию второй стадии. Факторы, влияющие на форму и структуру осадков: концентрация растворов, температура, порядок и скорость осаждения, наличие электролитов, созревание. Созревание – процесс укрупнения частиц при стоянии осадков. Выпадение в осадок вместе с осаждаемым соединением каких-либо посторонних веществ называется соосаждением. Адсорбцией называется поглощение вещества поверхностью твердого тела (адсорбента). Окклюзией называется вид соосаждения, при котором происходит захват примесей из раствора внутрь кристалла. Ошибки количественного анализа делятся на две группы: 1. случайные ошибки, которые по знаку и величине неопределенны, предвидеть их невозможно, но они могут быть уменьшены увеличением числа параллельных определений. 2. систематические ошибки, которые по знаку постоянны и зависят от определенных причин. Разность между истинным значением и значением определяемой величины, найденной в опыте, выражаемая в абсолютных единицах, называется абсолютной ошибкой. Отношение абсолютной ошибки к истинному содержанию величины называется относительной ошибкой. |
