Физика молекулярная. Методические указания к лабораторным работам для студентов инженерных специальностей
 Скачать 0.62 Mb. Скачать 0.62 Mb.
|
Вопросы для самопроверкиОбъясните процесс теплопроводности с точки зрения молекулярнокинетической теории. Назовите способы передачи теплоты, отличные от теплопроводности, и объясните их механизм. Что называется коэффициентом теплопроводности? В каких единицах измеряется коэффициент теплопроводности? ЛАБОРАТОРНАЯ РАБОТА 2ОПРЕДЕЛЕНИЕ ПРИРАЩЕНИЯ ЭНТРОПИИ ПРИ ПЛАВЛЕНИИ ОЛОВАЦелью работы является ознакомление с одним из методов измерения прирашений энтропии с помощью термопары. В работе измеряется приращение энтропии олова при плавлении. Оборудование: тигельная печь, тигель с оловом, сосуд с маслом, милливольтметр, термопара, секундомер. Теоретическое введениеВ соответствии с первым началом термодинамики тепло dQ. подводимое к системе, идет на приращение внутренней энергии системы dUи на совершение системой работы против внешних сил dA. 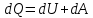 , (1) , (1)где 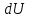 - внутренняя энергия системы, т.е. сумма всех видов кинетической и потенциальной энергии всех составных частей системы: молекул, атомов, электронов и т.д. (для идеального газа внутренняя энергия представляет собой только кинетическую энергию хаотического теплового движения молекул). - внутренняя энергия системы, т.е. сумма всех видов кинетической и потенциальной энергии всех составных частей системы: молекул, атомов, электронов и т.д. (для идеального газа внутренняя энергия представляет собой только кинетическую энергию хаотического теплового движения молекул).Теплота и работа - количественные характеристики двух разных форм изменения энергии системы, две формы передачи энергии от одного тела к другому, а не какие-то особые виды энергии. Равновесным состоянием называется такое состояние, в котором все параметры имеют одинаковые значения во всей системе. Тепловой процесс протекает в одном направлении и является необратимым. Круговым процессом называется процесс, в результате совершения которого система возвращается в первоначальное состояние. Процесс называется обратимым, если система может вернуться в первоначальное состояние, пройдя в обратном порядке через все промежуточные состояния. Первое начало термодинамики не позволяет определить направление протекания термодинамических процессов, в его формулировке нет запрета для процесса передачи тепла от холодного тела к горячему. Введением понятия энтропии можно определить направление тепловых процессов. Второе начало термодинамики формулируется так: «невозможен процесс, единственным результатом которого является передача энергии в форме тепла от холодного тела к горячему». Энтропией называется функция 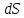 состояния системы, дифференциал которой в элементарном обратимом процессе равен отношению бесконечно малого количества тепла состояния системы, дифференциал которой в элементарном обратимом процессе равен отношению бесконечно малого количества тепла 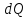 , сообщенного системе, к абсолютной температуре системы Т: , сообщенного системе, к абсолютной температуре системы Т: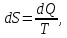 (2) (2)Полное приращение энтропии при получении системой количества тепла 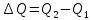 равно: равно: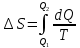 (3) (3)Для изолированной системы справедливо неравенство Клаузиуса 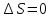 . Энтропия изолированной системы не убывает. Энтропия изолированной системы постоянна, если в системе протекают только обратимые процессы. В реальной изолированной системе процессы необратимы, и энтропия возрастает. . Энтропия изолированной системы не убывает. Энтропия изолированной системы постоянна, если в системе протекают только обратимые процессы. В реальной изолированной системе процессы необратимы, и энтропия возрастает.Больцман предложил формулировку второго начала термодинамики, отражающую его статистический смысл: «Во всякой изолированной системе происходят такие изменения, которые приводят систему к ее наиболее вероятному состоянию». Изменение энтропии определяется по формуле Больцмана: 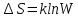 , ,где 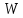 - термодинамическая вероятность; - термодинамическая вероятность; 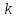 - постоянная Больцмана. - постоянная Больцмана.Термодинамической вероятностью данного макросостояния называется число микросостояний, соответствующих этому макросостоянию. Термодинамическая вероятность состояния характеризует степень неупорядоченности макроскопического состояния и является функцией параметров состояния системы. Следовательно, энтропия также является функцией параметров состояния. В частности, при плавлении твердого тела энтропия системы должна измениться. Это изменение можно вычислить, зная температуру плавления и ряд других легко определяемых величин. |
