Лабораторная диагностика холеры. МУК 4.2.2218-07 Лабораторная диагностика холеры. Методические указания мук 221807
 Скачать 2.25 Mb. Скачать 2.25 Mb.
|
|
6.2. Биохимические свойства Биохимическую активность холерного вибриона изучают, используя коммерческие среды и тест-наборы или среды лабораторного приготовления, рецептура которых изложена в разделе 7. Определение индофенолоксидазы а) С помощью реактивов. Реактивы: 1%-е водные растворы диметил-пара-фенилендиамина, тетраметил-пара-фенилендиамина (гидрохлорида), этилоксиэтил-пара-фенилендиамина серно-кислого (из набора для обработки бумаги «фотоцвет») и пара-аминодиметиланилина (гидрохлорида или оксалата) в сочетании с 1%-м спиртовым раствором α-нафтола или без него. Реактивы должны быть бесцветными, их следует хранить во флаконах из темно-коричневого стекла со стеклянной пробкой без доступа света в холодильнике. В случае помещения реактива во флаконы из светлого стекла их следует обернуть алюминиевой фольгой или темной бумагой. Постановка пробы: на поверхность 18-часовой агаровой культуры, подозрительной колонии или полусливного роста на щелочном агаре наносят 1 каплю 1%-го водного раствора одного из указанных реактивов. Положительная реакция на индофенолоксидазу – ярко красная окраска культуры через 20-30 с. При использовании двухкомпонентной реакции (в сочетании с α-нафтолом) в положительных случаях – синее окрашивание культуры в течение 1-2 мин. б) Для постановки пробы на оксидазу можно использовать тест-систему ОКСИ-тест или специальные бумажки из набора СИБ, MTC-V или пропитать помещенную в чашку Петри полоску фильтровальной бумаги 2-3 каплями 1%-го водного раствора одного из реактивов. Культуру наносят на полоску смоченной реактивом бумаги платиновой петлей (но не хромникелевой), стеклянной или деревянной палочкой и размазывают в виде небольшого пятнышка. Через 10-30 с появляется пурпурно-красное окрашивание, свидетельствующее о положительной реакции. Из грамотрицательных бактерий положительную пробу на индофенолоксидазу дают вибрионы, аэромонады, псевдомонады, плезиомонады, а отрицательную – все эн-теробактерии. Не следует ставить пробу на оксидазу с культурами на полиуглеводных средах, а также с колониями на элективных средах (СЭДХ и TCBS). Учитывая возможную нестойкость реактивов и различную способность вибрионов к образованию оксидазы на различных питательных средах, пробу обязательно сопровождают положительными и отрицательными контролями соответственно с культурами вибрионов или псевдомонад и энтеробактерий, выращенными на используемом в лаборатории питательном агаре. Определение типа расщепления глюкозы (тест Хью-Лейфсона) В две пробирки со средой Хью-Лейфсона засевают уколом в столбик изучаемую культуру. Поверхность среды в одной из пробирок покрывают 0,5-1,0 мл стерильного вазелинового масла. Посевы инкубируют от 1 до 4 суток при температуре (37,0 ± 0,5)°С. Окисление определяют по желтой окраске среды только в аэробных, ферментацию – в аэробных и анаэробных условиях роста. Вибрионы расщепляют глюкозу по ферментативному типу. Определение декарбоксилазной и дигидролазной активности В пробирки со средами, содержащими лизин, орнитин, аргинин и контрольную среду без аминокислот, засевают по полной петле 18-часовой культуры и заливают 0,5-1,0 мл стерильного вазелинового масла. Инкубируют посевы при температуре (37,0 ± 0,5) °С. Учет результатов ежедневно, при сомнительном результате – наблюдение до 4 суток. В результате ферментации глюкозы вначале происходит сдвиг рН в кислую сторону, а в дальнейшем при гидролизе аминокислот накапливаются амины, и происходит защелачивание среды. Ферментацию углеводов и многоатомных спиртов (глюкоза, лактоза, манноза, сахароза, арабиноза, маннит, салицин, дульцит, инозит, крахмал и др.) определяют в жидких или полужидких средах Гисса с индикатором бромтимоловым синим, Андреде, ВР. Для посева используют культуру, выращенную в течение 12-20 ч на плотной питательной среде или в течение 3-4 ч – в жидкой питательной среде. Посевы на средах с углеводами и спиртами инкубируют при (37,0 ± 0,5) °С и учитывают через 6-18 ч. Для определения диастатической активности кроме среды Гисса с крахмалом может быть использована и среда Кодама. Культуру засевают в среду и также инкубируют при (37,0 ± 0,5) °С. Через 18 ч в пробирку со средой Кодама добавляют 2-3 капли раствора Люголя. При разложении крахмала среда не окрашивается. Определение протеолитических свойств В столбик желатины уколом засевают 18-часовую культуру и инкубируют в течение 2-3 суток при температуре (22 ± 0,5) °С или при (37,0 ± 0,5) °С в течение 18 ч. Перед учетом результатов пробирки помещают в холодильник на 20 мин. При положительном результате желатина остается жидкой, а при отрицательном (и в контрольной пробирке) – затвердевает. Определение образования индола Холерные вибрионы при выращивании в средах, содержащих триптофан (пептонная вода, мясо-пептонный бульон, бульон Хоттингера и др.), расщепляют его с образованием индола, что выявляется с помощью индикаторных бумажек или реактива Эрлиха после инкубирования при температуре (37,0 ± 0,5)°С в течение 18 ч. Определение образования сероводорода Холерные вибрионы не продуцируют фермент тиосульфатредуктазу, т. е. не способны расщеплять неорганические серосодержащие соединения, присутствующие в среде Клиглера и маннозо-сахарозной среде – это является дифференциальным признаком. Однако они так же, как некоторые другие энтеробактерии, продуцируют фермент цистиндесульфогидролазу, за счет которого способны образовывать сероводород из серосодержащих аминокислот, присутствующих в достаточном количестве в бульоне Хоттингера, мясо-пептонном бульоне, но отсутствующих или содержащихся в незначительном количестве в 1%-й пептонной воде. Поэтому для постановки этого теста культуры выращивают в 1%-й пептонной воде при температуре (37,0 ± 0,5)°С в течение 18-20 ч. Образование сероводорода регистрируют с помощью индикаторных бумажек. Использование микротест-систем и СИБ Для определения оксидазы, образования индола и сероводорода, декарбоксилаз лизина, орнитина, дигидролазы аргинина, ферментации углеводов и многоатомных спиртов при идентификации вибрионов можно также использовать Систему индикаторную бумажную (СИБ) и микротест-ситемы для биохимической идентификации вибрионов. 6.3. Выявление способности к биолюминесценции Изучаемые штаммы засевают в 1%-ю пептонную воду или на пластинки щелочного агара, инкубируют при температуре (37,0 ± 0,5) °С в течение 18 ч. Выросшие культуры просматривают в темной комнате. Свечение наблюдают после 5-10-минутной адаптации в темноте. 6.4. Тесты дифференциации биоваров холерных вибрионов О1 Определение чувствительности к диагностическим холерным фагам В лабораторной диагностике холеры используют бактериофаги диагностические холерные классический и эльтор. При оценке результатов проб с фагами необходимо ориентироваться на диагностический рабочий титр (ДРТ), который обычно обозначают на этикетках. Определение чувствительности к фагам проводят как с цельными препаратами, так и с их 10-кратными разведениями до ДРТ в мясо-пептонном бульоне. Дифференциальный рабочий титр не ниже 1×10-2. Для постановки реакции в чашки разливают щелочной агар. После застывания агара и подсушивания его в течение 30 мин при температуре 37°С дно чашек делят на квадраты по количеству образцов фагов и 10-кратных разведений фага. В пробирку с 5 мл 0,5-0,7%-го питательного агара, расплавленного и охлажденного до 45°С, добавляют 0,1-0,2 мл 3-4-часовой бульонной культуры, тщательно смешивают и выливают на поверхность агара. Чашки оставляют при комнатной температуре с приоткрытыми крышками на 30 мин. В центр квадратов наносят штампом-репликатором, стандартной петлей или тонко оттянутой пастеровской пипеткой по капле фагов в соответствующих разведениях. После подсыхания капель чашки переворачивают вверх дном и помещают в термостат при температуре (37,0 ± 0,5)°С. Результаты учитывают через 3-4 и 18-20 ч. Наличие лизиса в виде одного «стерильного» пятна или группы мелких негативных колоний оценивается как положительный результат. Определение чувствительности к полимиксину В В расплавленный и остуженный до 45°С питательный агар (рН 7,2 ±0,1) добавляют полимиксин В из расчета 50 единиц на 1 мл среды. После тщательного перемешивания среду разливают в чашки Петри. На застывшие агаровые пластинки наносят обычной бактериологической петлей 18-ти или 3-часовую бульонную культуру. Результаты учитывают после инкубирования посевов при температуре 37°С в течение 18 ч. Холерные вибрионы биовара cholerae не растут на полимиксиновом агаре, для холерных вибрионов биовара eltor – признак вариабелен. Постановка реакции гемагглютинации На предметное стекло в чашке Петри помещают каплю 0,9%-го раствора хлорида натрия и суспендируют в ней петлей 18-часовую агаровую культуру. Затем добавляют каплю 2,5%-й взвеси куриных эритроцитов, трижды отмытых 0,9%-м раствором хлорида натрия. Стекло покачивают до смешивания взвеси эритроцитов и вибрионов. При положительной реакции в течение 1 мин наступает склеивание эритроцитов. Реакцию сопровождают двумя контролями: а) в каплю 0,9%-го раствора хлорида натрия добавляют каплю 2,5%-й взвеси эритроцитов; б) в капле 0,9%-го раствора хлорида натрия суспендируют испытуемую культуру. Контроли должны быть отрицательными. Для постановки пробы могут быть использованы эритроциты морской свинки. Постановка реакции Фогес-Проскауэра (на ацетилметилкарбинол) Испытуемую культуру засевают в глюкозо-фосфатный бульон Кларка и инкубируют при температуре (37,0 ± 0,5) °С в течение 1-3 суток. Затем к 1 мл бульонной культуры добавляют 0,6 мл 6%-го спиртового раствора альфа-нафтола и 0,4 мл 40%-го раствора едкого калия. Пробирки встряхивают и помещают в термостат на 1 ч. При положительной реакции среда окрашивается в розовый или ярко-красный цвет. 6.5. Тесты межвидовой дифференциации патогенных для человека вибрионов Определение галофильности вибрионов Суточную агаровую культуру исследуемого штамма засевают в 1%-ю пептонную воду с 3% натрия хлорида. Через 3-4 ч инкубации при температуре (37,0 ± 0,5)°С переносят строго по 1 капле выросшей культуры в пептонную воду без NaCl, с 7 и 10% натрия хлорида. Через 18-20 ч инкубации оценивают рост культур по помутнению среды. К негалофильным относятся V.cholerae и V.mimicus, для роста которых достаточны следовые количества соли в среде. Вибрионы остальных видов, за исключением некоторых штаммов V.fluvialis и V.metshnikovii не растут в 1%-й пептонной воде без добавления натрия хлорида и устойчивы к значительным его концентрациям. Определение способности вибрионов к росту при разных температурах Способность вибрионов к росту при температуре 4; 20; 30; 35; 40; 45 и 50°С выявляют при посеве суточных культур в 1%-ю пептонную воду с 0,5% натрия хлорида для негалофильных вибрионов и с 1,5-2,0% натрия хлорида для галофильных вибрионов. Наличие роста оценивают визуально в сравнении с контролем. Наблюдают за посевами ежедневно в течение 2 недель. Определение нитратредуктазы а) Суточную агаровую культуру засевают в 1 мл бульона Хоттингера с 0,1% азотно-кислого калия. После 2-х суток инкубации при температуре (37,0 ± 0,5)°С в посевы добавляют 0,5 мл реактива Грисса. В положительных случаях среда сразу же окрашивается в красный цвет. б) К 1-2-суточной культуре в бульоне Хоттингера с 0,1% KNCh добавляют 3-5 капель реактива, представляющего собой смесь равных объемов 0,1%-го раствора риванола в дистиллированной воде и 12%-го раствора соляной кислоты. В случае положительной реакции бульон окрашивается в красный цвет. Определение β-галактозидазы Суточную агаровую культуру засевают на скошенную поверхность агара, содержащего 10% лактозы. Посевы инкубируют 1-2 суток при температуре (37±0,5)°С. Петлю выросшей культуры суспендируют в 0,25 мл 0,9%-го раствора натрия хлорида, добавляют 0,25 мл водного раствора О-нитрофенил-β-D-галактопиранозита (ONPG) и помещают в термостат при (37±0,5)°С. Реакцию учитывают через 20 мин, 1, 3 и 24 ч. В положительном случае взвесь приобретает желтую окраску, отрицательном – остается бесцветной. 6.6. Оценка эпидемической значимости холерных вибрионов 6.6.1. Определение гемолитической активности (по Грейгу) К 1 мл 18-24-часовой культуры, выращенной в 4-5 мл мясо-пептонного бульона добавляют 1 мл 1%-й взвеси трижды отмытых эритроцитов барана в физиологическом растворе. Смесь бульонной культуры и эритроцитов осторожно перемешивают встряхиванием и помещают на 2 ч в термостат при температуре (37,0±0,5)°С, а затем в холодильник до следующего дня. Предварительный учет результатов проводят через 2 ч, окончательный – на следующий день. При положительной реакции наступает полный или частичный лизис эритроцитов (лаковая кровь). В контроле (1 мл бульона + 1 мл взвеси эритроцитов) гемолиз отсутствует. Чистоту опыта следует контролировать путем высева «смеси» на агаровую среду. Для постановки пробы Грейга может быть использована дефибринированная кровь барана, консервированная борной кислотой или консервантом Алсевера. Консервированные эритроциты сохраняют свои свойства в течение 3-х месяцев. Перед постановкой пробы на гемолиз дефибринированную кровь центрифугируют при 2-3 тыс. об./мин в течение 15 мин, надосадочную жидкость удаляют, а осевшие эритроциты отмывают 0,9%-м раствором хлорида натрия 2-3 раза с промежуточным центрифугированием до получения прозрачной надосадочной жидкости. Из отмытых эритроцитов приготавливают 1%-ю взвесь в 0,9%-м растворе хлорида натрия, которую можно хранить при температуре 4°С 2-3 дня и использовать для постановки пробы Грейга описанным выше способом (рецепты консервантов см. раздел 7). 6.6.2. Определение эпидзначимости холерных вибрионов эльтор комплексным методом – по отношению к диагностическим холерным бактериофагам эльтор ctx+ и ctx в соответствии с наставлением к препаратам и гемолитической активности Методика определения гемолитической активности описана выше. Для постановки пробы с фагом используют метод агаровых слоев. Испытуемую культуру в объеме 0,5 мл добавляют пипеткой в пробирку с 5,0 мл 0,5-0,7 %-го агара Мартена рН 7,6 ± 0,2, расплавленного и охлажденного до 45 °С. После перемешивания все содержимое выливают на подсушенную поверхность агара Мартена рН 7,6 ± 0,2 в чашку Петри. После застывания слоя агара с культурой на его поверхность наносят цельные фаги эльтор ctx+ и ctx. После высыхания капель фагов чашки переворачивают агаром вверх и инкубируют при температуре (37,0 ± 0,5)°С. По лизису фагами и гемолитической активности в пробе Грейга (табл. 6) исследуемые штаммы относят к эпидемически опасным (I группа, вариант 1), эпидемически неопасным (III группа, варианты 6, 7, 8) или требующим дополнительных исследований для заключения об их эпидзначимости (группа II, варианты 2, 3, 4, 5). 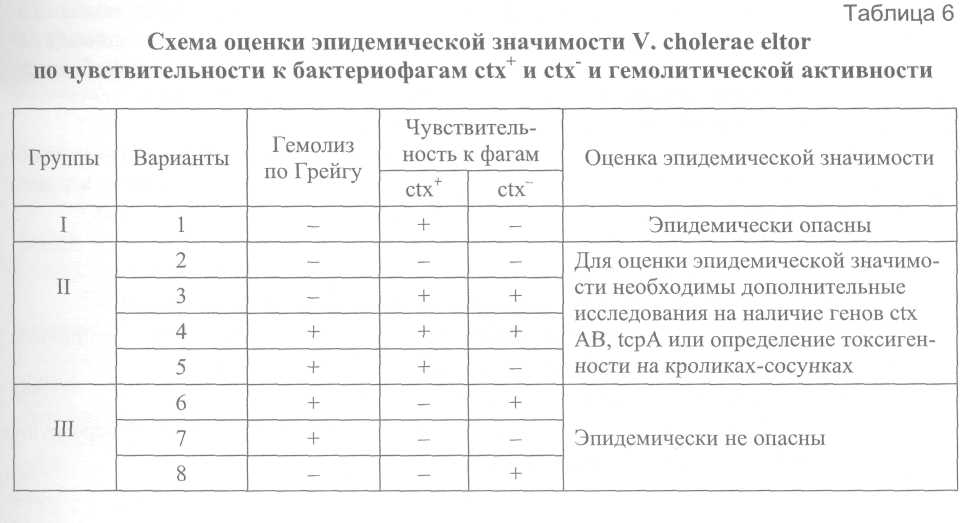 6.6.3. Определение токсигенности холерных вибрионов на модели кроликов-сосунков Исследования проводят в лабораториях, имеющих разрешение на экспериментальную работу с микроорганизмами I-II групп патогенности. Для заражения животных используют 4-часовую агаровую культуру, выращенную при температуре (37,0 ± 0,5) °С или 18-часовую – при температуре (20,0 ± 1,0) °С. Необходимо использовать две заражающие дозы: 1×105 и 1×107 м.к., которые вводят внутрикишечно в объеме по 0,2 мл двум кроликам. Заражающую дозу контролируют путем высева на две чашки щелочного агара 0,1 мл взвеси из разведения 1×10 м.к./мл. Кроликов 10-12-дневных, массой 130-160 г, фиксируют к станку брюшком вверх, выстригают шерсть на операционном поле и смазывают его йодом. Дают эфирный или внутримышечно тиопенталовый наркоз (0,2 мл 1%-го раствора на 100 г массы). Делают разрез длиною 1 см по средней линии живота на уровне пупка. Извлекают петлю тонкого кишечника на длинной брыжейке, фиксируют с помощью мягкого пинцета и вводят взвесь вибрионов. Петлю погружают в брюшную полость, брюшную стенку и кожу послойно зашивают. Шов смазывают йодом. Оперированных крольчат кормят с помощью шприца молоком и наблюдают 48 ч. Всех погибших и умерщвленных через 48 ч животных вскрывают и делают высев содержимого кишечника на чашки щелочного агара. Наиболее выраженные изменения наблюдаются в толстом кишечнике, который растянут бесцветной или светло-желтой прозрачной или слегка опалесцирующей жидкостью. Слепая кишка и прилегающие отделы толстого кишечника могут быть настолько растянуты, что сквозь них видны подлежащие петли кишечника, что создает видимость полной прозрачности кишечного содержимого. Тонкий кишечник расширен и также заполнен полупрозрачным содержимым. Описанные изменения характерны для «синдрома холерогенности», наблюдаемого при заражении эпидемически опасными, содержащими ген холерного токсина штаммами. Токсигенные (содержащие ген холерного токсина) штаммы холерных вибрионов вызывают гибель большинства зараженных животных дозами 1×105 и 1×107 м.к. в течение первых двух суток с описанным выше типичным «синдромом холерогенности». Штаммы холерных вибрионов, не содержащие гена холерного токсина, как правило, не вызывают гибели животных и изменений в кишечнике или обусловливают накопление в кишечнике выживших или единичных павших животных мутной, бесцветной или коричневато-жёлтой жидкости, т. е. развитие энтеропатогенного синдрома, связанного с реализацией других факторов патогенности. Обязательной проверке на модели кроликов-сосунков при отсутствии возможности определения эпидзначимости другими методами подлежат следующие штаммы V.cholerae 01 и 0139 серогрупп. а) Выделенные от людей: гемолизнегативные штаммы холерных вибрионов 0139 серогруппы; гемолизпозитивные штаммы холерных вибрионов обеих серогрупп; гемолизнегативные штаммы холерных вибрионов 01 серогруппы, атипичные по серологическим свойствам и устойчивые к фагам эльтор и ctx+. б) Выделенные из объектов окружающей среды: • гемолизотрицательные штаммы холерных вибрионов 01 и 0139 серогрупп, выделенные при отсутствии эпидосложнений по холере. 6.6.4. Определение генов холерного токсина (ctxAB) и токсинкорегулируемых пилей (tcpA) А. Полимеразная цепная реакция (ПЦР) Методом ПЦР проводят определение генов холерного токсина (ctx AB) и токсинкорегулируемых пилей (tcp A). В основе ПЦР лежит амплификация (умножение) участка генома, ограниченного парой специфических праймеров, путем многократного копирования при помощи фермента – термостабильной ДНК-полимеразы (Taq-полимеразы). Образование в результате реакции фрагментов ДНК ожидаемого размера свидетельствует о наличии в пробе специфической ДНК. Материал для исследования. Материалом для исследования может быть клинический материал (испражнения, рвотные массы), объекты окружающей среды (вода поверхностных водоемов, смывы с поверхностей, стоки, ил), чистые культуры вибрионов, I и II среда накопления. Первичную подготовку, обеззараживание материала и выделение ДНК проводят в соответствии с МУ 1.3.1794-03 «Организация работы при исследованиях методом ПЦР материала, инфицированного микроорганизмами I-II групп патогенности». Подготовка проб для ПЦР. Подлежащие исследованию пробы испражнений или рвотных масс в объеме 1 мл (1 г) помещают в стерильные флаконы и добавляют 0,9 мл 0,9%-го раствора натрия хлорида, суспендируют встряхиванием и отстаивают в течение 10 мин. Затем для отделения крупных частиц центрифугируют в течение 3 мин при 5000 g (об/мин). Надосадочную жидкость центрифугируют в течение 15 мин при 12000 g (об/мин), после чего осадок ресуспендируют в 100 мкл дистиллированной воды. Подготовленную таким образом пробу обеззараживают. Воду из поверхностных водоемов (стоки) центрифугируют в полном объёме (1л) в центрифужных стаканах ёмкостью 250 мл в течение 15 мин при 12 000 g (об/мин.). Осадок ресуспендируют в 1 000 мкл или 1,5-2,0 мл дистиллированной воды. Пробы обеззараживают. Подозрительные колонии и чистые культуры, выросшие на плотных питательных средах, суспендируют в 50 мкл дистиллированной воды в микропробирке объемом 1,5 мл, доводя концентрацию до 5 единиц по стандартному образцу мутности (ОСО 42-28-59-86П), что соответствует 1×109 м.к./мл для вибрионов. Затем готовят 10-кратные разведения взвесей в дистиллированной воде до необходимой концентрации с учетом чувствительности используемой ПЦР-тест-системы и обеззараживают. При исследовании сред накопления их центрифугируют в течение 15 мин при 12000 g (об/мин). Осадок ресуспендируют в 100 мкл дистиллированной воды и обеззараживают. Обеззараживание проб. Все пробы обеззараживают путем кипячения в течение 30 мин, что обеспечивает инактивацию культур холерных вибрионов согласно пункту 2.8.16 СП 1.3.1285-03. Выделение ДНК. Из подготовленных и обеззараженных таким образом проб проводят выделение ДНК с помощью сертифицированных наборов для выделения ДНК и согласно прилагаемой к набору инструкции. При исследовании чистых культур этап выделения ДНК опускают, для постановки ПЦР используют обеззараженные кипячением бактериальные взвеси. Постановка ПЦР. Для постановки ПЦР используют разрешенные комитетом МИБП к применению в практике здравоохранения ПЦР-тест-системы. Работу выполняют согласно прилагаемой к тест-системе инструкции. Амплификацию проводят на программируемых термоциклерах отечественного и зарубежного производства. Учет результатов ПЦР. Для учета результатов ПЦР используют электрофорез в агарозном или полиакриламидном геле. Условия проведения электрофореза, визуализации результатов и их учет отражены в инструкциях к ПЦР-тест-системам. При этом следует обратить внимание на следующие моменты: если в положительном контроле отсутствует специфическая полоса (ошибка в постановке реакции, неправильное хранение или загрязнение реактивов в процессе работы, сбой программы амплификатора) – требуется повторная постановка реакции; если в отрицательном контроле выявляется специфическая полоса на уровне положительного контроля (контаминация реактивов положительной ДНК или продуктами амплификации) – необходимо поставить дополнительные отрицательные контроли на этапе постановки ПЦР. Если результат повторяется – необходимо сменить реактивы. Наличие полос ампликонов, располагающихся выше или ниже контрольной полосы, является неспецифическим ответом, и результат реакции оценивается как отрицательный. |
