Лабораторная диагностика холеры. МУК 4.2.2218-07 Лабораторная диагностика холеры. Методические указания мук 221807
 Скачать 2.25 Mb. Скачать 2.25 Mb.
|
|
5.2. Порядок исследования При бактериологическом исследовании на холеру используют различные питательные среды: жидкие среды обогащения, щелочной агар, элективные дифференциально-диагностические среды и набор сред для идентификации. Применяют сухие среды производственного выпуска, имеющие номера госрегистрации и лицензии, или среды, консерванты, приготовленные по рецептуре и технологии, изложенной в разделе 7. Используемые для диагностики холеры питательные среды подлежат бактериологическому контролю в установленном порядке. Агаровые среды перед использованием должны быть тщательно подсушены. Посев делают так, чтобы получить рост в виде изолированных колоний. Все посевы инкубируют при температуре (37,0 ± 0,5) °С. Посевы исследуемого материала на всех этапах выращивают в 1%-й пептонной воде 6-8 ч, в пептонной воде с теллуритом калия – 12-18 ч, на щелочном агаре – не менее 14-16 ч, а на плотных элективных средах – 18-24 ч. Теллурит калия следует добавлять в 1%-ю пептонную воду с рН не ниже 8,3 ±0,1, до внесения исследуемого материала. Продолжительность хранения рабочего раствора теллурита калия (1:1000) – 7 дней, а питательных сред с теллуритом калия – не более 2-х суток при условии содержания их в холодильнике. 5.2.1. Исследование проб от больных и вибриононосителей, секционного материала (рис. 1) I этап Испражнения, рвотные массы больных, а также содержимое кишечника, желчного пузыря и суспензию кусочков слизистой тонкого кишечника трупа в объёме 0,5-1,0 мл засевают пипеткой в 50-100 мл накопительной среды, петлей - на щелочной агар и одну из элективных сред (СЭДХ, TCBS). При исследовании материала от больных с подозрением на заболевание холерой не допускается использование в качестве накопительной среды 1%-й пептонной воды с теллуритом калия. В случае поступления материала от больных с подозрением на холеру могут быть использованы ускоренные методы исследования: иммунолюминесцентный, иммобилизация и ПЦР со специфическими праймерами (см. раздел 6) на первом, втором и последующих этапах исследования. Материал от подозреваемых на вибриононосительство засевают в 50 мл среды накопления при индивидуальных анализах ив 100 мл – при групповых, объединяя в один флакон по 0,5-1,0 мл пробы не более чем от 5 человек. К групповым посевам прибегают в редких случаях при проведении массовых обследований на вибриононосительство. Материал, доставленный в 5 мл 1%-й пептонной воды, полностью используют для посева в 50 мл среды накопления. В случае поступления в лабораторию материала, забранного в 50 мл 1%-й пептонной воды во флаконе, и доставки его не позже 2-х ч после забора пробы, флакон помещают в термостат на 6 ч для накопления возбудителя. При доставке материала в более поздние сроки 5 мл его засевают в 50 мл 1%-й пептонной воды. В отдельных случаях, при бактериологическом исследовании материала от лиц, принимавших антибиотики, активные по отношению к возбудителю холеры, его засевают в 200-300 мл 1%-й пептонной воды (предпочтительно в широкогорлые колбы) и на 2 чашки щелочного агара так, чтобы получить рост в виде изолированных колоний. Посевы инкубируют при 37°С в течение 24 ч, производя последовательные высевы через 8-10 ч инкубации с поверхностного слоя среды на пластинки щелочного агара. Использование второй среды обогащения в этом варианте исследования нецелесообразно. II этап (через 6-8 ч от начала исследования) С первой среды накопления делают высев на щелочной агар и одну из элективных сред и в 5-8 мл второй среды накопления. Пересевы в жидкие и на плотные среды делают с поверхности жидкой среды большой бактериологической петлей диаметром 5 мм. При отрицательных результатах исследования нативного материала ускоренными методами их повторяют после 6 ч инкубации первой среды накопления. III этап (через 12-16 ч от начала исследования) Высев со второй среды накопления на щелочной агар. В случае необходимости ускорения хода анализа материала от больного, подозрительного на заболевание холерой, отбор колоний со щелочного агара, засеянного в начале исследования, можно начинать уже на этом этапе, в остальных случаях - на следующем. IV этап (через 18-24 ч от начала исследования) Отбор подозрительных на холерный вибрион колоний в посевах на плотные среды нативного материала, а также в высевах из 1-й и 2-й накопительных сред. а) Чашки с посевами просматривают в проходящем свете невооруженным глазом или с помощью лупы, а также (особенно в вечернее и ночное время) под стереоскопическим микроскопом в косо проходящем свете и отбирают подозрительные на вибрионы колонии для выделения и идентификации культуры. 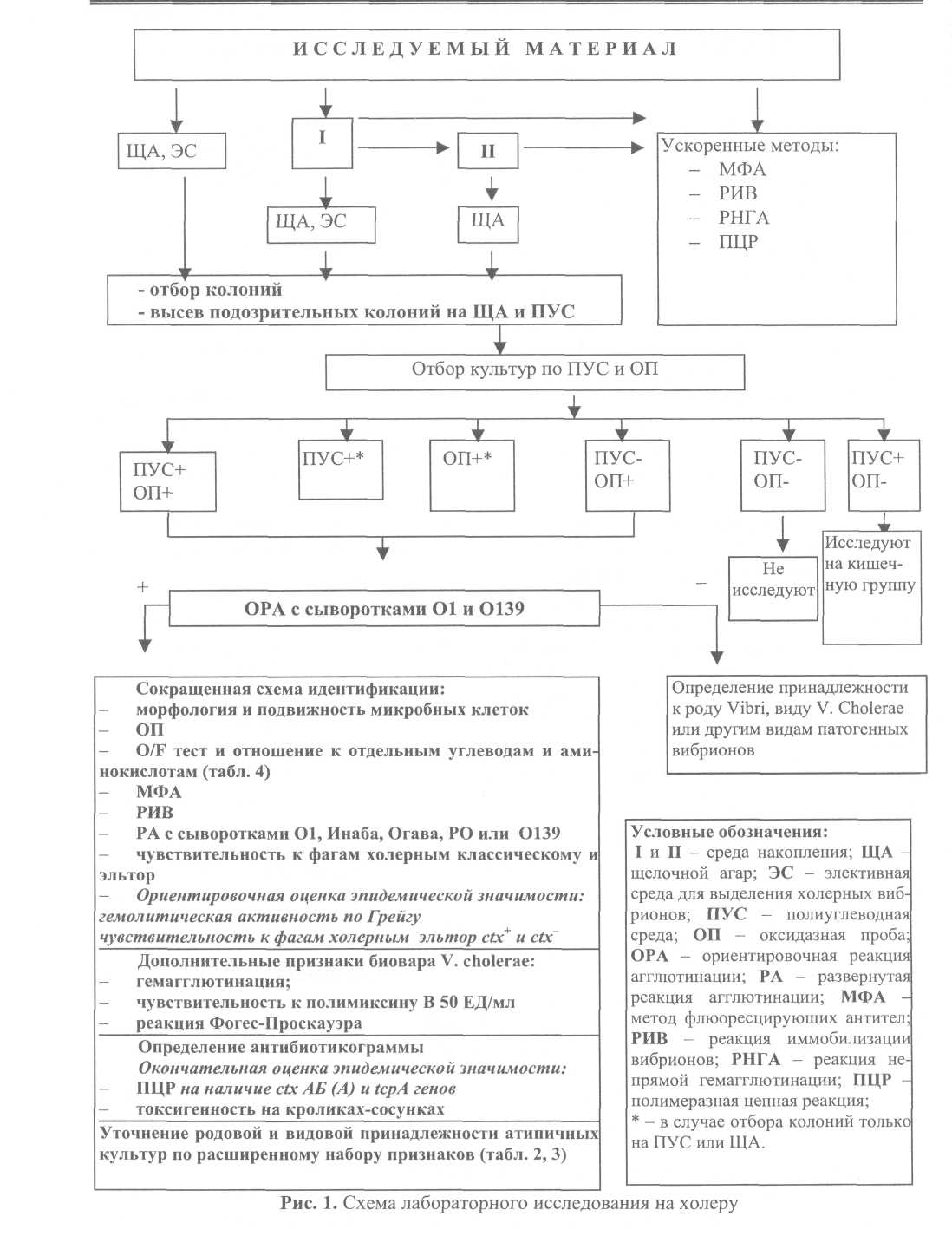 На щелочном агаре колонии холерных вибрионов 01 и 0139 серогрупп в типичной S-форме – круглые, гладкие, плоские, голубоватые, гомогенные, с ровными краями, прозрачные в проходящем свете и светло-серые с голубым или зеленоватым оттенком под стереоскопическим микроскопом в косо проходящем свете (прилож. 5). Колонии холерных вибрионов на элективных средах TCBS и СЭДХ имеют ярко-желтую окраску на зеленом или синем фоне среды, полупрозрачные. Размеры колоний на щелочном агаре через 10-12 ч инкубации обычно не превышают 1 мм, а к 18-24 ч достигают 2-3 мм в диаметре. Темпы формирования колоний холерных вибрионов на элективных средах несколько замедлены, поэтому просмотр посевов на СЭДХ или TCBS следует проводить не ранее чем через 18-20 ч инкубации, когда размеры их становятся близки к колониям, вырастающим на щелочном агаре. В отдельных случаях в посевах могут также встречаться атипичные колонии: мутные с плотным центром, пигментированные (коричневые или светло-желтые), мельчайшие коккоподобные, шероховатые. Следует иметь в виду, что состав и качество питательных сред оказывают влияние на величину и плотность колоний холерных вибрионов, а также на морфологию клеток. б) При отборе колоний можно использовать пробу на индофенолоксидазу с однокомпонентным реактивом (без альфа-нафтола) с индикаторными бумажками из набора СИБ-1 для идентификации вибрионов или – тест-системы ОКСИ-тест. С колониями, обнаруженными на элективных средах, пробу на оксидазу ставить не рекомендуется. в) Подозрительные колонии проверяют в слайд-агглютинации с сывороткой холерной 01 в разведении 1:50-1:100. При положительной реакции и достаточном количестве подозрительных колоний ставят слайд-агглютинацию с вариантоспецифическими сыворотками Инаба и Огава в том же разведении, приготавливают мазки для окраски по Граму и обработки флюоресцирующими иммуноглобулинами. При отрицательных результатах колонии, обнаруженные в посевах материала от больных, проверяют в слайд-агглютинации с холерными сыворотками 0139 и РО. Положительная ориентировочная реакция агглютинации с холерной 01 сывороткой в разведении 1:100 и вариантоспецифической в разведении 1:50 или положительная реакция с флюоресцирующими иммуноглобулинами в сочетании с морфологическими, культуральными признаками и специфической иммобилизацией позволяют выдать на соответствующем этапе предварительный ответ об обнаружении в исследуемом материале холерного вибриона 01, а в случае положительной реакции с сывороткой 0139 – холерного вибриона 0139 серогруппы. г) Подозрительные на вибрионы колонии, агглютинирующиеся и не агглютинирующиеся холерными 01 и 0139 сыворотками, отсевают на одну из полиуглеводных сред (лактозо-сахарозная, Ресселя, Клиглера, маннозо-сахарозная или др.) и (или) на сектор пластинки щелочного агара для выделения чистой культуры, ее идентификации и определения чувствительности к антибиотикам. V этап (через 24-36 ч от начала исследования) Отбор культур для идентификации На полиуглеводных средах отбирают культуры с типичными для вибрионов характером роста и изменениями: • на двууглеводных средах (лактозо-сахарозная, глюкозо-лактозная и Клиглер) наблюдается характерное для кислой реакции изменение цвета столбика при сохранении цвета скошенной части без образования газа, а также сероводорода, продуцируемого в среде Клиглера, отдельными штаммами за счет расщепления серосодержащихся компонентов; • в маннозо-сахарозной среде за счет ферментации обоих углеводов окрашиваются и столбик, и скошенная часть, а также в отдельных случаях улавливается образование сероводорода. Культуры, выросшие на щелочном агаре, проверяют на наличие индофенолоксидазы. Определяют морфологию микроорганизмов и чистоту отобранных культур, выросших на щелочном агаре и полиуглеводных средах, с помощью окрашенных по Граму мазков. Культуры, дающие характерные изменения на полиуглеводных средах и положительные в пробе на оксидазу, проверяют в ориентировочной слайд-агглютинации с холерными сыворотками 01 в разведении 1:100, РО, Инаба и Огава – в разведении 1:50. При отрицательных результатах с этими сыворотками ставят слайд-агглютинацию с холерной сывороткой 0139 серогруппы, используя ее в соответствии с инструкцией по применению. На основании положительных результатов агглютинации с сыворотками О1, Инаба или/ и Огава выдают предварительный положительный ответ о выделении из исследуемого материала культуры холерного вибриона 01 соответствующего серовара. Если выделенная культура реагирует с холерной сывороткой 0139 при отрицательных результатах с сыворотками О1 серогруппы, выдают ответ о выделении холерного вибриона 0139 серогруппы. Проводят идентификацию выделенных на полиуглеводных средах или на щелочном агаре агглютинирующихся и не агглютинирующихся сыворотками 01, РО или 0139 серогрупп оксидазопозитивных культур по сокращенной или полной схеме, не агглютинирующихся холерными 01, РО и 0139 сыворотками - до определения вида с учетом основных родовых признаков. VI этап (через 36-48 ч от начала исследования) Учитывают результаты идентификации и выдают окончательный ответ о выделении культуры холерного вибриона соответствующей серогруппы и биовара. Для холерных вибрионов О1 эпидемическую значимость ориентировочно оценивают по тестам гемолитической активности и чувствительности к фагам эльтор ctx+ и ctx, а в специализированных учреждениях - окончательно по результатам ПЦР или генетического зондирования на присутствие в геноме выделенной культуры ctx AB (А) гена, а также токсигенности на модели кроликов-сосунков. Эпидемическую значимость холерных вибрионов 0139 серогруппы определяют по тем же тестам, кроме чувствительности к фагам эльтор ctx+ и ctx. К окончанию этого этапа исследования должна быть определена антибиотикочувствительность выделенной культуры. При выделении от больного или вибриононосителя культуры холерного вибриона, не агглютинирующейся холерными сыворотками 01 и 0139, выдают ответ о выделении холерных вибрионов не О1 и не 0139. При наличии вибрионных агглютинирующих диагностических сывороток определяют принадлежность к другим серогруппам (02-083). Идентификацию культур, агглютинирующихся РО-сывороткой, см. в разделе 5.3. 5.2.2. Исследование объектов окружающей среды Схема анализа объектов окружающей среды отличается от схемы исследования материала от больных только на I этапе, II-VI этапы изложены выше. а) Вода поверхностных водоемов и водопроводная В зависимости от времени доставки пробы возможны следующие варианты посевов с целью первичного накопления вибрионов: к исследуемой воде добавляют раствор основного пептона до 1%-й концентрации, определяют рН, в случае необходимости подщелачивают 10%-м раствором едкого натрия до рН 8,4 ±0,1. Время инкубации в 1-й среде накопления – 8-10 ч. Объем 2-й среды накопления - 10 мл; время инкубации в среде без теллурита калия – 6 ч, а с теллуритом калия – 18-20 ч; в исследуемую воду добавляют раствор основного пептона до 1%-й концентрации и теллурит калия из рабочего разведения 1:1000 до концентрации 1:100000 или 1:200 000 в соответствии с данными проверки. Устанавливают рН 8,4 ± 0,1. Время инкубации 18-24 ч; вторая среда накопления – 10 мл среды без теллурита калия, время инкубации 6-8 ч; исследование проб воды можно также проводить с использованием в качестве ингибитора посторонней флоры моющего средства «Прогресс» в концентрации 0,1-0,2%; после добавления основного раствора пептона до 1%-й концентрации и установления щелочной реакции пробы сохраняют при комнатной температуре (не выше 25°С) до утра (первая среда накопления). В начале следующего дня засевают 5 мл поверхностного слоя в 100 мл 1%-й пептонной воды (вторая среда накопления) и делают высев на щелочной агар; высев со второй среды накопления производят через 6-8 ч инкубации; воду фильтруют через мембранные фильтры №2 или 3, смыв с которых сеют в накопительную среду и на агаровые пластинки. Из смыва с фильтра можно делать мазки для окраски флюоресцирующими холерными иммуноглобулинами, а также ставить РНГА, ПЦР со специфическими праймерами. При интенсивном бактериальном загрязнении проб можно использовать III среду накопления. б) Хозяйственно-бытовые сточные воды Сточные воды, доставленные в объеме 1 л, фильтруют через бумажный или матерчатый фильтр для освобождения от механических примесей (при необходимости). После добавления к пробам основного раствора пептона до 1%-й концентрации устанавливают рН 8,4 ± 0,1 и инкубируют в объемах по 500 мл 8-10 ч (1 среда накопления) или с добавлением теллурита калия 1:100000 (1:200000) – 18-24 ч. При заборе сточных вод марлевыми тампонами последние помещают в широкогорлые колбы или банки с накопительной средой (500 мл) и далее исследуют, как указано выше. в) Гидробионты Лягушку непосредственно перед исследованием обездвиживают уколом иглы в спинной мозг и фиксируют на препаровальной доске брюшком вверх. Поверхность брюшка обрабатывают спиртом и ножницами делают медиальный разрез. Желчный пузырь отсекают от печени, разрезают и делают отпечаток на пластинке щелочного агара. Остатки желчи вместе с желчным пузырем помещают во флаконы с 50-100 мл 1%-й пептонной воды. Содержимое желудка засевают в 1%-ю пептонную воду, а внутренней поверхностью стенки делают отпечатки на агаровые пластинки. Посев кишечника делают таким же образом, отсекая несколько петель в верхнем, среднем и нижнем отделах кишечника. У крупных рыб в том же порядке засевают в накопительную среду содержимое желчного пузыря, желудка, кишечника и жабры. Мелких рыб (мальков) измельчают ножницами по 10-20 экз. в одной пробе и делают посев суспензии петлей на чашку с агаром и в 1%-ю пептонную воду. Дафний, циклопов и других рачков, так же, как и фитопланктон, растирают в ступке и засевают петлей в 1%-ю пептонную воду. У раков исследуют кишечник и жабры, делая посев содержимого в среду накопления и слизистой стенки - отпечатком на агаровую среду. г) Пищевые продукты Безалкогольные напитки исследуют тем же методом, что и воду. Молоко в количестве 5 мл сеют в 50-100 мл среды накопления или к 0,5 л молока добавляют основной раствор пептона до 1%-й концентрации его в молоке. Другие молочные продукты (кефир, сметану, творог, мороженое и т.д.) в количестве 5-10 мл засевают в 1%-ю пептонную воду. Из твердых пищевых продуктов берут навеску 25 г, растирают в стерильной ступке с 2-3 г кварцевого песка и физиологическим раствором, а затем переносят в 125 мл накопительной среды и петлей на агаровые среды. Масло засевают в жидкую среду накопления в количестве 5-10 г, размягчив его в термостате, или делают посев смыва с поверхности его кусков.После посева продукта устанавливают рН среды 8,4 ± 0,1. д) Смывы с объектов внешней среды и мух засевают в 1 %-ю пептонную воду и исследуют по обычной схеме. 5.2.3. Порядок исследования в условиях односменной работы лаборатории При осуществлении эпиднадзора за холерой исследование материала от обследуемых контингентов может выполняться в следующих вариантах. а) В качестве 1-й или 2-й среды накопления используют 1%-ю пептонную воду (рН 8,4 ± 0,1) с теллуритом калия в конечной концентрации 1:100000-1:200000 в соответствии с результатами его контроля. Вопрос выбора транспортной среды и порядок исследования решают в зависимости от разницы времени с момента взятия пробы до поступления ее в лабораторию. Примерная схема забора материала от больных в 1%-ю пептонную воду и порядок дальнейшего его исследования на холеру с учетом различного времени доставки в лабораторию представлены в табл. 1. В течение рабочей недели для отбора проб используют 1%-ю пептонную воду без теллурита калия в объеме 5-10 мл, во флаконах или пробирках (транспортная среда). 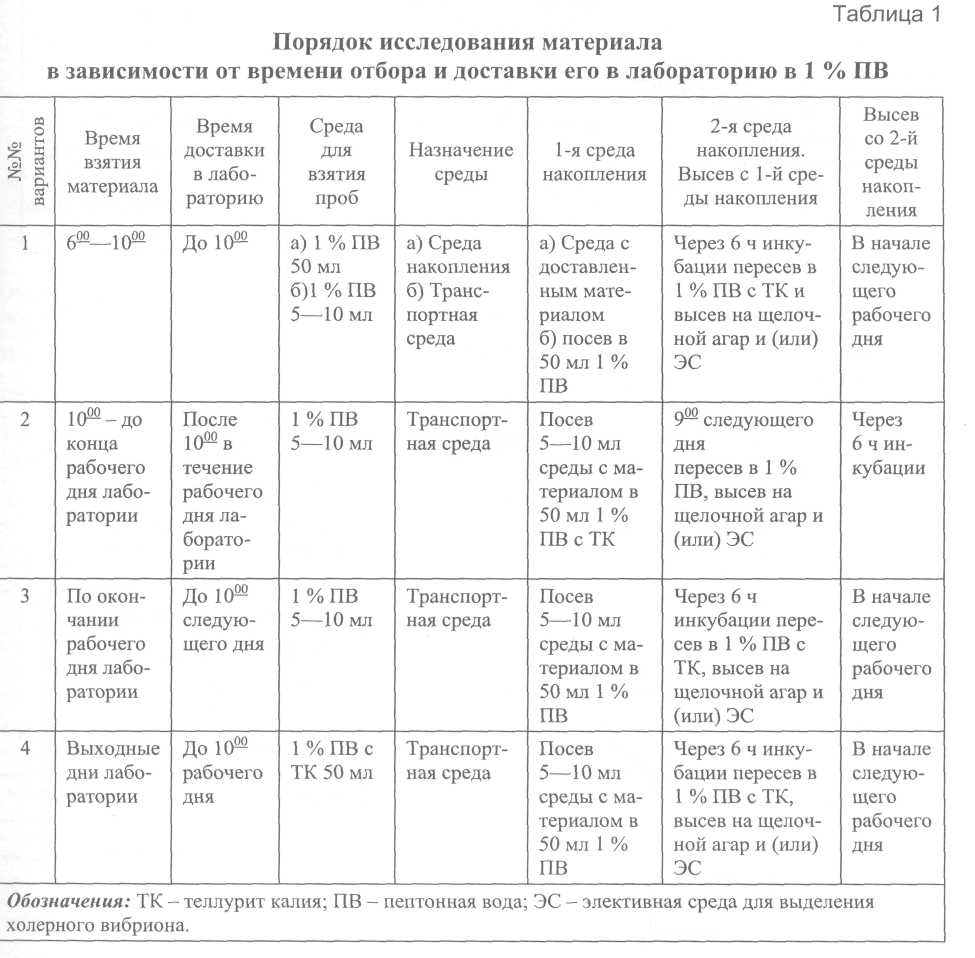 Пробы до отправки в лабораторию сохраняют при комнатной температуре (24,0 ± 1,0)°С в биксах, ящике, шкафу и т. д. в специально выделенной комнате, закрывающейся на замок. Продолжительность сохранения проб в указанных условиях – до 24 ч. В случаях, когда температура в помещении превышает 25°С, материал следует брать в 1%-ю пептонную воду с теллуритом калия. В лаборатории в пробы во флаконах доливают соответствующую среду накопления до 50 мл, а из пробирок все 5-10 мл транспортной среды с материалом переносят пипеткой в 50 мл среды накопления. На период выходного дня лаборатории в порядке исключения допускается следующий вариант: забор материала в 50 мл 1%-й пептонной воды с теллуритом калия (транспортная среда); допускаемое время сохранения проб до начала исследования при температуре (20,0 ± 1,0)°С – 60 ч, (27,0 ± 3,0)°С – 48 ч. В лаборатории 5-10 мл поверхностного слоя среды с материалом переносят в 50 мл 1 %-й пептонной воды без теллурита калия (1 среда накопления) и делают высев на чашку щелочного агара с дальнейшим исследованием по изложенной схеме. б) Пептонную воду повышенной щелочности в качестве накопительной среды рекомендуется использовать только на первом этапе исследования с удлинением срока инкубации ее до 18-24 ч. Основной раствор пептона и 1%-ю пептонную воду с рН 9,5 ± 0,5 можно готовить впрок по общепринятой методике с подщелачиванием до необходимого уровня и последующей стерилизацией при температуре 120°С – 20 мин. Для подшелачивания пептонной воды используют 10-20% NaOH. |
