Лабораторная диагностика холеры. МУК 4.2.2218-07 Лабораторная диагностика холеры. Методические указания мук 221807
 Скачать 2.25 Mb. Скачать 2.25 Mb.
|
|
B. Для контроля на наличие антагонистов сульфаниламидных препаратов и триметоприма рекомендуется использовать штамм Enterococcus faecalis ATCC 29212. При величине МПК триметоприма/сульфаметоксазола < 0,5/9,5 мкг/мл среду следует признать удовлетворительной по качеству. Определение величины МПК антибиотиков (или диаметров зон ингибиции роста) в отношении референтных штаммов в целях контроля качества среды проводят в соответствии с описанными выше методами. Категорическим требованием является использование антибиотиков с предварительно известной активностью. 6.7.3. Контроль качества питательных сред для определения антибиотикочувствительности Качество питательной среды является одним из критических параметров для корректной оценки антибиотикочувствительности. Важнейшими показателями качества питательной среды являются концентрации двухвалентных катионов Са2+ и Mg2+, влияющих на активность аминогликозидных антибиотиков и тетрациклинов, а также тимина и тимидина, являющихся антагонистами сульфаниламидных препаратов и три-метоприма. Перед использованием в экспериментах по оценке антибиотикорезистентности каждая новая партия среды (Mueller-Hinton или какой-либо другой) должна пройти контроль качества в соответствии с описанным ниже методом. A. Определение рН среды Определение рН среды проводят после автоклавирования и охлаждения до комнатной температуры 25 °С, приемлемый диапазон 7,2—7,4. При величине рН среды, выходящей за указанные пределы, возможны существенные изменения в величине МПК. Б. Контроль катионного состава Для получения воспроизводимых результатов оценки антибиотикорезистентности питательная среда должна содержать Са2+ 20-25 мг/л и Mg2+ 10,0-12,5 мг/л. Наиболее доступным интегральным методом оценки качества сред (как жидких, так и агаризованных) является сопоставление экспериментально полученной величины МПК референтных штаммов микроорганизмов с этим показателем, приведенным в их паспортной характеристике. Наиболее подходящим штаммом для оценки качества жидких и плотных питательных сред, предназначенных для изучения антибиотикорезистентности, является штамм Pseudomonas aeruginosa ATCC 27853. Среду следует считать удовлетворительной по качеству, если величина МПК гентамицина находится в пределах 0,5-2,0 мкг/мл. Выбор гентамицина для контроля качества связан с тем, что аминогликозидные антибиотики наиболее чувствительны к колебаниям концентрации двухвалентных катионов. B. Для контроля на наличие антагонистов сульфаниламидных препаратов и триметоприма рекомендуется использовать штамм Enterococcus faecalis ATCC 29212. При величине МПК триметоприма/сульфаметоксазола < 0,5/9,5 мкг/мл среду следует признать удовлетворительной по качеству. Определение величины МПК антибиотиков (или диаметров зон ингибиции роста) в отношении референтных штаммов в целях контроля качества среды проводят в соответствии с описанными выше методами. Категорическим требованием является использование антибиотиков с предварительно известной активностью. 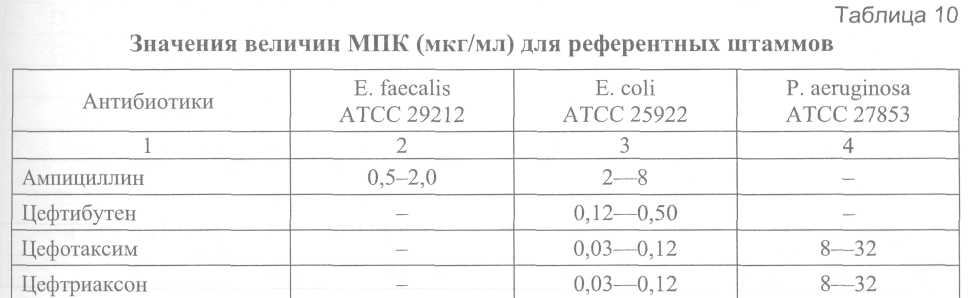 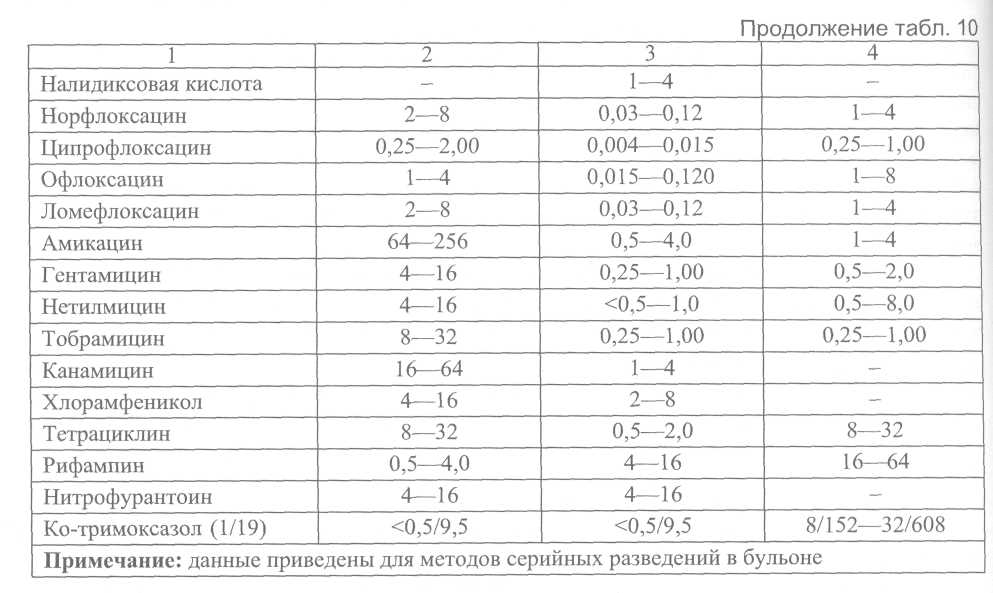 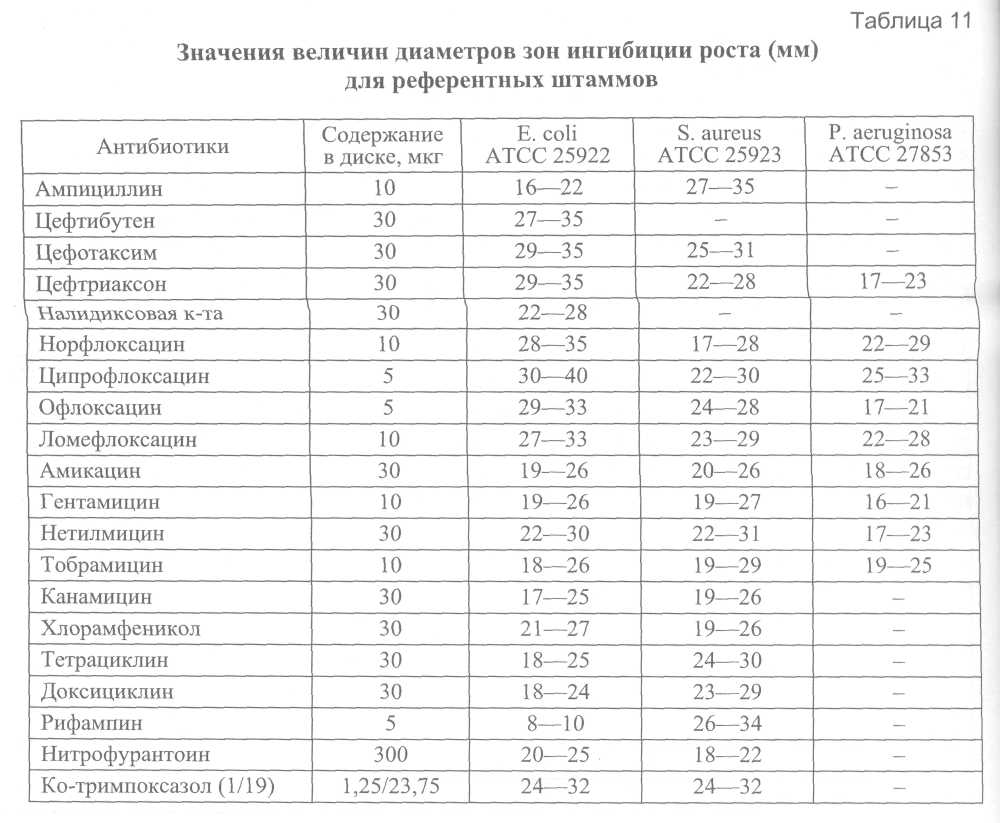 7. Питательные среды, реактивы, консерванты. Порядок контроля качества питательных сред 7.1. Питательные среды Транспортные среды: 1%-я пептонная вода, рН 8,5 ±0,1 без ингибиторов роста сопутствующей флоры и с теллуритом калия (см. среды обогащения); 2%-й раствор поваренной соли: 20 г хлорида натрия и 0,1 г едкого натрия растворяют в 1 л дистиллированной воды; жидкость пропускают через бумажный фильтр, разливают по 10 мл в пробирки и стерилизуют в автоклаве 20 мин при 0,7 атм. Среды обогащения а) Основной раствор пептона готовят по следующей прописи: Пептон сухой - 100,0 Натрия хлорид - 50,0 Калия нитрат - 10,0 Натрия карбонат - 25,0 Дистиллированная вода - 1 л рН 8,4 ±0,1. В холодную дистиллированную воду погружают пептон, хлорид и карбонат натрия. Смесь кипятят при постоянном помешивании до полного растворения пептона, не допуская его пригорания, затем добавляют нитрат калия. Проверяют реакцию среды, если нужно, рН доводят до 8,5 ±0,1. Раствор фильтруют через миткалевый или бумажный фильтр, разливают в посуду и стерилизуют в автоклаве 20 мин при 1 атм. Основной раствор пептона сохраняется до 2 лет. б) 1 %-я пептонная вода. Для получения 1%-й пептонной воды концентрированный раствор разводят в 10 раз дистиллированной водой. После установления рН 8,5 ±0,1 разливают в пробирки или во флаконы и стерилизуют 20 мин при давлении 0,7 атм. Можно готовить 1%-ю пептонную воду и непосредственно из отдельных компонентов, взяв навески в 10 раз меньше указанных в рецепте основного пептона. Технология приготовления такая же, как и основного пептона. в) Пептонная вода с теллуритом калия. В 1 %-ю пептонную воду (рН 8,5 ±0,1) после автоклавирования добавляют теллурит калия в конечном разведении 1:100 000 или 1:200000. Предварительно готовят рабочий 0,1%-й раствор теллурита калия(1:1000). Срок хранения рабочих растворов 7 дней. Плотные среды для выделения холерных вибрионов Щелочной мясо-пептонный агар: Мясная вода - 1 л Пептон - 10,0 Натрия хлорид - 5,0 Агар-агар - 20,0 рН 8,0 ± 0,2. В мясную воду вносят пептон и хлорид натрия. Смесь перемешивают и подщелачивают 20%-м раствором едкого натра до рН 8,3 ±0,1. Затем добавляют агар-агар и содержимое помещают в автоклав для варки среды в начале текучим паром в течение 30-40 мин, а затем при 1 атм 20 мин. Если мясо-пептонный агар варят на плите, среду кипятят до полного расплавления агар-агара при постоянном помешивании. Для получения прозрачной агаровой среды ее после варки с целью отстоя на 2-3 ч оставляют в автоклаве или помещают в термостатную комнату при температуре (43 ± 2)°С, лучше время отстоя продлить до 18-20 ч. Отстоявшийся агар осторожно, не взбалтывая, сливают с осадка на плотный ватно-марлевый фильтр. В фильтрате уточняют реакцию среды, если требуется, подкисляют её, но подщелачивать агар на данном этапе не рекомендуется во избежание выпадения осадка при стерилизации готовой среды. Профильтрованный агар разливают в посуду и стерилизуют при 1,0 атм 20 мин. Элективные среды Рекомендуется использовать питательную среду для выделения холерных вибрионов элективно-дифференциальную, сухую (СЭДХ). Среда обладает выраженными элективными свойствами, обеспечивая ингибицию сопутствующей микрофлоры (энтеробактерий, протея, кокков и др.) и практически не влияет на рост вибрионов. Холерные вибрионы 01 и не О1 групп через 12-18 ч формируют на этих средах плоские, прозрачные колонии желтого цвета за счет ферментации сахарозы, диаметром 1,0-2,0 мм; V.parahaemolyticus – мелкие, голубоватые (цвета среды) с уплотненным центром; V.alqinolyticus – крупные, желтые; колонии Pseudomonas, Aeromonas – голубые, Enterobacteriaceae – очень мелкие, плотные или полупрозрачные, иногда окрашены в желтый цвет; колонии протея, как правило, не роятся. Среды для идентификации вибрионов а) Среды с углеводами для отбора колоний: Среда Ресселя Пептон - 5,0 Натрия хлорид - 5,0 Лактоза -10,0 Глюкоза -1,0 Агар-агар -10,0 Индикатор Андреде - 40 мл Вода дистиллированная - 1 л рН 7,3 ±0,1. Среду варят, фильтруют, разливают по 5-7 мл в стерильные пробирки и стерилизуют при давлении 0,5 атм 20 мин. Готовую среду после стерилизации скашивают так, чтобы получить столбик и косяк. Среда светлая. Среду можно готовить на 1,0-1,3%-м питательном агаре, добавляя к нему в соответствующих концентрациях углеводы и индикатор Андреде. Лактозо-сахарозная среда Готовится как и среда Ресселя, но вместо глюкозы берут сахарозу в том же количестве. Среда Клиглера: 1,5-1,7%-й мясопептонный агар или другой слабощелочной питательный агар - 1 л Лактоза -10,0 Глюкоза - 1,0 2%-й раствор серно-кислого закисного железа - 10,0 мл 0,8%-й раствор тиосульфата натрия - 10,0 мл 0,4%-й раствор сульфата натрия - 10,0 мл 1%-й раствор фенолового красного - 24,0 мл рН 7,3 ±0,1. Вначале в расплавленном питательном агаре (рН 7,7 ± 0,1) растворяют углеводы, затем к нему добавляют свежеприготовленные растворы железа и солей натрия согласно прописи среды (индикатор на сероводород). Кроме того, для регистрации кислото-образования добавляют индикатор феноловый красный. Среду варят, фильтруют, разливают по 5-7 мл в стерильные пробирки, стерилизуют 20 мин при давлении 0,5 атм и скашивают по типу среды Ресселя; рН готовой среды 7,3 ±0,1; цвет красный. Маннозо-сахарозная среда 1,5%-й питательный агар - 1 л Манноза -1,0 Сахароза - 10,0 Серно-кислое железо (FeSC^) - 0,2 Гипосульфит натрия (Na2SO3 • 5Н2О) - 0,08 Сульфит натрия (Na2SO3) - 0,4 0,2%-й феноловый красный - 10,0 После расплавления рН среды довести до 8,0, разлить в пробирки по 5-7 мл и стерилизовать при 0,7 атм 15 мин. Готовую среду после стерилизации скашивают так, чтобы получить столбик и косяк. б) Среды для идентификации. Среды Гисса К 100 мл 1%-й пептонной воды (рН 7,3 ±0,1) без селитры добавляют 0,5-1,0% необходимого углевода или спирта (L-арабиноза, D-манноза, D-сахароза, D-маннит, L-инозит, D-глюкоза, растворимый крахмал и др.) и 1% индикатора Андреде или 0,1 мл 1,6%-го раствора бромтимолового синего. Среды разливают в стерильные пробирки с поплавками и стерилизуют при 0,5 атм 20 мин; среду с L-арабинозой следует стерилизовать в течение 20 мин при 0,1-0,2 атм. Для приготовления сред Гисса можно применять только перечисленные изомеры углеводов. Готовые среды Гисса с индикатором Андреде светлые, при кислотообразовании краснеют. Среды с бромтимоловым синим зеленого цвета с травянистым оттенком, при кислой реакции - жёлтого цвета, при щелочной - синего. Среда Хъю-Лейфсона Пептон - 2,0 Натрия хлорид - 5,0 Двузамещённый фосфат калия - 0,3 Глюкоза -10,0 Бромтимоловый синий - 0,03 Агар-агар - 3,0 Дистиллированная вода - 1 л рН 7,1 ±0,1. К воде добавляют пептон, натрия хлорид и агар-агар. Смесь подогревают до расплавления агара, затем вносят фосфат калия и глюкозу, продолжают кипятить 2-3 мин. Смесь подщелачивают 20%-м раствором едкого натрия до рН 7,4 ±0,1, доводят объем среды до первоначального и добавляют 3 мл 1%-го водного раствора бромтимолового синего. Затем среду фильтруют через ватно-марлевый фильтр, разливают по 4-5 мл в стерильные пробирки и стерилизуют при давлении 0,5 атм 20 мин. Цвет среды до стерилизации синий, а после автоклавирования травянисто-зеленый, рН 7,1 ±0,1. При кислой реакции среда желтеет. Бульон Кларка Пептон - 5,0 Глюкоза - 5,0 Двузамещенный фосфат калия - 5,0 Дистиллированная вода - 1 л Смесь ингредиентов нагревают до полного их растворения, затем фильтруют через бумажный фильтр и разливают по 5 мл в стерильные пробирки. Бульон стерилизуют при давлении 0,5 атм 20 мин. Среда Кодама. В 1%-ю пептонную воду добавляют 0,5% растворимого крахмала. Среду разливают в стерильные пробирки и стерилизуют 20 мин под давлением 0,5 атм. Для оценки результатов расщепления крахмала используют реактив Люголя. Среда с желатиной. К мясопептонному бульону или бульону Хоттингера прибавляют мелко нарезанную желатину из расчета 10,0-15,0 г на 100 мл (летом концентрацию желатины увеличивают до 20%). Желатине дают набухать в течение 30 мин и затем растворяют при медленном нагревании в водяной бане при температуре (45,0 ± 5,0)°С. Устанавливают рН 7,1 ± 0,1, прибавляя к расплавленной желатине 10%-й раствор двууглекислого натрия. При более щелочной реакции желатина застывает плохо, а иногда и совсем не застывает. В 1 л растворенной желатины вносят для просветления два взбитых с небольшим количеством дистиллированной воды яичных белка. Смесь перемешивают и прогревают текучим паром в течение 20 мин до полного свертывания белка и просветления среды. Затем среду фильтруют в горячем состоянии через бумажный или ватно-марлевый фильтр с большой поверхностью. Среду, разлитую по 5-8 мл в пробирки, стерилизуют при давлении 0,5 атм 20 мин. После стерилизации среду охлаждают путем погружения пробирок в холодную воду в строго вертикальном положении, чтобы верхняя часть столбика при застывании оставалась совершенно ровной. Среда для определения декарбоксилаз и дигидролаз аминокислот Пептон - 5,0 Дрожжевой экстракт - 25,0 (сухой 3,0) Глюкоза - 1,0 Натрия хлорид - 5,0 Натрия карбонат - 0,1 Бромтимоловый синий (0,1 %-й раствор в 20 %-м спирте) - 45,0 (0,045 г сухого) Аминокислота - 10,0—20,0 Дистиллированная вода - 1 л рН 6,4 ±0,1. Все ингредиенты по прописи вышеуказанной среды растворяют при нагревании, устанавливают рН 6,4 ± 0,1, затем добавляют соответствующий индикатор и делят среду на 4 равные части. В одну часть аминокислоты не добавляют, эта порция служит контролем. В остальные порции вносят соответственно: в первую – 1 % лизина, во вторую – 1 % орнитина, в третью – 1% аргинина. Аминокислоты должны быть в L-форме, если имеются D-аминокислоты, то добавляют 2%, т. к. микроорганизмы активны только в отношении L-форм. После добавления аминокислот перед стерилизацией в случае необходимости реакцию среды исправляют 0,1%-м раствором соляной кислоты. Среду разливают по 1-2 мл в химически чистые стерильные пробирки и стерилизуют при давлении 0,1-0,2 атм 20 мин. Небольшое количество флокулята в средах не имеет значения. Пептонно-дрожжевая среда имеет травянисто-зеленый цвет, при кислой реакции среда желтеет, при щелочной - синеет. Мясо-пептонный бульон: мясная вода с 1 % сухого пептона и 0,85 % поваренной соли. Смесь кипятят до полного растворения пептона и соли, устанавливают нужную реакцию среды, стерилизуют при 0,7 атм 20 мин. 7.2. Реактивы а) Для определения образования индола Реактив Эрлиха: Парадиметиламинобензальдегид - 1,0 г Этиловый спирт - 95,0 мл Концентрированная соляная кислота - 20,0 мл Альдегид растворяют в спирте, затем добавляют кислоту, смешивают, хранят в темном месте. Полоски фильтрованной бумаги пропитывают насыщенным раствором щавелевой кислоты и высушивают в термостате. б) Для выявления образования сероводорода Полоски фильтровальной бумаги пропитывают раствором уксусно-кислого свинца. Подсушивают на воздухе. Полоски индикаторных бумажек на индол и сероводород помещают под пробку пробирки с засеянной культурой. В случае образования индола полоска краснеет, а при образовании сероводорода полоска чернеет. в) Для определения нитратредуктазы Готовят отдельно два раствора. Первый – путем растворения при нагревании в фарфоровой ступке в 20 мл дистиллированной воды 0,2 мг альфа-нафтиламина (C10H7NH2). Жидкость осторожно вливают в 150 мл 12%-го раствора уксусной кислоты. Второй – 0,5 г сульфаниловой кислоты (C6H4NH2SO3H) растворяют в 150 мл 12%-й уксусной кислоты. Затем оба раствора сливают в темную склянку с хорошо притертой пробкой. Реактив Грисса должен быть бесцветным, если он розовеет, то им не пользуются. Сложность приготовления реактива Грисса, дефицитность и токсичность входящих в него компонентов (в частности, альфа-нафтиламина) ограничивают возможности его применения. Этих недостатков лишен метод с использованием риванолового реактива, представляющего собой смесь равных объемов 0,1%-го раствора риванола в дистиллированной воде и 12%-го раствора соляной кислоты. В случае положительной реакции культура испытуемого штамма, выращенная в бульоне или 1%-й пептонной воде с 0,1%-м KNO3, окрашивается в красный цвет. г) Для определения β-галактозидазной активности приготавливают М/75 раствор орто-нитрафенил - β-Д-галактопиранозида (ОНФГ): ОНФГ - 80 мг Дистиллированная вода - 75 мл Фосфатный буфер - 5 мл Растворяют в дистиллированной воде при 37°С ОНФГ, затем добавляют раствор однозамещенного фосфорно-кислого натрия (NaH2PO4 × Н2О). Доводят рН до 7,0. Раствор должен быть бесцветным - хранят при температуре -4°С. Перед использованием раствор выдерживают в течение нескольких минут до растворения фосфата, который на холоде кристаллизируется. 7.3. Консерванты для сохранения дефибринированной крови а) Консервант с борной кислотой Борная кислота - 40,0 г Глюкоза - 50,0 г 0,9 %-й раствор натрия хлорида - до 1 л. Стерилизуют на водяной бане или текучим паром при 100°С - по 20 мин в течение 3-х дней. Соединяют 100 мл дефибринированной крови барана с 15 мл консерванта с борной кислотой. б) Консервант Алсевера Сахароза (или глюкоза) - 20,5 Хлористый натрий - 8,0 Цитрат натрия - 4,2 Дистиллированна вода - до 1,0 л рН - 6,1 доводится 10 %-м раствором лимонной кислоты. Стерилизуют на водяной бане или текучим паром при температуре 100°С по 20 мин в течение 3-х дней. Консервант Алсевера и дефибринированную кровь соединяют поровну. Консервированную кровь хранят при температуре (4 ± 1) °С. |
