Лабораторная диагностика холеры. МУК 4.2.2218-07 Лабораторная диагностика холеры. Методические указания мук 221807
 Скачать 2.25 Mb. Скачать 2.25 Mb.
|
|
7.4. Порядок контроля качества питательных сред Питательные среды, консерванты, ингибиторы посторонней микрофлоры, используемые в диагностике холеры, подлежат обязательной проверке в соответствии с действующими инструктивно-методическими документами. Бактериологический контроль качества плотных и жидких питательных сред могут проводить лаборатории противочумных и других учреждений, имеющие разрешение на работу с возбудителем холеры, применяя для контроля тест-штаммы Vibrio cholerae P-l (145) и Vibrio cholerae eltor M-878, а также лаборатории особо опасных инфекций учреждений, осуществляющих государственный санитарно-эпидемиологический надзор, с использованием тест-штамма авирулентного холерного вибриона не 01 серогруппы Р-9741 в порядке, определяемом действующими методическими указаниями по контролю питательных сред. Бактериологическому контролю подлежит каждая серия сухой среды производственного выпуска, имеющая номер государственной регистрации, лицензии на ее производство и соответствующий срок годности, а также среды лабораторного изготовления. На контроль направляют часть общего объема среды, предназначенного для проведения исследований, в количестве 200 мл агара и 100 мл основного раствора пептона производственного выпуска и в двойном объеме для серий лабораторного изготовления. В направлении следует указать название среды, предприятие-изготовитель, номер серии и срок годности сухой среды, дату контролируемой варки. Транспортируемые образцы должны быть надежно упакованы, флаконы с жидкой средой закрыты резиновыми пробками. Оптимальный срок проверки питательной среды 10-14 дней после приготовления. При положительном результате контроля пробы соответствующая серия сухой среды считается пригодной к использованию. Последующий контроль этой серии среды осуществляется ежегодно, а также при изменении условий приготовления сухой среды, независимо от времени предыдущей проверки. Если при первом контроле среда оказалась непригодной, необходим повторный бактериологический контроль этой же серии сухой среды, при этом на контроль необходимо направлять образец новой варки и навеску сухой среды этой же серии. При получении отрицательного результата повторного контроля среды, приготовленной на месте, и положительного бактериологического контроля образца этой же серии сухой среды, сваренного в лаборатории контролирующего учреждения, следует считать пригодной данную серию сухой питательной среды и принять меры к выяснению и устранению ошибки в технологии местного изготовления. При получении отрицательного результата на образец сухой среды данной серии направляют рекламацию в адрес учреждения-изготовителя и ГИСК им. Л.А. Тарасевича. Сроки хранения щелочного агара и основного раствора пептона производственного выпуска (сухая среда и приготовленные из неё образцы) указаны в инструкции предприятия-изготовителя по применению среды. Для сред лабораторного изготовления определены следующие сроки хранения: для щелочного агара - 6 месяцев с момента изготовления и первичного контроля, по истечении этого срока допускается переконтроль и продление срока годности ещё на 3 месяца; для основного раствора пептона – 2 года с контролем качества среды после приготовления, затем спустя 1,0—1,5 года хранения. Срок хранения 1%-й пептонной воды при герметичной упаковке (резиновые пробки и металлические колпачки) – 2 месяца, а после переконтроля возможно продление срока хранения на 1 месяц. Питательные среды, готовые к употреблению, хранят в тёмном прохладном месте (6-20°С), не допуская перепада температур больше чем на 5°С. Подъем и снижение температур губительно действуют на биологические свойства сред. Щелочной агар и основной пептон, контролируемые авирулентным тест-штаммом холерного вибриона, подлежат периодической перепроверке по согласованию с территориальными лабораториями и противочумными учреждениями на базе последних вирулентными тест-штаммами. Ежегодному контролю в территориальном противочумном учреждении подлежит также теллурит калия. 8. Методы серологической диагностики Серологические методы исследования, как правило, имеют дополнительное значение, и лишь в отдельных случаях при проведении оперативного и ретроспективного эпидемиологического анализа их результаты могут быть решающими. Для серологической диагностики холеры используют иммунологические реакции, выявляющие в сыворотке крови больных, переболевших и вибриононосителей, а также вакцинированных специфические антитела: агглютинины, антитоксины и вибриоцидные антитела. У больных холерой на 5-7-й день от начала заболевания появляются агглютинины, вибриоцидные антитела и антитоксины. Целесообразно исследовать парные сыворотки с интервалом в 7-10 дней. Первая проба должна быть взята на 5—7-й день для оперативной диагностики и вторая – через 7-10 дней и более – для ретроспективной. Кровь для серологических исследований берут из вены, а при отсутствии такой возможности – из пальца. Из вены берут 1-5 мл крови, после свертывания сгусток отслаивают от стенки пробирки стерильной стеклянной палочкой или платиновой петлей. Пробирки сохраняют в холодильнике и транспортируют в лабораторию охлажденными (в термосе, сумке-холодильнике и др.). В лаборатории сыворотку инактивируют при температуре (56,0 ± 0,5)°С 30 мин. Если кровь забирают в день постановки реакции, пробирки со свернувшейся кровью необходимо центрифугировать 10-15 мин при 3000 об./мин. При отсутствии возможности исследовать сыворотку немедленно, ее сохраняют в ампулах при температуре (4,0 ± 0,5)°С. Кровь из пальца берут в объеме 0,4 мл и вносят в стерильный пенициллиновый флакон или пробирку с 1,6 мл 0,9%-го раствора хлорида натрия (1:5). 8.1. Определение аглютининов в сыворотке крови A. Обнаружение противохолерных антител методом развернутой реакции агглютинации. Исследуемую сыворотку разводят 1 %-й пептонной водой рН 7,5 ±0,1 в объеме 1 мл от 1:10 до 1:640. В качестве антигена используют 3-часовую бульон ную культуру, выделенную в данном очаге, или исследуют в 3-х рядах с культурами холерных вибрионов (сероваров Огава, Инаба и 0139 серогруппы). В пробирку с раститрованной сывороткой вносят по 1 капле культуры-антигена и ставят на 1 ч в термостат, затем до утра в холодильник при температуре (4,0 ± 0,5)°С, после чего отмечают результаты. Реакция сопровождается контролями антигена и сыворотки. При определении титра реакции учитывают разведения с агглютинацией на 3-4 креста. Результат исследования сыворотки больного при реакции агглютинации в разведении 1:40 и выше считается ориентировочно положительным. Диагностическое значение имеет не менее чем 4-кратное нарастание титров антител. Б. Реакция непрямой гемагглютинации (РНГА) с диагностикумом эритро-цитарным холерным антигенным Для выявления полных антител в сыворотке крови предназначена РНГА. Это достаточно специфичная и чувствительная двухкомпонентная реакция. По чувствительности значительно превосходит реакцию агглютинации. Необходимые ингредиенты, методика постановки в макро- и микрообъемах изложены в наставлении к диагностикуму эритроцитарному холерному антигенному. Результат исследования сыворотки больного в разведении 1:40 и выше считается ориентировочно положительным. Диагностическое значение имеет не менее чем 4-кратное нарастание титров антител. B. Реакция нейтрализации антигена (РНАг) Для выявления антител в сыворотке крови с использованием диагностикума эритроцитарного холерного иммуноглобулинового служит РНАг. Реакция нейтрализации антигена – высокоспецифическая трехкомпонентная реакция. Ее принцип заключается в специфической нейтрализации добавляемого антигена как полными, так и неполными антителами, которые появляются ранее других. Необходимые ингредиенты, методика постановки в макро- и микрообъемах изложены в инструкциях по применению к диагностикуму эритроцитарному холерному иммуноглобулиновому. При использовании системы реакций РНГА и РНАг отпадает необходимость в постановке контроля специфичности с каждой исследуемой сывороткой, т. к. эти две реакции взаимно контролируют полученные результаты. Результат исследования сыворотки больного в РНАг в разведении 1:50 (1:80) и выше считается ориентировочно положительным. Диагностическое значение имеет не менее чем 4-кратное нарастание титров антител при исследовании парных сывороток в РНГА и РНАг. 8.2. Определение вибриоцидных антител в сыворотке крови (РВА) Вибриоцидные антитела в крови больных обнаруживаются и достигают максимальных значений 10-4-10-8 к 10-12 дню. Принцип метода во всех его вариантах заключается в том, что в присутствии вибриоцидных антител не происходит размножение холерных вибрионов. При проведении серологических исследований в очаге, обусловленном возбудителем холеры определенного серовара, в реакции используют один штамм соответствующего серовара, при отсутствии этих данных – два штамма обоих сероваров. Материалы и оборудование исследуемые сыворотки, инактивированные прогреванием 30 мин при температуре (56,0 ± 0,5)°С; сухой комплемент или свежеполученная сыворотка морской свинки в разведении 1:20; 0,9%-й раствор хлорида натрия рН 7,2 ± 0,1; штаммы холерных вибрионов сероваров Огава и Инаба, типичные в S-форме, не чувствительные к комплементу; чашки Петри со щелочным агаром; лоток со льдом; • термостат на (37,0 ± 1,0) °С. Методика постановки реакции Комплемент, разведенный 0,9%-м раствором хлорида натрия 1:20, разливают в два ряда пробирок по 0,9 мл. В первую пробирку вносят 0,1 мл исследуемой сыворотки и после тщательного перемешивания последовательно переносят по 0,1 мл до разведения 10-10, получая десятикратные разведения сыворотки в объеме 0,9 мл. Титрацию сыворотки проводят на льду, который помещают в любую емкость. Из односуточной агаровой культуры холерного вибриона готовят взвесь в 0,9%-м растворе хлорида натрия, содержащего в 1 мл 1-2 × 104 м.к. Стерильной градуированной пипеткой полученную взвесь по 0,1 мл вносят в опытные пробирки с раститрованной сывороткой. Необходимы следующие контроли: а) контроль комплемента (0,9 мл комплемента и 0,1 мл культуры); б) контроль сыворотки (0,8 мл 0,9%-го раствора хлорида натрия, 0,1 мл сыворотки и 0,1 мл культуры); в) контроль культуры (0,9 мл 0,9%-го раствора хлорида натрия и 0,1 мл культуры). Штатив с пробирками на 1 ч помещают в водяную баню или термостат при температуре (37,0 ± 0,5)°С, сделав предварительно высев из пробирки контроля культуры на 2 пластинки щелочного агара для определения фактической концентрации живых вибрионов в опытной суспензии (контроль разведения). Через 1 ч штатив вновь ставят на лед и из каждой пробирки отдельной стерильной пипеткой 0,1 мл культуры высевают на чашку с щелочным агаром рН 7,0 ±0,1. Посев равномерно распределяют по поверхности чашки покачиванием или шпателем. Чашки помещают на 18-24 ч в термостат при температуре (37,0 ± 0,5)°С, после чего подсчитывают количество выросших колоний. В посевах из контрольных пробирок с культурой должно вырастать количество колоний, близкое к контролю разведения. Вибриоцидным титром считают максимальное разведение сыворотки, которое вызывает гибель не менее чем 50% клеток холерного вибриона, что выявляется при посеве на агаровые пластинки в чашки Петри по сравнению с количеством выросших колоний из пробирки контроля комплемента. Пример вычисления: при посеве из опытных пробирок с разведением сыворотки 10-1; 10-2; 10-3; 10-4; 10-5; 10-6; 10-7 и т. д. на чашках соответственно выросло 0; 0; 5; 10; 15; 30; 38 и т. д. колоний. При высеве из пробирки контроля комплемента также после часовой инкубации при температуре (37,0 ± 0,5)°С выросло 36 колоний, 50% от этого числа будет составлять 18. Из 5-й пробирки выросло 15 колоний, т. е. меньше 50% от количества колоний в контроле (18), в следующей – 30, т. е. более 50% этого же показателя. Разведение сыворотки в 5-й пробирке составляет 10-5, следовательно, вибрио-цидный титр в данном примере будет составлять 10-5. Определение вибриоцидных антител (ВА) в сыворотке крови на основе ферментации углеводов Об отсутствии или наличии ВА судят по ферментации сахарозы, регистрируемой с помощью индикатора. Материалы и оборудование: инактивированная сыворотка крови; штаммы холерного вибриона серовара Огава и Инаба; комплемент, разведенный 1:20 1%-й пептонной водой, содержащей 1% сахарозы и 1% индикатора Андреде; • термостат на (37,0 ± 1) °С. Методика постановки реакции Комплемент, разведенный 1:20 1%-й пептонной водой с сахарозой и индикатором Андреде разливают в пробирки по 0,45 мл. В первую пробирку добавляют 0,05 мл исследуемой сыворотки и после тщательного перемешивания переносят 0,05 мл смеси во вторую пробирку, из второй в третью и т. д. (до разведения 10-5-10-9). Готовят суспензию 18-20-часовой агаровой культуры холерного вибриона и разводят 1 %-й пептонной водой до концентрации 103 м.к./мл. Во все пробирки вносят по 0,45 мл суспензии и помещают в термостат. Постановку реакции сопровождают следующими контролями: 0,45 мл 1%-й пептонной воды, содержащей 1% сахарозы и 1% индикатора Андреде + 0,05 мл исследуемой сыворотки + 0,45 мл взвеси культуры – контроль сыворотки; 0,45 мл комплемента с сахарозой и индикатором + 0,45 мл культуры – контроль комплемента; 0,45 мл 1%-й пептонной воды с сахарозой и индикатором + 0,45 мл культуры – контроль культуры; 0,45 мл 1%-й пептонной воды с сахарозой и индикатором + 0,05 мл исследуемой сыворотки - контроль стерильности сыворотки. Через 5-6 ч проводят учет реакции. При этом в контроле (кроме контроля стерильности сыворотки) цвет содержимого пробирок должен перейти в красный или розовый. Изменение цвета индикатора в пробирках рабочего ряда, связанное с ферментацией сахарозы размножившимися вибрионами, свидетельствует об отсутствии вибриоцидных антител в исследуемой сыворотке. За вибриоцидный титр принимают то наибольшее разведение сыворотки, при котором цвет содержимого пробирок остается неизмененным или интенсивность его значительно отличается от окраски контрольных проб. Результат выражают в виде десятичного логарифма разведения сыворотки, взятого с обратным знаком. Примечание. Для постановки РВА при холере, обусловленной холерным вибрионом 0139 серогруппы, не может быть использован выделенный в очаге штамм в связи с возможной чувствительностью его к комплементу. В этих случаях рекомендуется предложенный специалистами Ростовского НИПЧИ, ctx клон холерного вибриона 0139, направленный на депонирование в Государственную коллекцию патогенных бактерий «Микроб» (РосНИПЧИ «Микроб»). 8.3. Определение токсиннейтрализующих антител в сыворотке крови Для выявления токсиннейтрализующих антител в сыворотке крови больных холерой и вибриононосителей предназначена РНГА с эритроцитарным холерным энтеро-токсическим диагностикумом (ЭХЭД), у которых инфицирование обусловлено холерными вибрионами 01 и 0139 серогрупп. Токсиннейтрализующие антитела появляются на 5-7-й день болезни, достигая максимума на 14-21-й день, затем их титр постепенно снижается, но сохраняется дольше других антител. Иммуноглобулины к холерному токсину, в сравнении с вибриоцидными и другими специфическими холерными антителами, дольше циркулируют в сыворотке крови после перенесенной инфекции (до 8-10 и более месяцев). Условно положительным титром РНГА с ЭХЭД следует считать 1:160 и выше. Целесообразно исследовать парные сыворотки. Результат РНГА с ЭХЭД позволяет сделать заключение о токсигенности (эпиде-мичности) циркулирующего в очаге штамма холерного вибриона, в том числе и без выделения культуры.   Приложение 3 (обязательное) Укладка для отбора материала от больного с подозрением на холеру для больничного учреждения неинфекционного профиля, станций скорой и неотложной помощи, поликлиник, СКО, СКП, ПСКП Банки широкогорлые с крышками или притертыми пробками, емкостью не менее 100 мл , 2 шт. Контейнеры 100-200 мл с завинчивающейся крышкой стерильные, поли пропиленовые 2 шт. Стеклянные трубки с резиновой грушей для переноса жидкого исследуемого материала в контейнеры 2 шт. Контейнеры для испражнений 30 мл с ложкой, полипропиленовые 2 шт. Пробирки с ватными тампонами или алюминиевыми петлями (стерильные) 2 шт. Клеенка медицинская подкладная 1 м Полиэтиленовые пакеты 5 шт. Салфетки марлевые 5 шт. Направление на анализ (бланк) „ 3 шт. Лейкопластырь 1 уп. Карандаш простой 1 шт. Карандаш по стеклу 1 шт. Бикс (металлический контейнер) 1 шт. Инструкция по забору материала 1 шт. Хлорамин в пакетах по 30 г, рассчитанный на приготовление 1 литра 3 %-го раствора 1 шт. Хлорная известь сухая в пакете из расчета 200 г на 1 кг выделений 1 шт. Перчатки резиновые 2 пары Емкость эмалированная 10 л 1 шт. Пептонная вода 1%-я во флаконах по 50 мл, закрытых резиновыми пробка ми и завальцованных металлическими колпачками 4 шт. Флаконы с 50 мл 0,9%-го раствора хлорида натрия, закрытые резиновыми пробками и завальцованные металлическими колпачками 2 шт. Приложение 4 (обязательное) Укладка для забора проб из объектов окружающей среды на холеру Ящик тарный на 20 гнезд 1 шт. Ящик металлический - укладка 1 шт. Бутылки 0,5 л с ватно-марлевыми (и резиновыми) пробками, с пергамент ными бумажными колпачками 20 шт. Флаконы с 50 мл 0,9%-го раствора натрия хлорида, закрытые резиновыми пробками и завальцованные металлическими колпачками 2 шт. Спирт 96° 100 мл Вата 100 г Карандаш по стеклу, 2 шт. Карандаш простой 1 шт. Бумага писчая 10 листов Направление на анализ (бланк) 10 шт. Бумага копировальная 5 листов Пинцет 1шт. Банка 0,5 л с матерчатыми салфетками (15 шт.) для отбора проб сточных вод 1 шт. Термометр до 50°С 1 шт. Бумага индикаторная для определения рН (1-12) 1 упак. Банка с притертой крышкой с ватными тампонами 1 шт. Пробирки с тампонами для взятия смывов 20 шт. Штатив на 20 гнезд 1 шт. Батометр 1 шт. Шпагат - мотки по 5, 10 и 30 м 45 м Хлорамин в пакетах по 30 г, рассчитанный на приготовление 1 литра 3%-го раствора 2 шт. Емкость на 1 л для приготовления 3%-го хлорамина 1 шт. Пакеты полиэтиленовые 5 шт. Халат медицинский и шапочка 2 шт. Перчатки резиновые 2 пары Фартук и нарукавники клеенчатые 1 шт. Приложение 5 (рекомендуемое) Способ отбора колоний вибрионов с помощью стереоскопического микроскопа в косо проходящем свете Принцип метода заключается в том, что при просмотре колоний различных микробов под малым увеличением микроскопа или лупы при освещении их пучком света, косо падающим на поверхность агара, колонии приобретают способность светиться и кажутся окрашенными. К стереоскопическому микроскопу МБС-2 или МБС-1 приспосабливают устройство для получения узкого пучка света и зеркало от микроскопа на подвижном шарнире для освещения чашки снизу под углом 45-50°. Чашки с посевами просматривают после 12-18 ч инкубации. При величине угла падения луча света к поверхности агара в 40-50° колонии вибрионов по своей окраске заметно отличаются от других микроорганизмов. Цвет колоний, выросших на щелочном агаре, при косом освещении: 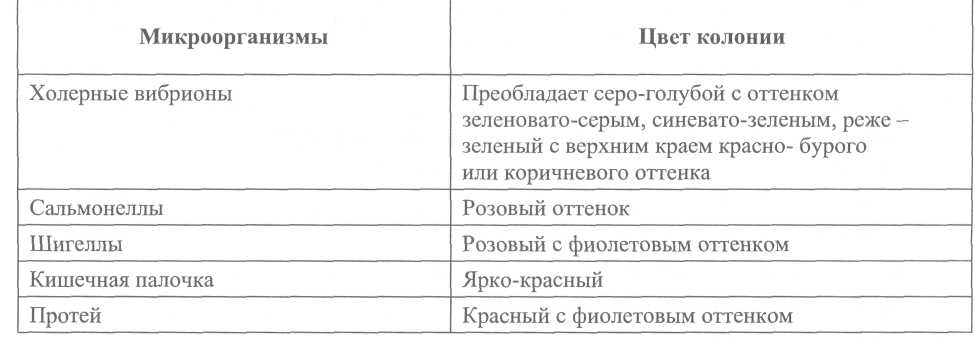 Приспособления для просмотра колоний в косо проходящем свете. 1. Столик стереоскопического микроскопа МБС-1 или МБС-2 заменяют специальным приспособлением для освещения чашки снизу под углом 45-50°. Источником света служит осветитель от микроскопа, на который надевают кожух с отверстием диаметром 5 мм против спирали лампочки для получения узкого пучка света. Узкий пучок света направляют в центр вогнутого зеркала, которое перемещается на подвижном шарнире поворотом винта в зависимости от необходимости угла падения света. Угол вычисляют по соотношению расстояния от зеркала до чашки, которое меняется произвольно, и расстояния от чашки до поверхности стола, остающегося неизменным. Для удобства исследования осветитель и зеркало можно вмонтировать в ящик со стеклянной крышкой, на которую помещают чашку с посевом. Это дает возможность быстро находить нужный угол падения света, передвигая зеркало поворотом винта по вмонтированной шкале. 2. Приспособление, смонтированное из основных узлов стереоскопического микроскопа БМС-1 и прибора для счета колоний. Из раструба верхней крышки прибора для подсчета колоний удалить оба стекла вместе с упорным кольцом и снять верхнюю крышку. Из скобы передней панели вывинтить вертикальную ось, после чего убрать диск со светофильтрами. Освободить два винта, прикрепляющие патрон лампочки освещения к кронштейну на задней панели. В крышку снизу вставить вертикальную штангу от узла лупы с таким расчетом, чтобы в рабочем положении прибора муфта с прижимным винтом оказалась на дне под кронштейном импульсного счетчика. В муфту зажать держатель с угловыми губками (из комплекта лабораторного штатива), предварительно укороченный до ПО мм. Держателем закрепить патрон с лампочкой в вертикальном положении. Крышку фиксировать винтами на своем обычном месте. Штатив микроскопа МБС-1 вместе с бинокулярной насадкой отсоединить от столика и установить непосредственно на корпус прибора для счета колоний так, чтобы 3 сферических ножки основания штатива охватили раструб крышки прибора, а окно основания было обращено к наблюдателю. Подлежащие к просмотру чашки с посевами устанавливают над открытым окном. Нужную освещенность и угол падения света находят изменением положения лампы, которое достигается поворотом штанги, после чего последнюю фиксируют цанговым зажимом.  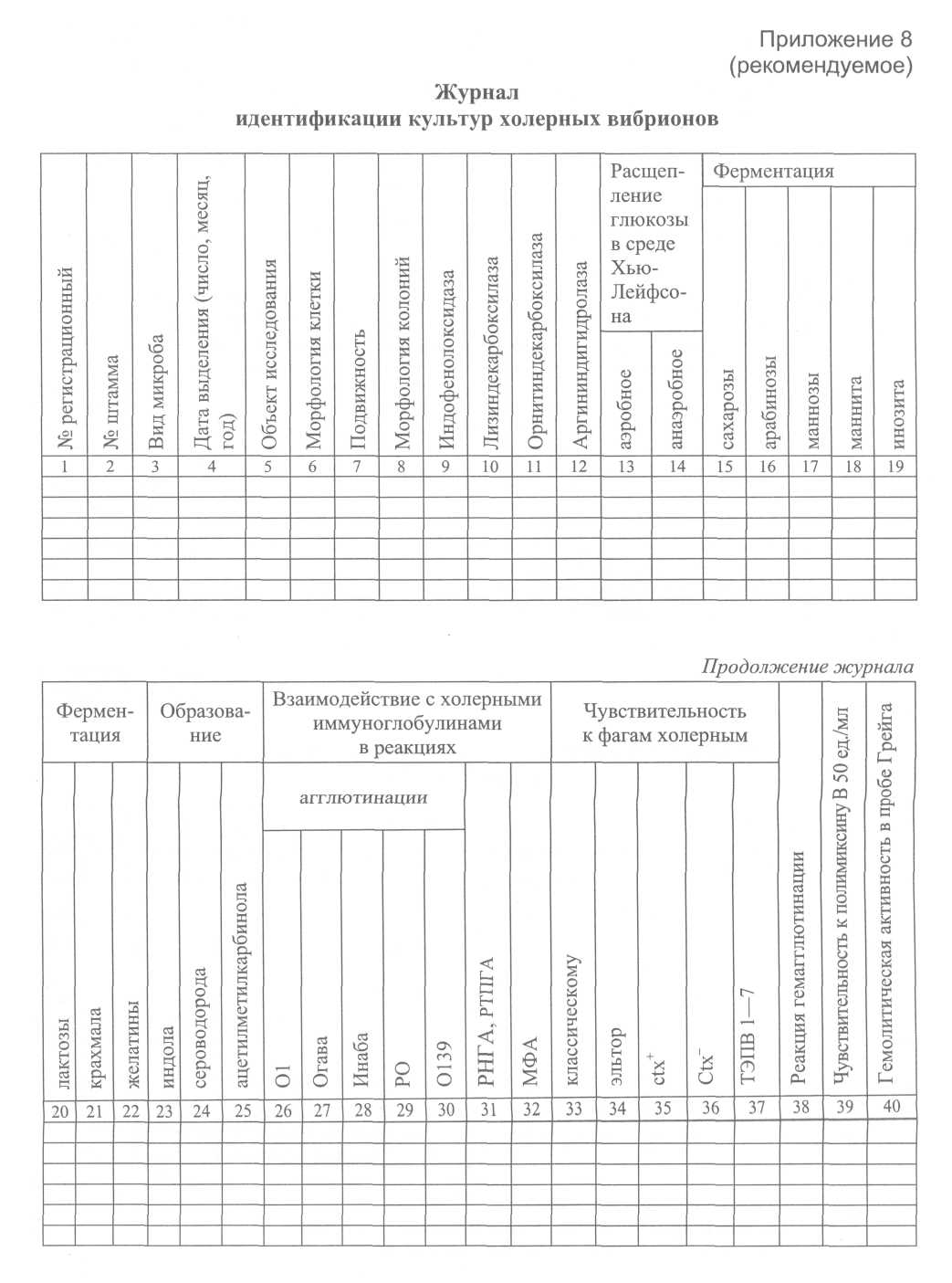    |
