Лабораторная диагностика холеры. МУК 4.2.2218-07 Лабораторная диагностика холеры. Методические указания мук 221807
 Скачать 2.25 Mb. Скачать 2.25 Mb.
|
|
6.7. Оценка антибиотикочувствительности Для оценки антибиотикочувствительности холерного вибриона используют диско-диффузионный метод и методы серийных разведений в агаре и бульоне. Методы и критерии оценки антибиотикочувствительности холерного вибриона разработаны и стандартизованы для указанных методов и ограниченного перечня антибиотиков: ампициллина, тетрациклина, доксициклина, ко-тримоксазола, хлорамфеникола. Для оценки чувствительности холерного вибриона к другим антибиотикам, прежде всего к фторхинолонам, временно предлагается использовать методы и критерии оценки, разработанные для микроорганизмов семейства Enterobacteriaceae. В пользу возможности такого допущения говорит тот факт, что методы и критерии, разработанные для перечисленных выше антибиотиков, полностью совпадают с таковыми для семейства Enterobacteriaceae. В международной практике основной средой, используемой во всех методах оценки антибиотикочувствительности, является среда Mueller-Hinton (агар и бульон). Рассматриваемые в последующих разделах критерии величины МПК, позволяющие отнести исследуемые микроорганизмы к одной из категорий: «чувствительные», «устойчивые» или «промежуточные», разработаны именно для среды Mueller-Hinton. Следует признать возможность использования для оценки антибиотикочувствительности и других сред (например, АГВ) в том случае, если они удовлетворяют требованиям, изложенным в разделе 6.7.3. Контроль качества питательных сред для определения антибиотикочувствительности с учётом соответствующих требований проводят в лабораториях учреждений, имеющих необходимые для этого референтные штаммы микроорганизмов. Указанные учреждения ежегодно информируют курируемые лаборатории о возможности использования для этих целей конкретных питательных сред с указанием номера серий и даты выпуска или снабжают их готовыми партиями сред. 6.7.1. Методы серийных разведений Постановка методов серийных разведений для оценки антибиотикочувствительности включает следующие этапы: приготовление растворов антибиотиков; приготовление питательных сред с антибиотиками; приготовление суспензии исследуемого микроорганизма, ее стандартизация и инокуляция; инкубация; учет и интерпретация результатов. Общим и крайне важным этапом для всех методов серийных разведений является приготовление растворов антибиотиков. Приготовление растворов антибиотиков Различают основные растворы антибиотиков – пригодные для хранения и рабочие – используемые «ex tempore» для приготовления питательных сред. Для приготовления основных растворов антибиотиков предпочтительно использовать субстанции препаратов с известной активностью, допускается использование готовых инъекционных лекарственных форм препаратов, оральные лекарственные формы не пригодны. Для приготовления навесок антибиотиков необходимо использовать аналитические весы или другие равного класса точности. Основные растворы антибиотиков готовят в концентрации 1000,0 мкг/мл и выше. Навески антибиотиков для приготовления основных растворов готовят с учетом их активности. В связи с тем, что антибактериальные препараты существенно различаются по растворимости, в ряде случаев возникает необходимость использовать разные вещества для первичной солюбилизации препаратов (растворители) и для доведения их до заданной концентрации (разбавители). В тех случаях, когда растворители и разбавители являются разными веществами, для солюбилизации антибиотика необходимо использовать минимально возможное количество растворителя. Отличные от воды растворители и разбавители для отдельных антибиотиков приведены в табл. 7. Основные растворы необходимо хранить при температуре не выше -20°С (сроки хранения отдельных антибиотиков при этой температуре существенно различаются). Оптимальными условиями для хранения основных растворов антибиотиков является температура -60°С и ниже, длительность не более 6 месяцев. 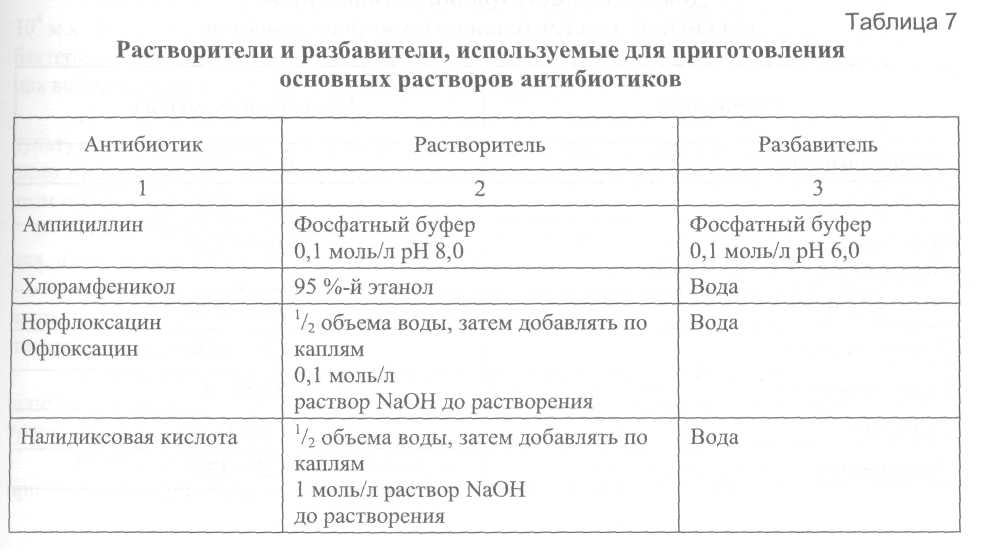  С целью предотвращения конденсации влаги извлеченные из морозильника флаконы с основными растворами антибиотиков, прежде чем открыть, необходимо выдержать до достижения ими комнатной температуры. Размороженные основные растворы должны быть использованы для приготовления рабочих растворов, их повторное замораживание не допускается. Из основных растворов антибиотиков готовят рабочие двукратные концентрации. За основу берется конечная концентрация антибиотика в питательной среде, равная 1,0 мкг/мл (более высокие - 2, 4, 8 и т. д.; более низкие - 0,5; 0,25; 0,125 и т. д.). Реальные концентрации рабочих растворов должны учитывать фактор разбавления раствора антибиотика в питательной среде (обычно 1 : 10 в плотной среде и 1 : 2 в жидкой). Для приготовления рабочих растворов используется дистиллированная вода (метод серийных разведений в агаре) или жидкая питательная среда (метод серийных разведений в бульоне). Примерный диапазон концентраций антибиотиков, используемых при оценке чувствительности к отдельным препаратам, приведен в табл. 8. В зависимости от целей исследования возможно использовать и иные диапазоны концентраций. 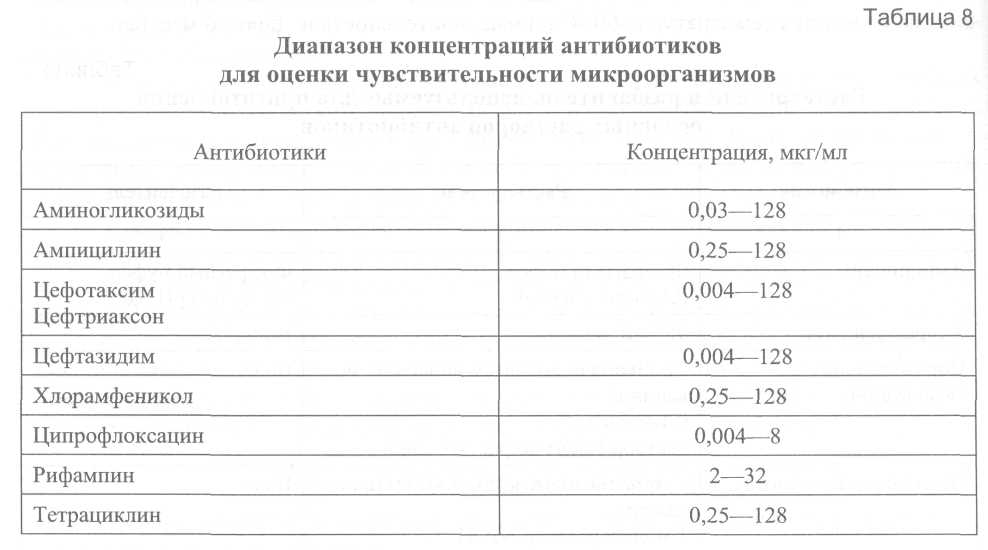 6.7.1.1. Методы серийных разведений в агаре Приготовление питательных сред с антибиотиками Сухая агаризованная питательная среда растворяется и автоклавируется в соответствии с инструкцией изготовителя. После автоклавирования колбы с питательной средой помещаются на водяную баню при 48-50°С, где выдерживаются до достижения указанной температуры, после чего в них асептически вносят рабочие растворы антибиотиков (1 часть рабочего раствора антибиотика на 9 частей расплавленного агара). Затем среду тщательно перемешивают и разливают по чашкам Петри, толщина слоя питательной среды должна быть 3-4 мм. Чашки оставляют при комнатной температуре для застывания. Приготовленные указанным образом чашки Петри предпочтительнее использовать немедленно. Допускается хранение в запаянных полиэтиленовых пакетах при 4-8°С в течение 5 суток. При этом необходимо иметь в виду, что некоторые беталактамные антибиотики, особенно при низких концентрациях, не выдерживают даже указанный срок хранения. Параллельно с чашками Петри, содержащими растворы антибиотиков, для контроля роста готовят чашки Петри без антибиотиков. Приготовление суспензии исследуемого микроорганизма, ее стандартизация и инокуляция. Инкубация Для приготовления суспензии используют 3-4-часовую бульонную или суточную агаровую культуру холерного вибриона. Для получения бульонной культуры отбирают одну или несколько четко изолированных колоний, легким прикосновением петли к центру колонии переносят незначительное количество материала в пробирку с 4,0-5,0 мл жидкой неселективной среды, например МПБ. Инкубируют при 37°С. Приблизительно через 3-4 ч инкубации мутность бульонной культуры соответствует 1-2 × 10 м.к./мл. Для получения суточных агаровых культур можно использовать только четко изолированные колонии, выросшие на неселективных питательных средах. Взвесь агаровых культур в концентрации 109 м.к./мл готовят на стерильном изотоническом растворе или бульонной среде по ОСО ГИСК им. Л.А. Тарасевича – ОСО-42-25-59-86П. Конечная посевная доза на поверхности питательной среды должна составлять 104 м.к. Поскольку коммерческие инокуляторы, штампы-репликаторы или стандартная бактериологическая петля диаметром 3,0 мм переносят 1-2 мкл жидкости, концентрация вибрионов в суспензии для инокуляции должна быть 107 м.к./мл. Для получения суспензии требуемой концентрации (107 м.к./мл) бульонную культуру следует развести в 10 раз, а взвесь агаровой – в 100 раз. Суспензию необходимо инокулировать на поверхность агара в течение 15 мин после приготовления, при этом образуется пятно диаметром 5-8 мм. После инокуляции чашки оставляют при комнатной температуре для подсыхания, далее переворачивают и инкубируют при 37°С в течение 16-20 ч. Для контроля качества приготовления суспензий периодически рекомендуется проводить подсчет реальных колониеобразующих единиц путем высева на плотную питательную среду. Важнейшим требованием контроля качества постановки метода является высев использованной для инокуляции суспензии на плотную неселективную среду для контроля чистоты культуры. Результат оценки антибиотикочувствительности имеет смысл учитывать только при подтверждении чистоты культуры. Учет результатов проводят, поместив чашку на темную, не отражающую поверхность. За МПК принимают концентрацию, вызвавшую полную ингибицию видимого роста. Для дифференцировки нежного роста от налета, оставшегося после инокулята, в ряде случаев целесообразно использовать увеличение. Появление единственной колонии на чашке с концентрацией на 1 разведение выше, чем явная МПК, можно не учитывать. При росте нескольких колоний или образовании «прозоны» исследование необходимо повторить, обратив особое внимание на чистоту культуры. В ряде случаев целесообразно получить субкультуру из единичных колоний, выросших на чашках с концентрацией антибиотика выше, чем явная МПК, и провести ее идентификацию. Интерпретацию результатов проводят с учётом данных, приведенных в табл. 9, с отнесением штаммов к «чувствительным», «устойчивым» или «промежуточным». 6.7.1.2. Метод серийных разведений в бульоне Наиболее распространен следующий способ постановки метода серийных разведений в бульоне. Жидкая питательная среда, прошедшая предварительный контроль качества, готовится в соответствии с инструкцией изготовителя. Рабочие растворы антибиотиков готовят в асептических условиях по схеме, аналогичной для метода серийных разведений в агаре, но в жидкой питательной среде и в концентрациях, вдвое превышающих заданные, затем разливают по 1,0 мл в пробирки. Суспензию исследуемого микроорганизма готовят из бульонной или взвеси агаровой культуры путем разведения в жидкой питательной среде до концентрации 106 м.к./мл и вносят по 1,0 мл в пробирки с растворами антибиотиков. Таким образом, конечная концентрация микроорганизмов в инкубационной среде будет равна 5 × 105 м.к./мл. Посевы инкубируют при 37°С в течение 16-20 ч. Учет результатов проводят визуально или спектрофотометрически. За МПК принимают минимальную концентрацию, обеспечивающую полное подавление видимого роста. При постановке метода необходимо предусмотреть следующие контроли: чистоту суспензии микроорганизма, использованной для инокуляции, путем высева на неселективные среды; рост культуры в среде без антибиотика. Качество постановки метода контролируется периодически с использованием референтных штаммов. 6.7.2. Диско-диффузионный метод Постановка диско-диффузионного метода включает следующие этапы: приготовление питательных сред; приготовление суспензии микроорганизма и инокуляция; наложение дисков и инкубация; учет и интерпретация результатов. Для получения достоверных результатов при постановке диско-диффузионного метода необходимо жестко соблюдать правила хранения и использования коммерческих дисков, в противном случае содержание в них антибиотиков может упасть ниже допустимого уровня (прежде всего в результате увлажнения) еще до истечения срока годности. Диски должны храниться при температуре 4-8°С, плотно укупоренными, для дополнительной гарантии защиты от увлажнения во флаконах коммерческих дисков содержится силикагель. Флаконы с дисками следует извлекать из холодильника за 1 ч до начала работы и выдерживать закрытыми при комнатной температуре, что обеспечит выравнивание температуры дисков и окружающей среды и, соответственно, предотвратит образование конденсата влаги после открывания флаконов. Приготовление чашек с питательной средой К качеству питательных сред для постановки диско-диффузионного метода выдвигаются те же требования, что и к плотным питательным средам для постановки метода серийных разведений в агаре, соответственно используются и те же методы контроля качества. Плотную питательную среду готовят в соответствии с инструкцией изготовителя. Перед заполнением расплавленной средой чашки Петри устанавливают на строго горизонтальную поверхность (выверенную по уровню, без впадин и выпуклостей). Глубина агарового слоя в чашке должна быть 4,0 мм, что достигается внесением 25-30 мл расплавленного агара в чашку диаметром 100 мм. Размер и форма зоны ингиби-ции роста зависят от глубины и равномерности агарового слоя. После заполнения чашки оставляют при комнатной температуре для застывания. Свежеприготовленные чашки перед инокуляцией культуры необходимо подсушить при 37°С в течение 10-20 мин с приоткрытой крышкой. Чашки с агаром можно хранить в запаянных полиэтиленовых пакетах при 4-8°С в течение 7-10 суток. Перед использованием их также необходимо подсушить в течение 10-20 мин при 37°С с приоткрытой крышкой. Перед инокуляцией необходимо проконтролировать отсутствие конденсата жидкости на внутренней поверхности крышек. Приготовление суспензии и инокуляция Для приготовления инокулята используют 18-20-часовую агаровую или 3-4-часовую бульонную культуру холерного вибриона. Суспензию или бульонную культуру доводят до концентрации 109 м.к./мл по отраслевому стандартному образцу ГИСК им. Л.А. Тарасевича – ОСО-42-25-59-86П и разводят в 10 раз изотоническим раствором хлорида натрия до конечной концентрации 108 м.к./мл. Приготовленный таким образом инокулят наносят в количестве 1-2 мл на поверхность питательной среды, равномерно распределяют по поверхности покачиванием и удаляют избыток жидкости пипеткой. Приоткрытые чашки подсушивают при комнатной температуре в течение 10-15 мин. Наложение дисков и инкубация Не позднее, чем через 15 мин после инокуляции, на поверхность питательной среды наносят диски с антибиотиками. Диски наносят с помощью автоматического диспенсора или стерильным пинцетом. Расстояние от диска до края чашки и между дисками должно быть 15-20 мм. Таким образом, на одну чашку диаметром 100 мм следует помещать не более 6 дисков. Диски должны равномерно контактировать с поверхностью агара, для чего их следует аккуратно прижать пинцетом. Непосредственно после наложения дисков чашки помещают в термостат кверху дном и инкубируют 14-18 ч при 37°С. Увеличение интервала между нанесением дисков на поверхность среды и началом инкубации, а соответственно и пролиферации микроорганизма, приводит к «преддиффузии» антибиотика и увеличению диаметра зоны ингибиции роста. Учет и интерпретация результатов После окончания инкубации чашки помещают кверху дном на темную матовую поверхность так, чтобы свет настольной лампы падал на них под углом в 45° (учет в отраженном свете). Диаметр зон задержки роста с учетом диаметра самого диска измеряют с точностью до 1 мм, при этом предпочтительнее пользоваться штангенциркулем или кронциркулем. При измерении зон задержки роста следует ориентироваться на полную ингибицию видимого роста. Не следует обращать внимания на очень мелкие колонии, выявляемые в пределах зоны задержки роста только при особых условиях освещения или увеличении, и на едва заметный налет у края зоны. Крупные колонии, выявляемые в пределах четкой зоны ингибиции роста, свидетельствуют о наличии посторонней микрофлоры или о гетерорезистентности популяции, в этом случае необходима повторная идентификация и повторение исследования на антибиотикочувствительность. При оценке чувствительности к сульфаниламидам и их комбинации с тримето-примом границу зоны ингибиции роста следует учитывать на уровне ингибиции роста на 80%. Это связано с тем, что под действием этих препаратов перед полной ингибицией роста возможно завершение 1-2-х циклов пролиферации микроорганизма. Интерпретация результатов производится по табл. 9. 6.7.3. Контроль качества питательных сред для определения антибиотикочувствительности Качество питательной среды является одним из критических параметров для корректной оценки антибиотикочувствительности. Важнейшими показателями качества питательной среды являются концентрации двухвалентных катионов Са2+ и Mg2+, влияющих на активность аминогликозидных антибиотиков и тетрациклинов, а также тимина и тимидина, являющихся антагонистами сульфаниламидных препаратов и три-метоприма. Перед использованием в экспериментах по оценке антибиотикорезистентности каждая новая партия среды (Mueller-Hinton или какой-либо другой) должна пройти контроль качества в соответствии с описанным ниже методом. A. Определение рН среды Определение рН среды проводят после автоклавирования и охлаждения до комнатной температуры 25°С, приемлемый диапазон 7,2-7,4. При величине рН среды, выходящей за указанные пределы, возможны существенные изменения в величине МПК. 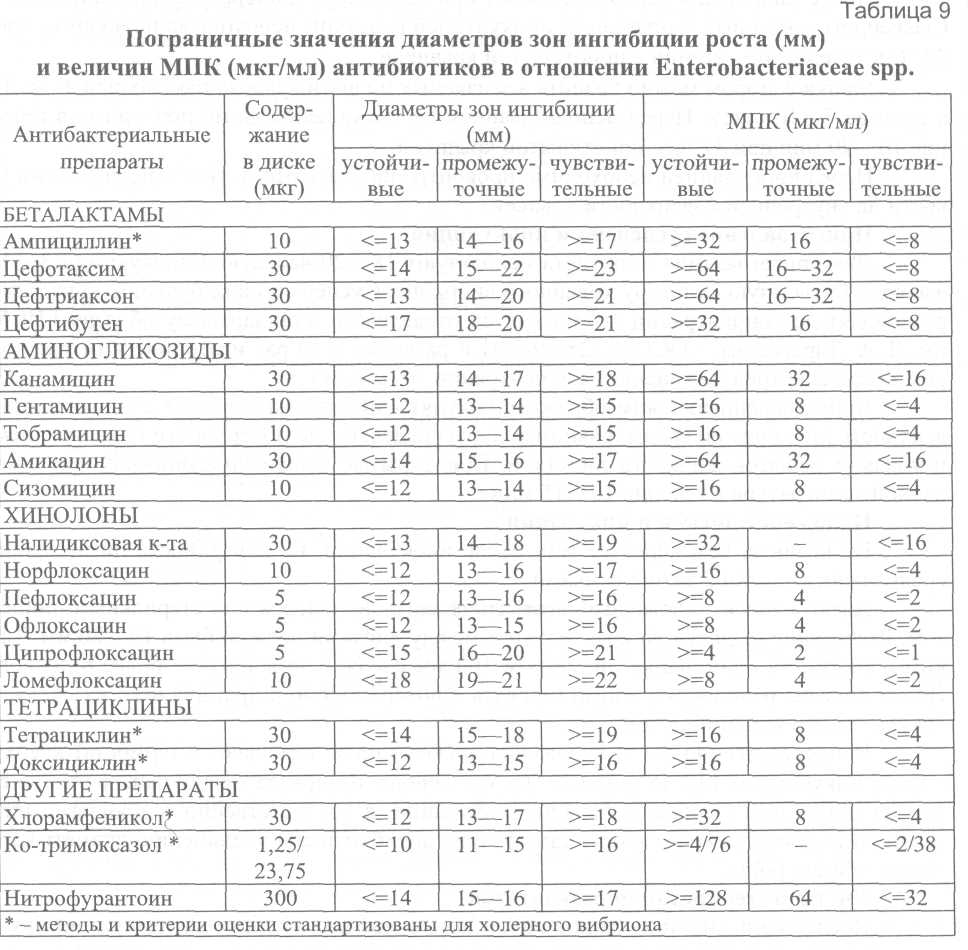 Б. Контроль катионного состава Для получения воспроизводимых результатов оценки антибиотикорезистентности питательная среда должна содержать Са2+ 20-25 мг/л и Mg2+ 10,0-12,5 мг/л. Наиболее доступным интегральным методом оценки качества сред (как жидких, так и агаризованных) является сопоставление экспериментально полученной величины МПК референтных штаммов микроорганизмов с этим показателем, приведенным в их паспортной характеристике. Наиболее подходящим штаммом для оценки качества жидких и плотных питательных сред, предназначенных для изучения антибиотикорезистентности, является штамм Pseudomonas aeruginosa ATCC 27853. Среду следует считать удовлетворительной по качеству, если величина МПК гентамицина находится в пределах 0,5-2,0 мкг/мл. Выбор гентамицина для контроля качества связан с тем, что аминогликозидные антибиотики наиболее чувствительны к колебаниям концентрации двухвалентных катионов. |
