Лабораторная диагностика холеры. МУК 4.2.2218-07 Лабораторная диагностика холеры. Методические указания мук 221807
 Скачать 2.25 Mb. Скачать 2.25 Mb.
|
|
5.3. Идентификация культур холерных вибрионов Культуры, выделенные на различных этапах, идентифицируют с целью определения их принадлежности к виду Vibrio cholerae соответствующей серогруппы (01, 0139 ил и других). К виду V.cholerae относят грамотрицательные, аспорогенные, полиморфные палочки, слегка изогнутые или прямые, активно подвижные, с одним полярно расположенным жгутиком, образующие индофенолоксидазу, ферментирующие глюкозу в аэробных и анаэробных условиях до кислоты (без газа), расщепляющие маннит, маннозу, сахарозу, но не активные в отношении к арабинозе, инозиту, салицину и некоторым другим субстратам. Холерные вибрионы декарбоксилируют лизин и орнитин, но не обладают дигидролазой аргинина, образуют индол, обладают нитратредуктазой, не продуцируют сероводород. Таксономическое положение холерных вибрионов и признаки, дифференцирующие их от родственных микроорганизмов, приведены на рис. 2 и в табл. 2, 3, 4. Возбудителями холеры являются V.cholerae 01 (биоваров классического и эль-тор; сероваров Инаба, Огава или Гикошима) и 0139 серогрупп. Токсигенные, эпидемически значимые варианты холерных вибрионов 01 и 0139 серогрупп, содержащие гены холерного токсина (ctx AB) и токсин-корегулируемых пилей (tcp А), вызывают заболевания холерой, склонные к эпидемическому распространению. Нетоксигенные (не содержащие гена холерного токсина), эпидемически неопасные варианты холерных вибрионов 01 могут вызывать спорадические или групповые заболевания холерой при общем источнике заражения. Вид V.cholerae помимо возбудителей холеры включает холерные вибрионы других О серогрупп, в настоящее время их известно более 200. Отдельные штаммы некоторых из них могут вызывать единичные случаи диарей или заболевания с внекишечной локализацией возбудителя. Известны отдельные групповые заболевания или вспышки диарей, обусловленных ими, при общем источнике заражения. Идентификацию выделенных на полиуглеводной среде или щелочном агаре агглютинирующихся на стекле культур проводят по сокращенной или полной схеме. 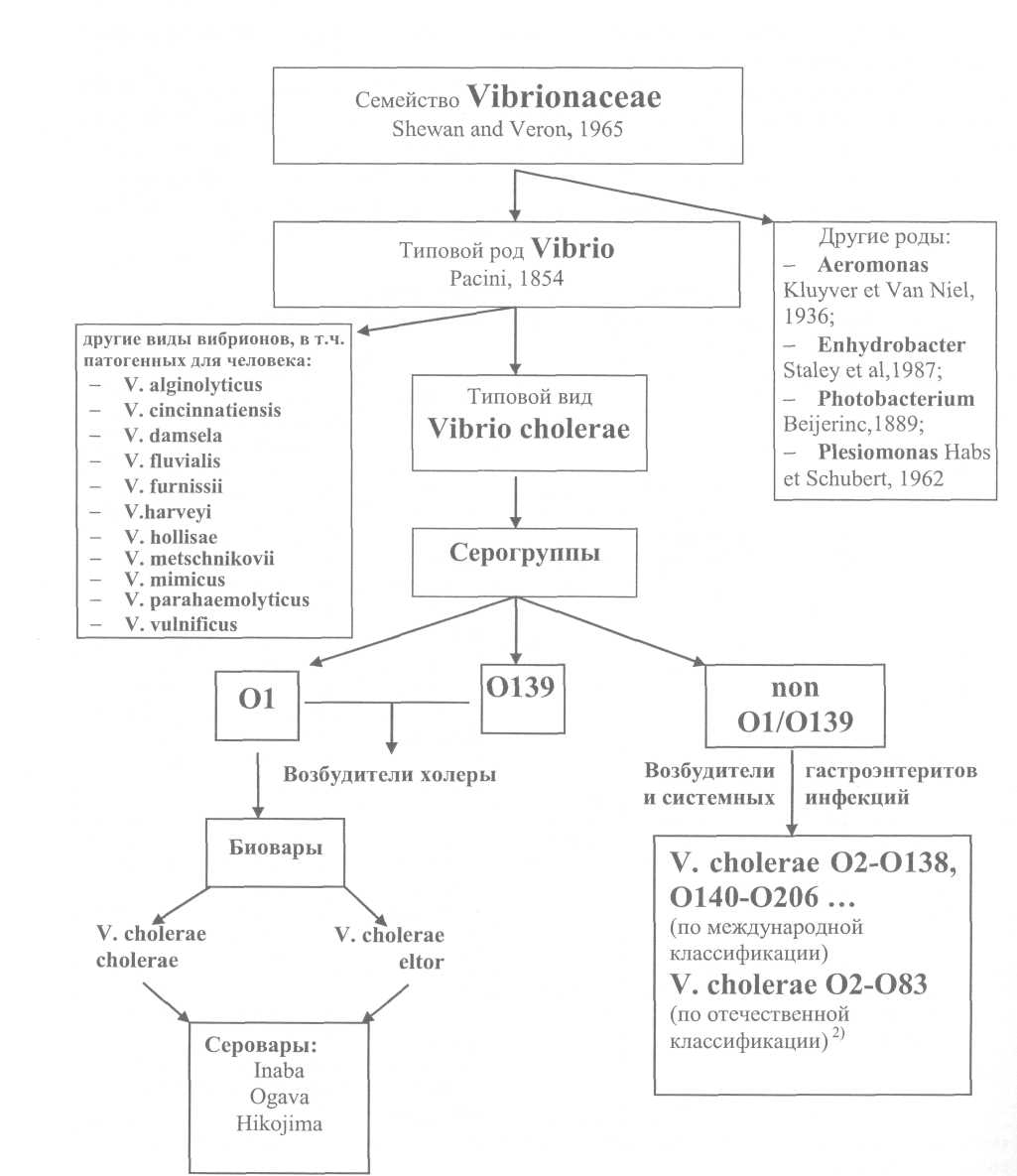 Примечания: 1) таксономия вибрионов представлена по Bergeys manual of Determinative Bacteriology, 1994; 2) типовые штаммы О2-О39 соответствуют Sakazaki (1970); 040-083, а также 012; 023 и 026 не изучены в сравнении с международной коллекцией типовых штаммов. 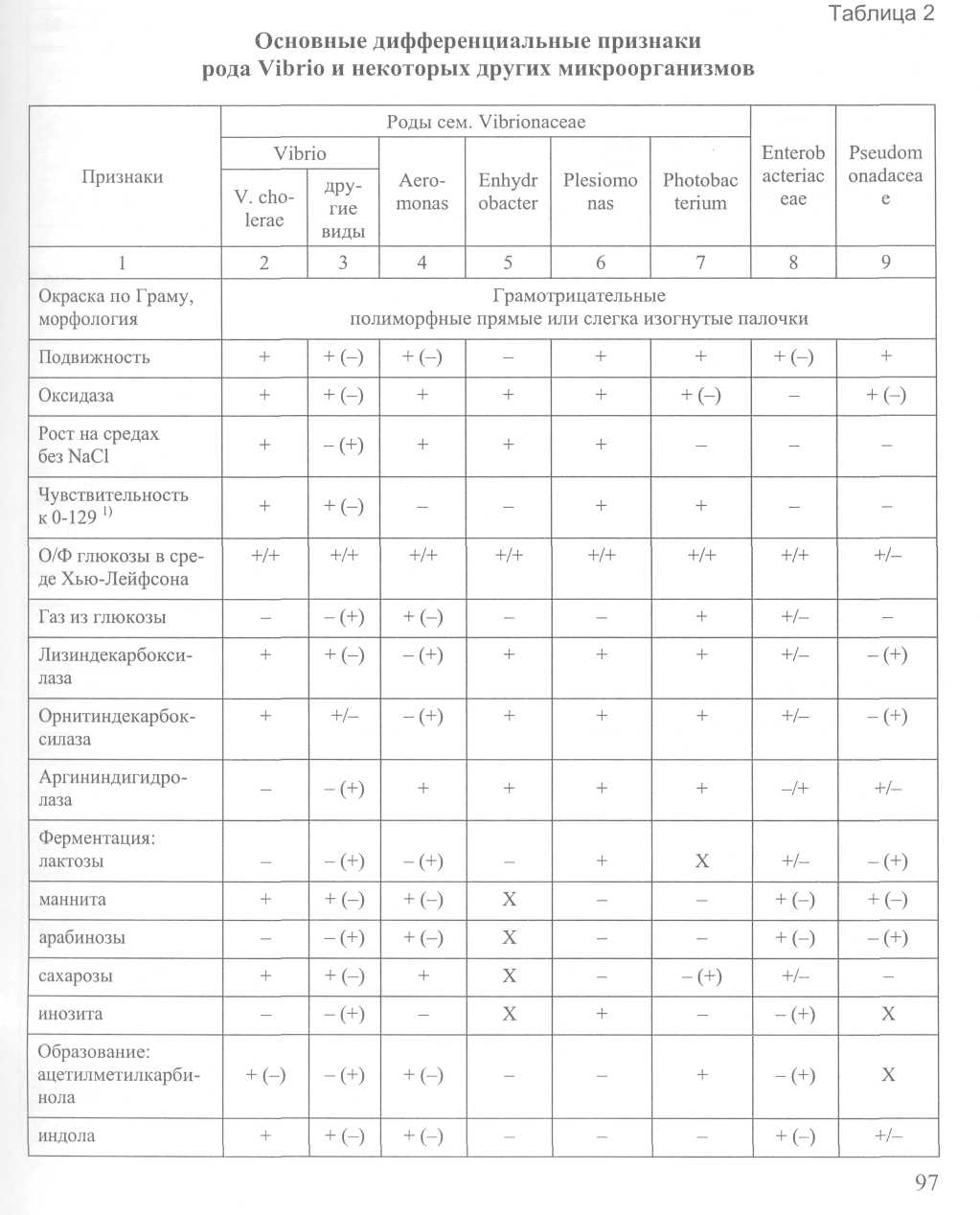  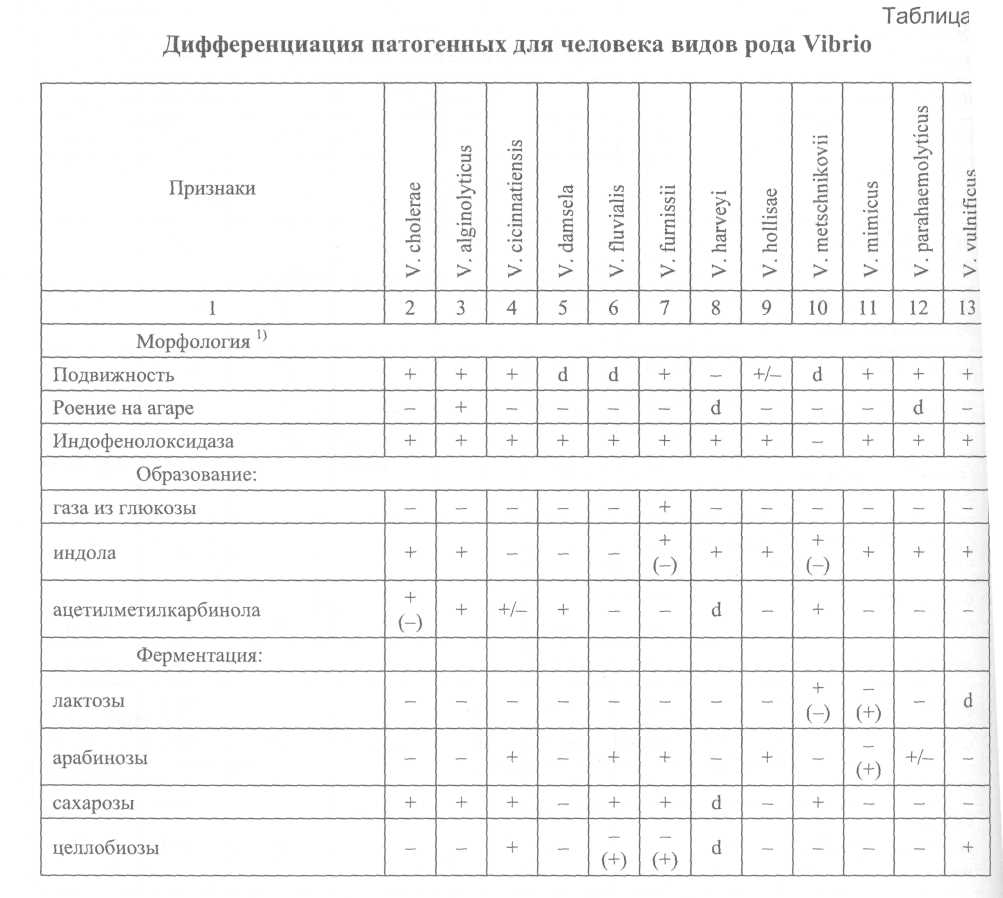 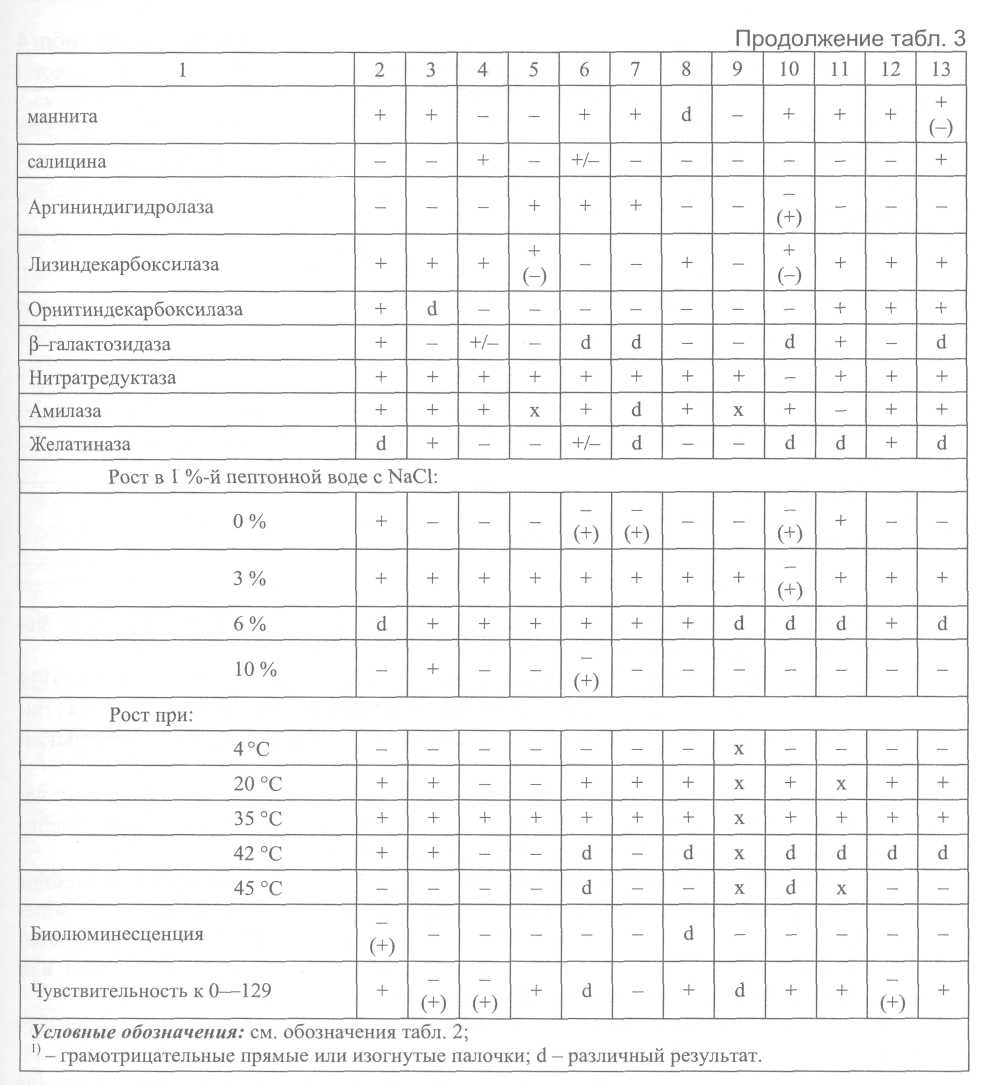 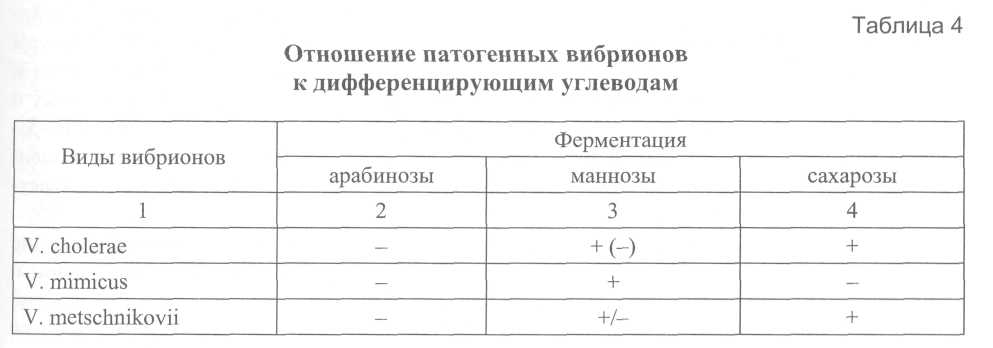  Сокращенная схема идентификации типичных по культуральным и морфологическим препаратам оксидазопозитивных культур, агглютинирующихся в слайд-агглютинации холерной 01 или 0139 сывороткой предусматривает изучение культуры в развернутой реакции агглютинации с холерными сыворотками 01, Инаба, Огава и РО, определение чувствительности к диагностическим бактериофагам классическому и эльтор, отношения к глюкозе в среде Хью-Лейфсона, сахарозе, маннозе, манниту и арабинозе в средах Гиса, а также лизину, орнитину и аргинину, и ориентировочную оценку эпидемической значимости по гемолитической активности в пробе Грейга и чувствительности к холерным эльтор ctx+ и ctx фагам. Культуры оксидазопозитивных, активно подвижных вибрионов, расщепляющие глюкозу в среде Хью-Лейфсона до кислоты без газа, декорбоксилирующие лизин и орнитин, не обладающие дигидролазой аргинин, ферментирующие сахарозу, маннозу, маннит в средах Гисса и инактивные по отношению к арабинозе, агглютинирующиеся не менее чем до 1/2титра сыворотками О1 и одной из вариантоспецифических сывороток, относят к V.cholerae 01 серовара Огава или Инаба. Культуры, агглютинирующиеся обеими вариантоспецифическими сыворотками не менее чем до 1/2 титра, относят к серовару Гикошима. В случае агглютинабельности выделенной культуры обеими вариантоспецифическими сыворотками целесообразно повторить исследование с использованием различных серий коммерческих препаратов. Для подтверждения принадлежности выделенной культуры холерных вибрионов к 0139 серогруппе достаточно положительного результата в слайд-агглютинации с соответствующей сывороткой в рабочем разведении. Полная схема идентификации культур, агглютинирующихся холерными сыворотками 01 серогруппы, предусматривает изучение их по дополнительным тестам, определяющим принадлежность к биовару (гемагглютинация, чувствительность к поликсимину, реакция Фогес-Проскауэра), определение антибиотикограммы, окончательную оценку эпидзначимости по результатам исследования в ПЦР на наличие генов ctx и tcp, и определение токсигенности на модели кроликов-сосунков. В случае выделения культур холерных вибрионов 0139 серогруппы, их также изучают по чувствительности к антибиотикам, определяют эпидемическую значимость ориентировочно по гемолитической активности в пробе Грейга, окончательно – указанными выше специальными методами. Токсигенные штаммы холерных вибрионов 01 и 0139 серогрупп, как правило, не лизируют эритроциты барана в пробе Грейга в отличие от нетоксигенных штаммов. На культуры, имеющие характерные для вибрионов морфологические, культу-ральные и биохимические признаки, агглютинирующиеся 01 и одной из вариантоспецифических сывороток не менее чем до 7 г титра, лизирующиеся и не лизирующиеся холерным и эльтор фагами, а также на культуры, агглютинирующиеся сывороткой 0139, выдают окончательный ответ, указывая чувствительность их к антибиотикам и оценку эпидемической значимости по результатам ориентировочных или специальных исследований. Кроме того, для холерных вибрионов 01 серогруппы указывают биовар на основании чувствительности к одному из диагностических фагов (эльтор или классическому) и (или) по дополнительным признакам - для фагорезистентных культур (табл. 5). 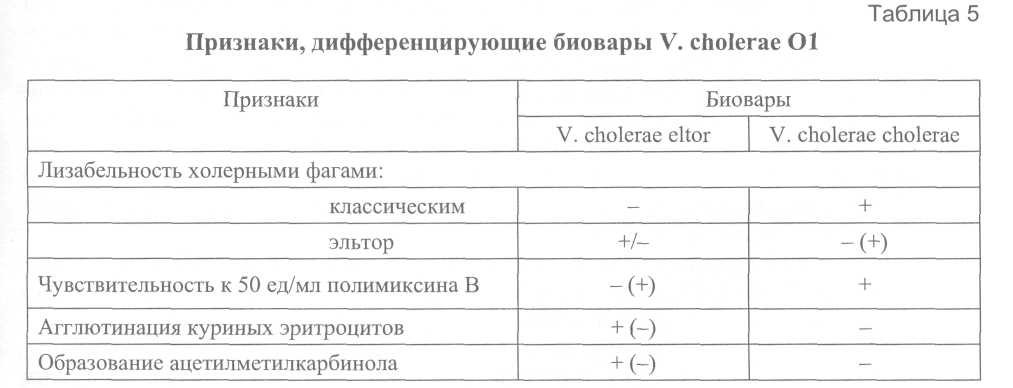 Культуры, имеющие признаки вибрионов по морфологии колоний и клеток, тесту на индофенолоксидазу и ферментативной активности на полиуглеводной среде, не агглютинирующиеся на стекле холерными сыворотками 01 и 0139 серогрупп, выделенные от больных острыми кишечными инфекциями, идентифицируют по тестам, определяющим принадлежность к роду Vibrio и виду V.cholerae (табл. 2 и 3). Принадлежащие к V.cholerae культуры изучают в пробе с диагностическими фагами. При выделении чувствительных к холерным диагностическим монофагам, но не агглютинирующихся холерными сыворотками 01 культур, особое значение имеет изучение их клеточного состава, т. к. в популяции таких штаммов могут находиться типичные холерные вибрионы О1 серогруппы. Если культура по совокупности признаков относится к виду холерных вибрионов, но не агглютинируется холерными 01 и 0139 сыворотками, ее изучают в реакции агглютинации с набором диагностических холерных сывороток 02-083 серогрупп по отечественной классификации (рис. 2). На культуры, агглютинирующиеся одной из сывороток, выдают ответ о выделении V.cholerae 02, О5 или другой серогруппы. Если культуры не типируются указанными холерными сыворотками или они отсутствуют в лаборатории, то выделенную культуру обозначают обобщенно – V.cholerae non 01/0139 серогрупп. Кроме этого, штаммы V.cholerae поп 01 типируют бактериофагами диагностическими холерными ТЭПВ 1-7. Энтеропатогенные холерные вибрионы не 01 группы относятся преимущественно к 02, 05, Об, 08, 011, 013, 018, 037, 047, 050, 062, 065, 082, 083 серогруппам и, как правило, лизируются фагами ТЭПВ 1, 4, 7. У выделенных от больных штаммов холерных вибрионов не 01/0139 серогрупп определяют антибиотикограмму. Для выделенных из окружающей среды вибрионов, не агглютинирущихся холерными 01 и 0139 сыворотками, целесообразность полной таксономической характеристики определяется в каждом случае отдельно для конкретных территорий и объектов с учетом эпидситуации по холере и регистрации острых кишечных заболеваний, обусловленных этими микроорганизмами. Идентификация атипичных культур холерных вибрионов К атипичным относят культуры холерных вибрионов, отклоняющиеся от типичных по отдельным родовым и видовым признакам, а также по агглютинабельности группо- и вариантоспецифическими сыворотками 01 и чувствительности к диагностическим фагам (классическому и эльтор). Антигенная изменчивость холерных вибрионов 01 может выражаться в ослаблении до ¼ титра или утрате агглютинабельности холерными сыворотками 01, Инаба, Огава. Встречаются штаммы, агглютинирующиеся только холерной сывороткой 01 серогруппы и не реагирующие с вариантоспецифическими сыворотками (Инаба и Огава), что делает невозможным установление их серова-ра. В случае S-R диссоциации культуры холерных вибрионов начинают агглютинироваться РО-сывороткой. При этом в одних случаях штаммы агглютинируются всеми холерными сыворотками, в т. ч. и РО, их обозначают как SR-варианты, в других – измененные холерные вибрионы в диагностических титрах агглютинируются только с РО сывороткой и не агглютинируются холерными сыворотками 01, Инаба и Огава, их относят к R-вариантам. В последние годы возросла частота встречаемости резистентных к диагностическим холерным фагам штаммов среди холерных вибрионов 01, выделяемых как от людей, так и из объектов окружающей среды. При этом фагоустойчивость вибрионов, снижение или отсутствие агглютинабельности холерными сыворотками иногда сочетается с вариабельностью по другим признакам (культурально-морфологическим и биохимическим). Штаммы, атипичные по морфологическим признакам, образуют шероховатые, слизистые, мутные и пигментированные колонии. Размер их также может варьировать, вплоть до появления едва видимых карликовых колоний. У таких культур нередко снижена подвижность, наблюдается спонтанная агглютинация в 0,9%-м растворе натрия хлорида. Отмечена возможность обнаружения в организме больного и в воде открытых водоемов холерных вибрионов в Л-форме. В мазках, сделанных из атипичных культур холерных вибрионов, клетки имеют форму шаров, сферопластов, встречаются вытянутые, извитые, неделящиеся клетки в виде цепей или нитей. Нередко встречаются штаммы, измененные по биохимическим свойствам, у которых отмечается ослабление, замедление или утрата способности расщеплять углеводы и многоатомные спирты (крахмал, маннит, маннозу, сахарозу), аминокислоты (триптофан, лизин, орнитин) и другие субстраты. Во всех случаях выделения атипичных культур обязательно изучение их по признакам, определяющим их принадлежность к роду Vibrio и виду Vibrio cholerae (определение типа расщепления глюкозы в среде Хью и Лейфсона, декарбоксилаз лизина и орнитина и дигидролазы аргинина, чувствительности в вибриостатику 0129 – 2,4-диамино-6,7-диизопропилптеридину и др.). Атипичные культуры холерных вибрионов, обладающие указанными выше признаками рода Vibrio и вида Vibrio cholerae, агглютинирующиеся сывороткой 01 до ¼ титра, лизирующиеся и не лизирующиеся диагностическими монофагами до ДРТ, следует относить к серогруппе О1. Для всестороннего изучения все атипичные культуры холерных вибрионов следует направлять в специализированные лаборатории. Для подтверждения принадлежности к V.cholerae 01 слабоагглютинирующихся (ниже ¼ титра), диссоциирующих и фагорезистентных культур обязательным является использование высокочувствительных методов (мультиплексным ПЦР набором праймеров) и, по возможности, реакции агглютинации с кроличьими холерными сыворотками, обладающими большей специфичностью, чем лошадиные, поскольку они не содержат пула неспецифических иммуноглобулинов. Рекомендуется при изучении измененных по антигенной структуре культур использовать также такие методы, как РНГА, РНАт, иммунофлюоресценцию, преципитацию в геле, адсорбцию агглютининов по Кастеллани, реакцию агглютинации с убитыми кипячением культурами, пробу с комплементом, позволяющую отбирать из популяции измененных штаммов типичные, резистентные к нему клоны в S-форме. При получении сомнительных результатов слайд-агглютинации с холерной сывороткой 0139 серогруппы следует повторить исследование с гретой культурой. Для серологической идентификации спонтанно агглютинирующихся культур применяют те же методы и дополнительно реакцию агглютинации с использованием осажденной культуры и 0,3%-го раствора натрия хлорида для разведения диагностических сывороток и приготовления взвеси изучаемой культуры. 5.4. Учет анализов, оформление направлений и выдача результатов Ответ о положительном результате может быть предварительным и окончательным. Предварительный положительный ответ выдают по результатам ускоренного исследования нативного материала и после подращивания его в пептонной воде с помощью иммунофлюоресцентного метода, специфической иммобилизации, РНГА, а также по слайд-агглютинации сыворотками О1 и 0139 подозрительных на холерный вибрион колоний. При наличии возможности на этом этапе может быть использована ПЦР со специфическими праймерами. Предварительный ответ, в случаях проведения срочных анализов, сообщают устно и только при совпадении результатов не менее двух методов. В условиях эпидемии холеры при проведении массовых исследований после идентификации первых культур такой ответ дает право на проведение противоэпидемических мероприятий. Окончательный положительный ответ выдают по результатам сокращенной или полной идентификации выделенной культуры в течение 36-48 ч. При проведении массовых исследований в очаге заболеваний холерой, когда первые культуры холерных вибрионов уже были идентифицированы по полной схеме, положительные результаты тестирования в слайд-агглютинации с холерными сыворотками О1 или 0139 серогрупп в сочетании с морфологией и подвижностью клеток культур, выделенных от больных диареями или при обследовании на вибриононосительство, следует считать окончательными для решения вопросов о проведении противоэпидемических мероприятий. Достоверность таких результатов повышается при использовании ускоренных методов диагностики: иммунофлюоресцентного, иммобилизации соответствующими сыворотками, ПЦР и др. Для полной идентификации выделенные культуры передают в назначенную для этих целей группу или лабораторию, специалисты которой при необходимости вносят в ответ соответствующие коррективы и дополнения, касающиеся определения антибиотикограммы, эпидемической значимости и токсигенности. Отрицательный ответ может быть дан только по окончании исследования по полной схеме через 36-48 ч; при осуществлении эпиднадзора в условиях односменной работы лаборатории, допускающей использование теллурита калия, продолжительность анализа увеличивается до 3-4 суток. Не допускается выдавать отрицательные ответы по результатам ускоренного исследования (МФА, РИВ, РИГА, и др.) до окончания анализа как в условиях эпидемии холеры, так и при проведении эпидемиологического надзора. Схему выдачи ответов см. на рис. 3. 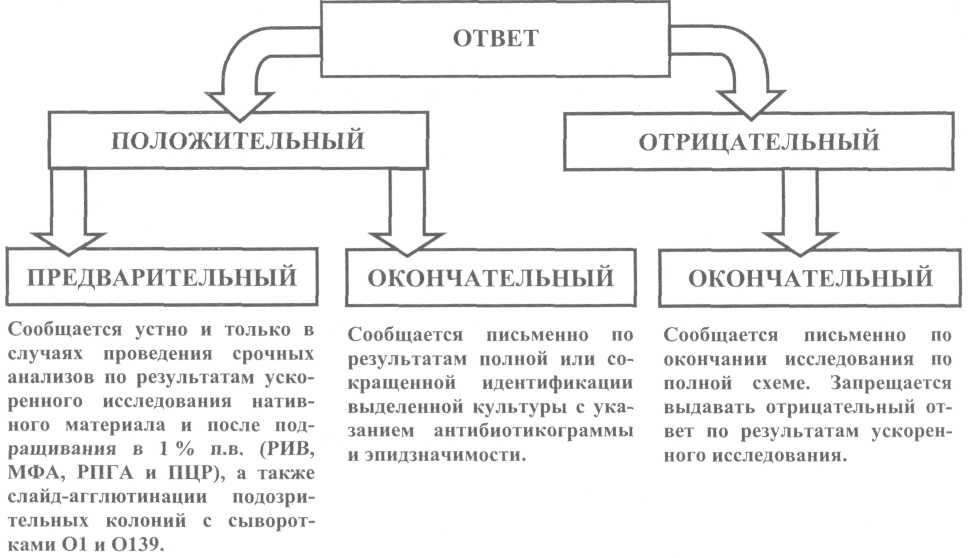 При осуществлении эпидемиологического надзора направление к анализу, а соответственно и ответ на него, оформляют индивидуально на каждого больного. При проведении большого объема исследований в очаге холеры направления к анализам и ответы на них оформляют списком. При обследовании здоровых людей на вибриононосительство и исследовании на холеру объектов окружающей среды групповые формы направления и ответов допускаются как при эпиднадзоре, так и в очаге холеры. Учет анализов и культур ведут по установленным формам (прилож. 6, 7). Обязательным является ведение рабочих записей идентификации исследования подозрительных культур (прилож. 8), регистрация выделенных культур (прилож. 9), составление паспорта штамма (прилож. 10). При работе в очаге холеры используют упрощенные формы регистрации анализов, учитывая, что более подробные сведения имеются в бланках направлений, находящихся в лаборатории до ликвидации очага. Для удобства работы направления за каждый день подшивают отдельно. 6. Методы изучения свойств холерных вибрионов 6.1. Серологические методы Принадлежность холерных вибрионов к О1 или 0139 серогруппе определяют в слайд-агглютинации или развернутой реакции агглютинации с холерными агглютинирующими сыворотками 01, Инаба, Огава, РО и с холерной сывороткой 0139 серогруппы в соответствии с инструкциями по применению препаратов, а также в других реакциях с иммуноглобулиновыми препаратами, предназначенными для ускоренной диагностики холеры и идентификации возбудителя. Слайд-агглютинацию ставят на обезжиренном стекле, помещенном в чашку Петри или на дне самой чашки, используя подозрительную на холерный вибрион колонию и (или) агаровую 12-18-часовую культуру и сыворотки 01 серогруппы в разведении 1:50-1:100. Сыворотку 0139 разводят в соответствии с указанием на этикетке. Реакцию обязательно сопровождают контролями культуры в 0,9%-м растворе хлорида натрия. Развернутую реакцию агглютинации ставят и учитывают по общепринятой методике в соответствии с инструкцией по применению диагностических сывороток. Для исключения спонтанной агглютинации рекомендуется ставить развернутую реакцию в 0,3%-м растворе NaCl. Диагностические сыворотки двукратно разводят 0,3%-м раствором натрия хлорида в объеме 0,5 мл соответственно величине диагностического титра. Суспензию изучаемой культуры готовят в этом же растворе концентрацией 3 × 109 – 5 × 109 м.к./мл в объеме 8-10 мл. Взвесь выдерживают при комнатной температуре в течение 1,0-1,5 ч. В реакции используют поверхностный слой микробной взвеси, разведенной 0,3 %-м раствором натрия хлорида до концентрации 1 млрд м.к./мл, добавляя ее по 0,5 мл во все разведения сыворотки и контроль культуры (0,5 мл 0,3%-го раствора натрия хлорида + 0,5 мл взвеси культуры). Учет и оценка результатов аналогичны основному варианту развернутой реакции. Флюоресцентно-серологический метод (МФА — метод флюоресцирующих антител) Метод дает возможность ускоренно идентифицировать выделенную культуру, а также выявить возбудителя холеры 01 и 0139 серогруппы при содержании его в ис-следуемом материале не менее чем 10 м.к./мл. Исследованию подлежат выделенная культура, нативный материал (испражнения и рвотные массы) и материал после подращивания. Порядок приготовления мазков, обработка их флюоресцирующими иммуноглобулинами, микроскопия и оценка результатов, являющиеся общими для всех бактерий, описаны в «Наставлениях по применению иммуноглобулинов диагностических флюоресцирующих холерных адсорбированных лошадиных сухих». Положительный результат может быть получен через 1,5—2,0 ч от начала исследования. При просмотре мазков, обработанных иммуноглобулином холерным флюоресцирующим, особое внимание следует обращать на морфологию светящихся микробов, т. к. в отдельных случаях в мазках из испражнений здоровых людей может наблюдаться свечение микроорганизмов, отличающихся по морфологии от вибрионов (грубые крупные палочки, кокки). Для устранения неспецифического свечения целесообразно использовать в качестве «гасителя» бычий альбумин, меченый родамином. Методика его использования описана в «Инструкции по применению альбумина бычьего, меченого родамином, сухого». Реакция иммобилизации вибрионов под влиянием специфических холерных сывороток 01 и O139 серогрупп (РИВ) Метод дает возможность обнаружить возбудителя в течение нескольких минут при концентрации его в исследуемом материале не менее 105 м.к/мл. На предметное стекло пипеткой или петлей наносят 2 капли испражнений, рвотных масс или поверхностного слоя среды обогащения. Первую каплю накрывают покровным стеклом (контроль), ко второй добавляют каплю 01 сыворотки в разведении 1:50, перемешивают и также накрывают покровным стеклом. Раздавленную каплю смотрят под микроскопом при увеличении ×400-600, используя фазово-контрастное устройство или конденсор темного поля. При наличии в исследуемом образце холерных вибрионов в первой капле наблюдают характерную подвижность, во второй – иммобилизацию отдельных микробных клеток и образование неподвижных микроагглютинатов немедленно или в течение 1-2 мин. В случае неспецифического взаимодействия с диагностическими сыворотками наблюдается образование мелких подвижных конгломератов при активной подвижности отдельных клеток. Реакция иммобилизации специфична и позволяет дать первый сигнальный ответ через 15-20 мин от начала исследования нативного материала. При отрицательном результате исследование повторяют после подращивания в 1%-й пептонной воде. В случае отрицательного результата необходимо провести аналогичное исследование с холерной сывороткой 0139 серогруппы, которую разводят 1:5. Реакция непрямой гемагглютинации (РНГА) с использованием диагностикума эритроцитарного холерного иммуноглобулинового Порядок подготовки материала, ингредиентов, постановки реакции и ее учет изложены в «Инструкции по применению диагностикума эритроцитарного холерного антительного иммуноглобулинового», прилагаемой к препарату. |
