Сборник лаб. раб по общей химии new. Методические указания по выполнению лабораторных работ и организации самостоятельной работы для студентов всех форм обучения
 Скачать 1.56 Mb. Скачать 1.56 Mb.
|
|
Лабораторная работа № 7 Электрохимическая активность металлов и гальванический элемент Введение Из 105 элементов периодической системы более восьмидесяти относятся к металлам. Переоценить значение металлов для человека невозможно. Одним из основных наиболее важных свойств металлов является способность их атомов окисляться, а катионов металлов – восстанавливаться (электрохимическая активность). Электрохимические процессы, связанные с окислительно-восстановительными реакциями металлов, происходят при электролизе, коррозии и в гальванических элементах. Одной из важнейших народно-хозяйственных задач является получение электрической энергии. Широко распространенным способом решения этой задачи является способ превращения химической энергии, освобождающейся в результате реакции, в электрическую энергию. Этот процесс осуществляется в простейших источниках электрического тока – гальванических элементах, а также других химических источниках тока и аккумуляторах. Для будущих инженеров и технологов необходимо иметь представление о том, какие процессы возникают на границе «металл-раствор» или «металл-расплав электролита», как устроен и работает гальванический элемент. Эти знания необходимы студенту, чтобы дальше можно было понять другие электрохимические процессы – коррозию металлов и электролиз. Для того чтобы успешно освоить материал данной темы, студент должен знать:
1. Цель и задачи В процессе изучения теоретического материала и в ходе выполнения эксперимента студент должен: а) научиться рассчитывать величину электродного потенциала по уравнению Нернста; б) по величине электродного потенциала научиться оценивать восстановительные свойства атомов металлов и окислительные свойства катионов металлов; в) опытным путем установить восстановительную активность предложенных металлов; г) ознакомиться с устройством и работой гальванического элемента; д) научиться составлять гальванические элементы и в зависимости от электродных потенциалов определять химические процессы, протекающие на электродах; е) научиться рассчитывать электродвижущую силу гальванических элементов. 2. Теоретическая часть 2.1. Электродный потенциал. Химическая активность металлов К металлам относятся химические элементы, в атомах которых на внешнем энергетическом уровне находится от одного до трех электронов. Поэтому основное химическое свойство атомов металлов – это их способность сравнительно легко отдавать свои валентные электроны (окисляться) и превращаться в положительно заряженные ионы. То есть атомы металлов являются восстановителями. Способность окисляться у различных металлов проявляется в разной степени Способность атомов металла окисляться, а его катионов восстанавливаться оценивается величиной стандартного электродного потенциала (Е0). Рассмотрим возникновение электродного потенциала на металлическом электроде. В твердом состоянии металлы являются кристаллическими веществами. В узлах кристаллической решетки располагаются катионы металла, а между ними перемещаются обобществленные электроны. При помещении металлической пластины (электрода) в воду между катионами металла, находящимися на поверхности электрода, и полярными молекулами воды происходит взаимодействие. В результате этого взаимодействия часть катионов металла переходит с поверхности электрода в раствор в виде гидратированных ионов. В электроде остается избыток электронов, и электрод заряжается отрицательно. Ушедшие в раствор катионы металла находятся вблизи электрода. Таким образом, на границе раздела «электрод – прилежащий раствор» возникает двойной электрический слой. Часть катионов металла из раствора снова возвращается на поверхность электрода. Со временем в двойном электрическом слое устанавливается равновесие: катионы металла в твердой фазе В двойном электрическом слое происходит определенный скачок потенциала, который называется электродным потенциалом. При погружении электрода в раствор электролита, содержащего катионы металла, из которого сделан электрод, могут происходить два процесса: один такой же, как и при погружении электрода в воду, при этом электрод заряжается отрицательно; другой процесс – обратный первому. Катионы металла, находящиеся в растворе, переходят на поверхность электрода, достраивают его кристаллическую решетку, электрод при этом заряжается положительно. За счет сил электростатического притяжения возле электрода в прилежащем слое жидкости собираются анионы электролита. Образуется двойной электрический слой. Потенциал такого двойного электрического слоя будет иметь положительное значение.1 Какой из этих двух процессов будет проходить на электроде при погружении его в раствор электролита, это зависит от природы электрода, концентрации катионов металла в растворе электролита температуры. Абсолютную величину электродного потенциала определить нельзя. Потенциал электрода измеряют по отношению к стандартному водородному электроду, потенциал которого при 298°К (25°С) условно принят равным нулю. Потенциал электрода, помещенного в раствор электролита с концентрацией его катионов, равной I моль/л, измеренный относительно стандартного водородного электрода при стандартных условиях называется стандартным электродным потенциалом (Е0). Стандартные электродные потенциалы для всех металлов являются справочными величинами. При изменении концентрации электролита, температуры величина электродного потенциала будет изменяться. Зависимость величины электродного потенциала (Е) от природы металла, концентрации катионов металла в растворе, температуры выражается уравнением Нернста: где Е0 - стандартный электродный потенциал; С - концентрация катионов металла в растворе; в концентрированных растворах она заменяется на активность ионов а; R - универсальная газовая постоянная; F - число Фарадея; n - заряд катиона металла. Подставив в уравнение Нернста значения постоянных величин R, F и Т=298°, а также заменив lnC = 2,3.lgC, получаем: Уравнение Нернста позволяет рассчитать значение электродного потенциала при концентрациях электролита, отличающихся oт С = 1 моль/л. Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов, получаем ряд стандартных электродных потенциалов (ряд напряжений). Чем меньше значение стандартного электродного потенциала металла, тем легче атомы этого металла окисляются, а его катионы труднее восстанавливаются. Таким образом, металл, имеющий меньшее значение стандартного электродного потенциала, будет более сильным восстановителем, чем металл, у которого стандартный электродный потенциал больше. Металл с меньшим стандартным электродным потенциалом способен восстановить из раствора катионы всех тех металлов, у которых потенциал больше. 2.2. Устройство и работа гальванического элемента Возникновение электродного потенциала на металлических электродах делает возможной работу гальванического элемента. Гальванический элемент – это система, состоящая из двух электродов, на поверхности которых химическая энергия окислительно-восстановительных процессов превращается в электрическую энергию. Гальванический элемент состоит из двух различных металлических электродов, каждый из которых погружен в раствор своей соли. Растворы солей должны быть разделены пористой перегородкой, которая препятствует смешению растворов, но дает возможность анионам электролита переходить из одного раствора в другой. Иногда растворы солей помещают в разные сосуды, тогда их соединяют электролитическим мостиком, предназначенным также для осуществления ионной проводимости в элементе. Электрод, помещенный в раствор своей соли, образует полуэлемент. Таким образом, гальванический элемент состоит из двух полуэлементов. В каждом полуэлементе возникает электродный потенциал. Поскольку металлы, из которых сделаны электроды, различны, то и электродные потенциалы будут иметь разное значение. Если эти два полуэлемента соединить между собой проводником первого рода, то электроны начнут переходить от электрода, где их больше (электродный потенциал меньше по своей величине), к электроду, на котором электронов меньше (электродный потенциал больше по величине). Этот переход электронов вызовет нарушение равновесия в двойном электрическом слое на обоих электродах. При этом на электроде с меньшим электродным потенциалом новое количество катионов металла перейдут в раствор, а на втором электроде с большим электродным потенциалом катионы из раствора перейдут на электрод. Таким образом, на первом электроде будет проходить реакция окисления: Ме1 - nе = Me1+n, где Me1 – первый металл; n – число электронов; а на втором электроде будет идти реакция восстановления: . Me2+n + ne = Me2, где Ме2 – второй металл. Электрод, на котором протекает реакция окисления (электрод с меньшим электродным потенциалом), называется анодом. Электрод, на котором протекает реакция восстановления (электрод с большим потенциалом), называется катодом. Разность потенциалов электродов служит мерой способности гальванического элемента совершать электрическую работу и называется электродвижущей силой (ЭДС) и обозначается Ет.э. ЭДС гальванического элемента равна разности потенциалов катода и анода: Ет.е. = Екатода - Еанода. Схематически можно записать формулу гальванического элемента следующим образом: Ме1 | Me1+nx || Me2+nx | Me2 раствор раствор В формуле одна вертикальная черта обозначает границу раздела твердой фазы и раствора; двойная вертикальная черта - граница раздела растворов, стрелки указывают направление перехода электронов. 3. Экспериментальная часть 3. 1. Качественное определение различной электрохимической активности металлов Установите опытным путем относительную активность шести металлов: меди, железа, олова, свинца, алюминия и цинка. Для этого возьмите шесть пробирок, внесите в каждую из них по 12-15 капель одного из следующих растворов: соли меди (II), соли железа (II), соли свинца (II), соли алюминия и соли цинка. Во все растворы, кроме раствора соли меди, опустите на 1-2 минуты по кусочку меди или медной проволоки. В какой пробирке красная медь покрылась налетом другого металла? Что это за металл, оказавшийся менее активным, чем медь? Напишите в ионном виде уравнение реакции взаимодействия меди с ионами этого металла. Выньте из пробирок медные полоски и опустите во все пробирки, кроме раствора соли железа (II), железную проволоку или кусочки железа. Какие металлы вытесняются из раствора солей железом? Напишите уравнения реакций взаимодействия железа с ионами этих металлов. Какова восстановительная активность железа по сравнению с вытесненными металлами? Проведите аналогичные опыты с кусочками свинца, алюминия, олова и пинка. Наблюдайте каждый раз, в каких пробирках происходит вытеснение металла из его соли. Напишите уравнения протекающих реакций с указанием направления перехода электронов. Результаты опытов запишите в следующей таблице.
Знаком (+) под соответствующими ионами металлов обозначайте вытеснение металлов из раствора своей соли при действии того или другого чистого металла и знаком (-), если вытеснения не происходит. Какой из исследованных металлов самый активный и вытеснил все остальные из их солей? Какой металл наименее активный? Расположите все остальные исследованные металлы между ними в порядке убывающей восстановительной активности. Напишите в ряду активности под каждым металлом его нормальный электродный потенциал. Соответствует ли составленный вами ряд последовательности расположения металлов в ряду нормальных электродных потенциалов? Принимая электродный потенциал водорода равным 0, поместите водород в полученный ряд активности. Какие из исследованных металлов могут вытеснить водород из разбавленных кислот? 3.2. Изготовление медно-цинкового гальванического элемента Медную пластинку, соединенную с медной проволочкой, опустить в 1,0м раствор медного купороса, а цинковую, прикрепленную к медной проволоке, опустите в 1,0м раствор сульфата цинка. Соединить оба раствора изогнутой стеклянной трубкой, заполненной раствором электролита с примесью агар-агара Концы медных проволочек опустить в стеклянный стаканчик с раствором сульфата натрия, в который добавить несколько капель раствора фенолфталеина. Наблюдать окрашивание раствора около проволоки, прикрепленной к цинковой пластинке (рис 1). 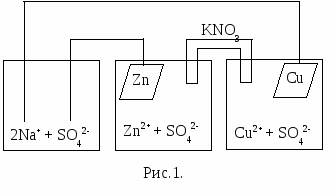 Какие окислительно-восстановительные процессы происходят на катоде и аноде вашего гальванического элемента? Какие процессы происходят на электродах в стакане с раствором сульфата натрия? Почему появилось окрашивание у цинковой проволоки, соединенной с цинковым электродом? Объясните назначение электролитического мостика. Рассчитайте ЭДС вашего гальванического элемента 3.3. Изготовление медно-никелевого гальванического элемента Соберите медно-никелевый гальванический элемент, используя 1,0 м растворы NiSO4 и CuSO4, электролитический мостик и электроды: медный и никелевый. Соедините концы проволочек ваших электродов с гальванометром, отметьте направление тока. Напишите уравнения реакций, протекающих на каждом электроде. Рассчитайте ЭДС гальванического элемента. 4. Задачи для самостоятельной работы 1. Рассчитайте величину равновесного электродного потенциала металла, опущенного в раствор своей соли с указанной концентрацией катиона металла:
2. Какой электрод будет являться анодом в гальваническом элементе, составленном из указанных стандартных электродов? Напишите уравнения реакций протекающих в этом гальваническом элементе, рассчитайте ЭДС и составьте формулу (схему работы) указанного гальванического элемента:
3. Составьте схемы двух гальванических элементов, в одном из которых указанный электрод является катодом, а в другом – анодом. Напишите уравнения реакций протекающих в составленных гальванических элементах:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
