Сборник лаб. раб по общей химии new. Методические указания по выполнению лабораторных работ и организации самостоятельной работы для студентов всех форм обучения
 Скачать 1.56 Mb. Скачать 1.56 Mb.
|
|
Лабораторная работа № 9 Коррозия металлов и методы защиты от коррозии Введение Изучение коррозии и разработка методов защиты металлов от нее представляют теоретический интерес и имеют большое народно-хозяйственное значение. Коррозия приводит к большим потерям в результате разрушения трубопроводов, цистерн, металлических частей машин, корпусов судов, морских сооружений и т.п. Безвозвратные потерн металлов от коррозии составляют до 15% от ежегодного их выпуска. Однако во многих случаях косвенные убытки oт коррозии могут значительно превышать прямые потери за счет растворения металла. Замена прокорродировавшего котла или конденсатора на больший теплоэлектростанции может нанести энергосистеме существенный ущерб. Кроме того, к убыткам от коррозии можно отнести также стоимость потерянного продукта, например, масла, газа, воды из системы с прокорродированными трубами или антифриза через прокорродировавший радиатор. Выброс природного газа и других пожаро- и взрывоопасных веществ через отверстия, образованные вследствие коррозии, может привести к пожарам и даже к мощным взрывам с огромными и материальными потерями и даже с человеческими жертвами. В целом потери народного хозяйства от коррозии исчисляются миллиардами рублей ежегодно. Цель борьбы с коррозией – это сохранение ресурсов металлов, мировые запасы которых ограничены. Методическое пособие разработано в соответствии с рабочими программами Дальрыбвтуза по химии и неорганической химии. Пособие предназначено для студентов всех специальностей. 1. Цели и задачи В процессе изучения теоретического материала и выполнения эксперимента студент должен: 1. изучить основные типы коррозии металлов; 2. познакомиться с действие ионов, активирующих процесс коррозии; 3. изучить методы защиты металлов от коррозии, действие. 2. Теоретическая часть Коррозией называется разрушение под воздействием окружающей среды. Выделение металлов из руд требует затраты энергии (в доменном процессе, при эдектрометаллургическом получении и т.д.) поэтому обратное превращение металлов в окисленное состояние протекает с высвобождением энергии. Все коррозионные процессы имеют одну и ту же причину: термодинамическую неустойчивость металлов в условиях воздействия внешней среды. Поэтому металлы самопроизвольно переходят в термодинамически более стабильные соединения: оксиды, гидроксиды, основные соли и т.д. Коррозия - это физико-химическое взаимодействие металла и среды, в которой он находится. Среда, вызывающая коррозию, называется коррозионной, или агрессивной. Способность металлов противостоять коррозионному воздействию среды называют коррозионной стойкостью. Химические процессы, вызывающие коррозию, – это окислительно-восстановительные реакции, протекающие на границе раздела "металл - агрессивная среда". Агрессивной средой может быть газ, воздух, вода (особенно морская), растворы электролитов, органические растворители. Металлы при коррозии окисляются, а вещества, с которыми они взаимодействуют, восстанавливаются. Коррозионные процессы различают по следующим признакам: а) виду (геометрическому характеру) коррозионных разрушений на поверхности или объеме металла; б) виду коррозионной среды; в) механизму реакций взаимодействия металла со средой. По характеру разрушений металла при взаимодействии его с агрессивной средой коррозию разделяют на следующие: а) сплошную (равномерную и неравномерную) разрушение охватывает всю поверхность металла; б) местную – разрушения локальны, большая часть поверхности не затронута, может иметь вид пятен, язв, точек петтенгов (углубление точек); в) подповерхностную, начавшись с поверхности, коррозия в дальнейшем поражает подповерхностные слои металла; г) межкристаллитную – не разрушая зерен металла коррозия продвигается по их менее стойким границам; д) избирательную (селективную) – в сплаве разрушается один компонент. По виду агрессивной среды, принимающей участие в разрушении металла, различают коррозию: газовую, атмосферную, подземную, в жидкостях – неэлектролитах, в растворах – электролитах. По механизму реакции взаимодействие металла с коррозионной средой различают два основных вида коррозии: химическую и электрохимическую. Особо выделяют биохимическую (микробиологическую) и радиационную коррозии. Химическая коррозия Химической коррозией называют разрушение металла под действием окружающей среды без возникновения электрического тока. Химическая коррозия бывает.
К химической коррозии в жидкостях неэлектролитах относят коррозионные процессы металлов в органических жидкостях: спиртах, бензоле, феноле, хлороформе, четырех хлористом углероде, нефти, керосине, бензине и т.д. В частом виде органические растворители и углеводороды, входящие в состав нефти и жидких топлив слабо реагируют с металлами. Но присутствие в них даже незначительных количеств примесей сероводорода, элементарной серы, меркаптанов резко активизирует коррозию металлов. Меркаптаны (R-SH) вызывают коррозию меди, никеля, свинца, олова и других металлов. Содержащийся в нефти сероводород взаимодействует с железом, свинцом, медью, серебром с образованием сульфидов: крекинг-бензины при взаимодействии с металлами (железом, медью, магнием, свинцом, цинком) осмоляются, возрастает кислотность среды, что и способствует коррозии. Алюминий разрушают даже безводные хлорорганические растворители, а присутствие в них воды приводит к усилению коррозии. Газовая коррозия наиболее распространенный вид химической коррозии, она наблюдается при работе двигателей внутреннего сгорания, при термической обработке, горячей прокатке, ковке металлов и т.д. Газовая коррозия может проходить при действии на металл кислорода, хлора, хлороводорода оксида углерода (II), оксидов серы (II), (IV). При коррозии металла в атмосфере, содержащей кислород, в том числе, и воздушной, образуются оксиды металла. Поверхность металла покрывается оксидной пленкой, которая может защищать металл от дальнейшего окисления. Чтобы оксидная пленка обладала защитными свойствами, она должна быть сплошной, беспористой, иметь хорошее сцепление с металлом, иметь коэффициент термического расширения близкий характеристике металла, быть химически инертной по отношению к данной агрессивной среде, обладать твердостью и износостойкостью. При образовании такой пленки на поверхности металл переходит в пассивное состояние, т.е. дальше не подвергается коррозии. Если образовавшаяся оксидная пленка пористая, рыхлая и плохо сцеплена с металлом, то она не будет обладать защитными свойствами для металла (например, пленка, состоящая из оксидов железа разной степени окисления FeO, Fе2O3, Fе3O4) При воздействии на металлы оксида углерода II с ростом температуры и давления могут образоваться легко летучие соединения карбонилы металла Ме(СО)4, которые, испаряясь с поверхности металла, разрыхляют его поверхностный слой. Коррозии под действием хлора и хлороводорода подвержены практически все металлы. При этой коррозии образуются хлориды металлов. Продукты сгорания топлива (угля, жидких углеводородов, мазута и др.) содержат значительные количества соединений серы и ванадия, влияющих на скорость газовой коррозии. С повышением температуры скорость газовой коррозии почти всех металлов увеличивается. Электрохимическая коррозия Электрохимической коррозией называют разрушение металла в среде электролита с возникновением в системе электрического тока. Различают: а) гальванокоррозию – коррозию металла в растворах электролитов; б) атмосферную – коррозию в атмосфере любого влажного газа; в) почвенную – коррозию во влажной почве; г) электрокоррозию – коррозию за счет внешнего электрического тока. При электрохимической коррозии процесс взаимодействия металла с окислителем включает анодное растворение металла и катодное восстановление окислителя. Поверхность любого металла неоднородна и состоит из множества короткозамкнутых микрогальванических элементов. Гальванические элементы на поверхности металла могут образоваться при наличии в металле примесей, пленок на его поверхности, неоднородности сплава по химическому и фазовому составам. Разнородные участки металла имеют различные значения электродных потенциалов. Участки, имеющие меньшее значение потенциала, являются анодом и на них протекает процесс окисления, а участки с большим электродным потенциалом – катодом, на них идет восстановление окислителя. Катодом могут служить самые разнообразные вещества, но обязательно являющиеся электронными проводниками. Примером гальванокоррозии может служить коррозия железа в контакте с медью в растворе электролита – соляной кислоты. При таком контакте возникает гальванический элемент  (-) Fe / НСl / Сu (+).  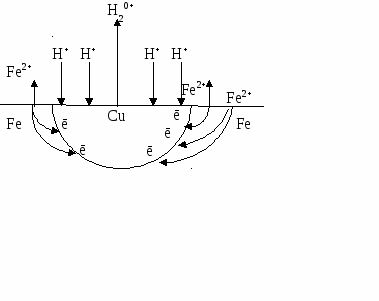  Схема действия гальванической пары Как показано на рисунке, более активный металл Fe (ЕFe/Fe2+ = – 0,46В) – анод – окисляется, посылая электроны меди, и переходит в раствор ионов Fe2+. Ионы H+ из электролита движутся к меди, являющейся катодом (ЕCu/Cu2+ = + 0,34 В), где, принимая электроны, восстанавливаются. Таким образом, протекают реакции A: Fe – 2ē 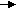 Fe2+ Fe2+K: 2H+ + 2ē 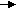 H2 H2F  e + 2H+ → Fe2+ +H2 e + 2H+ → Fe2+ +H2В результате перехода электронов с анода на катод потенциал катода становится более отрицательным, а потенциал анода – более положительным, т.е., как и в обычном гальваническом элементе, имеет место поляризация электродов. В результате этого происходит выравнивание потенциалов электродов, и коррозия замедляется или вовсе прекращается. Однако при коррозии окислители внешней среды, принимающие электроны у катода деполязируют его, т.е. повышают потенциал катода. Эти окислители называются катодными деполяризаторами. В приведенном примере катодным деполяризатором является ион водорода (водородная деполяризация). Катодным деполяризатором может являться кислород, растворенный в воде (кислородная деполяризация). Восстановление кислорода на катоде протекает по уравнению: O2 + H2O + 4ē 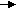 4OH-. 4OH-.При работе гальванопары железо-медь в нейтральной среде  (-) Fe / НСl / Сu (+) протекают реакции  A: Fe – 2ē 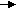 Fe2+ Fe2+ K: O2 + H2O + 4ē K: O2 + H2O + 4ē 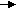 4OH- 4OH-Fe + O2 + H2O 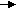 Fe(OH)2 Fe(OH)2Гидроксид железа (II) в присутствии воды и кислорода воздуха переходит в гидроксид железа (III): 4Fe(OH)2 + O2 +2 Н2О 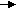 4Fe(OH)3. 4Fe(OH)3.Возможность протекания коррозионных процессов зависит от энергии Гиббса. Коррозия как самопроизвольный процесс протекает, если энергия Гиббса ΔG реакции имеет отрицательное значение. А так как энергия Гиббса связана с ЭДС элемента Е = -(ΔG/nF), то возможность коррозии может быть установлена, но знаку ЭДС элемента Е. ЭДС элемента должна быть положительна. Так как ЭДС элемента Е равна разности потенциалов окислителя и восстановителя Е = Еокисл. – Евосст., то коррозия возможна при условии, что потенциал окислителя положительнее потенциала металла (восстановителя). Равновесные потенциалы восстановления катионов водорода и молекул кислорода зависят от кислотности среды. Потенциал восстановления ионов водорода меняется от Е2Н+/Н2 = 0В (сильно кислая среда) до Е2Н+/Н2 = – 0,41В (нейтральная среда). Потенциал восстановления кислорода в нейтральной среде ЕО2/ОН = + 0,81В. Из сравнения потенциалов ионов водорода, кислорода и потенциалов металла можно сделать следующие выводы:
Появление анодных и катодных участков на поверхности металла (гальванопар) может быть вызвано не только наличием вкраплений других металлов, но и присутствием примесей неметаллических веществ (например, углерода) или неоднородностью поверхности. Совершенно чистые металлы подвержены коррозии в значительно меньшей степени, но при больших значениях рН растворяется алюминий и практически не растворяется железо. Из-за амфотерности Zn(OH)2 коррозия цинка возрастает как в кислой, так и в щелочной среде. Золото, весьма стойкое в обычных условиях, легко окисляется в растворе цианида калия KCN вследствие образования следственных соединений. Выводы:
Атмосферная коррозия – это коррозия во влажном воздухе при обычной температуре. Поверхность металла покрывается пленкой влаги, содержащей кислород. В этой пленке и протекает коррозия с кислотной депоизоляцией. Интенсивность коррозии возрастает с увеличением влажности воздуха, содержания в нем газов СО2 и SО2, пыли, копоти, а также с появлением на поверхности металла шероховатостей и трещин, облетающих конденсацию влаги. Почвенная коррозия угрожает трубопроводам, оболочкам кабелей и всем подземным сооружениям. Особенно коррозионно - активны почвы с высокой влажностью, низким значением рН и хорошей электропроводимостью Электрическая коррозия вызывается блуждающими токами, исходящими от трамваев, метро, электрических железных дорог и различных электроустановок, работающих на постоянном токе. Блуждающие токи разрушают подземные металлические сооружения, вызывают появление на металлических предметах, находящихся в земле участков входа и выхода постоянного тока. Разрушаются анодные зоны, т.е. места выхода тока. Блуждающие токи от источников переменного тока вызывают слабую коррозию у подземных изделий из стали и сильную – у изделий из цветных металлов. Биохимическая (микробиологическая) коррозия – это разрушение металлов при воздействии микроорганизмов и продуктов их жизнедеятельности. Микроорганизмы могут разрушать защитные покрытия на металлах, подавлять действие веществ, замедляющих коррозию (ингибиторов). Бактерии могут вырабатывать серную, муравьиную, уксусную и другие органические кислоты, деполяризовать катодные участки коррозионных микрогальванических элементов Особенности коррозии в морской воде Особенностями морской воды как агрессивной среды являются: а) высокая концентрация солей (от 5 до 39 г/л), снижающая химическое сопротивление электролита; б) большое содержание хлоридов (ион Сl- является сильнейшим активатором коррозии); в) энергичное перемешивание воды с одновременной аэрацией, способствующее увеличению содержания растворенного кислорода. Скорость коррозии в зоне прилива или волны в 3-5 раз больше, чем зоне полного погружения; г) одновременное содержание в воде ионов Сl и кислорода, являющегося сильным окислителем; д) присутствие биологических факторов, вызывающих биокоррозию и обрастание судов. Все это делает воду очень сильной коррозионной средой, хотя её рH= 7,2 – 8,0. Особенно резко возрастает скорость коррозии по ватерлинии судна, что объясняется большим поступлением атмосферного кислорода. Исключительно энергичное коррозионное воздействие оказывают брызги морской воды. По мере испарения воды из капли в последней увеличивается концентрация солей, что приводит к увеличению коррозии. Методы защиты металлов от коррозии.
В процессе коррозии протектор служит анодом и разрушается, предохраняя тем самым от разрушения конструкцию. На том же принципе основана электрозащита. Конструкцию. находящуюся в среде электролита, также соединяют с другим металлом, но через внешний источник тока. При этом защищаемую конструкцию присоединяют к катоду, а металл - к аноду источника тока. Анод (защищающий металл) разрушается, а на катоде происходит восстановление окислителя.
Органические ингибиторы прочно адсорбируются на поверхности металла и повышают перенапряжение электродных реакций. Неорганические ингибиторы тормозят анодную реакцию, что замедляет анодное растворение металла и благоприятствует его переходу в пассивное состояние. Примеры решения эталонных задач 1. Как происходит коррозия цинка находящегося в контакте с кадмием в нейтральном и кислом растворах? Составить электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии? Решение. Цинк имеет более отрицательный потенциал (- 0,763В), чем кадмий (-0,403В), поэтому он является анодом, а кадмий катодом. Анодный процесс: Zn0 – 2ē = Zn2+. Катодный процесс: в кислой среде 2Н+ + 2ē = Н2; в нейтральной среде 1/2О2 + Н2О + 2ē = 2ОН-. Так как ионы Zn2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2. 2. Железо находится в контакте с медью. Составьте электронные уравнения реакций этого изделия при коррозии в атмосферных условиях и в кислой среде. Решение. Рассмотрим коррозию железа в контакте с медью в растворе соляной кислоты, при котором возникает гальваническая пара: (-) Fe / HCl / Cu (+). В этой паре железо, как более активный металл (EFe/Fe2+= – 0,44В), является анодом, а медь (ЕCu/Cu2+ = + 0,34В) – катодом. Железо – анод – окисляется, и электроны его переходят на медь. Ионы Fe2+ переходят в раствор. Катионы водорода, содержащиеся в соляной кислоте, подходят к поверхности меди и восстанавливаются на ней. Уравнения процессов, происходящих на аноде и катоде: Анод: Fe - 2ē = Fe2+; катод: 2Н+ + 2ē = Н2. Таким образом, железо, содержащее примеси, подвергается коррозии. Если средой, в которой находится такая гальванопара, будет не кислота, а вода или влажный воздух, то катодный процесс будет насколько иной. В этом случае окислителем является растворенный в воде кислород, и на катоде будет идти его восстановление: О2 + 2Н2О + 4ē = 4OН-. Ионы железа, перешедшие в раствор, соединяются с гидроксид - ионами: Fe2+ – 2OH- = Fe(OH)2. Получающийся гидроксид железа(II) будет дальше окисляться кислородом воздуха: 4Fe(OH)2 + 2Н2О + О2 = 4Fe(OH)3. 3. Экспериментальная часть 3.1. Образование микрогальванопар
3.2. Электрохимическая коррозия железа
3.3. Действие ионов, активирующих процесс коррозии
3.4. Ингибиторы раствора
4. Задачи для самостоятельной работы 1. Составить уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии данной пары металлов. Указать, какие продукты коррозии образуются в первом и втором случаях:
2. Выбрать металл для протекторной зашиты от коррозии данного металла. Составить электронные уравнения анодного и катодного процессов в кислой среде, указать состав продуктов коррозии:
3. Выбрать металлы для анодной и катодной зашиты от коррозии данного металла. Составить электронные уравнения анодного и катодного процессов коррозии, проходящей во влажном воздухе, для первого и второго случая:
Лабораторная работа № 10 Химический контроль качества воды Введение Для энергетических установок транспортных и рыболовных судов основным показателем интенсификации процесса эксплуатации является экономия топлива и других энергетических и материальных ресурсов. В решении этой комплексной проблемы новое качественное значение имеют вспомогательные котельные установки. Котлы позволяют повысить степень утилизации тепла уходящих газов дизелей, выполнить роль оборудования по защите от загрязнения окружающей морской среды и обеспечить безопасность за счет генерации инертных газов. Эксплуатационная надежность и общая эффективность паровых котлов и энергетической установки в целом определяется качеством воды. Сущность обеспечения качества воды сводится к тому, чтобы исключить накипеобразование и коррозию элементов пароводяного тракта. Специалист морского флота должен уметь применять химические знания в процессе эксплуатации судовых котлов, то есть уметь использовать полученные знания для анализа питательной, котловой вод и проводить мероприятия по приведению показателей качества к норме. 1. Цели и задачи В процессе изучения теоретического материала и выполнения эксперимента студент должен: 1. Ознакомиться с методами устранения жесткости воды; 2. Определить жесткость воды (морской, котловой, водопроводной), сравнить величины жесткости и сделать вывод о пригодности исследуемой воды; 3. Определить щелочность и рН исследуемых вод. 2. Краткий теоретический материал Питательная и котловая вода должны удовлетворять определенным требованиям, которые обуславливаются необходимостью обеспечения высокой надежности и достаточной экономичности котла. Для обеспечения главных задач водного режима судовых установок качество воды обычно нормируется по следующим показателям: сухому остатку, общему солесодержанию, концентрации ионов хлора, кислорода, значению рН и активности, жесткости, щелочности. Сухой остаток представляет собой суммарное содержание растворенных в воде неорганических и органических веществ. Определяется сухой остаток выпариванием через плотный бумажный фильтр пробы воды с последующим высушиванием полученного остатка при Т = 110-I20 С. Количественно сухой остаток выражают в мг/л. Его величина не должна превышать 1,0-1,5 мг/л. Соленость отражает содержание в воде хлоридов и выражается в градусах Брандта (°Бр). 1 °Бр соответствует содержанию 10 мг/л NaCl. В последнее время количественно соленость воды выражается в мг/л Сl- (1 °Бр соответствует 6,06 мг/л Сl). Присутствие ионов хлора крайне нежелательно из-за разрушающего воздействия его на некоторые металлы. Содержание хлор /ионов в котловой воде многократной циркуляции допустимо до 0,5-1,0 мг/л. Кислородосодержание обуславливается содержанием в воде кислорода, растворенного в ней, и измеряется в миллиграммах на литр кислорода. Присутствие кислорода в воде интенсифицирует процессы коррозии металла, а поэтому крайне нежелательно. Кислородосодержание не должно быть больше 0,01-0,020 мг/л. Концентрация водородных ионов зависит от состава и соотношения растворенных солей и газов. От этого зависит реакция воды - щелочная или кислая. Количественно реакция воды определяется по концентрации водородных ионов (или водородному показателю рН = - lg СH+. Обычно в практике считают, что при показателе рН = от 6,5-7 вода (раствор) имеет слабощелочную реакцию, при рН > 7 - щелочную. Величина рН в котловой воде для углеродистых сталей должна быть в пределах 8,5-9,5. Жесткостью воды обусловлена содержанием в ней растворенных солей кальция и магния. Жесткость воды подразделяется на карбонатную и некарбонатную. Карбонатнаяжесткость (временная) обуславливается присутствием в воде гидрокарбонатов кальция и магния: Ca(HCO3)2 и Mg(HCO3)2. Некарбонатная жесткость (постоянная) определяется наличием в воде солей кальция и магния сильных кислот-сульфатов или хлоридов. Суммарное содержание ионов кальция и магния называется общей жесткостью. Карбонатнуюжесткость воды называют временной, т.к. при длительном кипячении воды в ней появляется осадок, состоящий из CaCO3 и одновременно выделяется СО2. При нагревании происходит разложение гидрокарбоната кальция: Ca(HCO3)2 = CaCO3 + CO2 + H2O. Жесткость, остающаяся после такого кипячения, называется постоянной жесткостью. Измеряют жесткость числом миллимолей эквивалентов ионов жесткости (Са2+ и Мg2+) в 1 дм3 или 1л воды (ммоль/дм3 или ммоль/л). При расчетах следует учитывать, что Э(Са2+) = 1/2Са2+ и Э(Мg2+) = 1/2Мg2+, а МэСа2+ = ½ Ми (Сa2+) = 20 г/моль и Мэ(Мg) = ½ Ми (Мg2+) = 12 г/моль. Мэ- молярная масса эквивалентов, Ми – молярная масса иона. Например: 0,2 г – это масса 0,01моль или 10 ммоль эквивалентов Са2+ . Присутствие в воде значительного количества солей кальция или магния делает воду непригодной для многих технических целей. Так при продолжительном питании паровых котлов жесткой водой их стенки постепенно покрываются плотной коркой накипи. Такая корка уже при толщине в 1 мм сильно понижает передачу теплоты стенками котла и, следовательно, ведет к увеличению расхода топлива. Кроме того, она может служить причиной образования вздутий и трещин как в кипятильных трубах, так и на стенках самого котла. А это может привести к аварии. Жесткая вода не дает пены с мылом, так как содержащиеся в мыле растворимые натриевые соли жирных кислот переходят в нерастворимые кальциевые соли тех же кислот. 2C17H35COONa + CаSO4 = (C17H35COO)2Ca + Na2SO4. Жесткой водой нельзя пользоваться при некоторых технологических процессах, например, при крашении. Щелочность воды характеризуется содержанием в воде NaOH, NaHCO3, Na3PO4 и др. Основной причиной повышения щелочности воды является введение в нее химических соединений с целью устранения жесткости. Щелочное число Аz представляет собой сумму свободной и связанной щелочи в котловой воде, а количественно это соответствует содержанию NaOH в мг/л. Приведенные выше примеры указывают на необходимость удаления из воды ионов Са2+ и Мg2+ , ионов Сl- и РО В ходе водоподготовки вода освобождается от грубодисперсных и коллоидных примесей и от растворенных веществ. Взвешенные и коллоидные примеси удаляются их коагуляцией при добавлении к воде солей (обычно Al2(SO4)3) с последующей фильтрацией. Для водоумягчения применяют методы осаждения и ионного обмена. Путем осаждения катионы Са2+ и Мg2+ переводят в малорастворимые соединения, выпадающие в осадок. Это достигается либо кипячением воды, либо химическим путем: введением в воду соответствующих реагентов. Сa(HCO3)2 = СaCO3 + CO2 + H2O; Мg(НCO3)2 = Мg(ОН)2 + 2CO2. В результате устраняется только карбонатная жесткость. При химическом методе чаще всего пользуются известью или содой. При этом в осадок (так же в виде СaCO3 и Мg(ОН)2) переводятся все соли кальция и магния. СaCl2 + Na2CO3 = СaCO3 + 2NaCl. Для устранения жесткости методом ионного обмена или катионирования воду пропускают через слой катионита (разнообразные синтетические ионнообменные материалы, химической промышленностью выпускаются в виде зернистых порошков, волокон, мембран). При катионировании, находящиеся в воде катионы Са2+ и Мg2+, обмениваются на катионы Nа+, которые содержатся в применяемом катионите. В некоторых случаях требуется удалить из воды не только катионы Са2+ и Мg2+, но и другие катионы и анионы. В таких случаях воду пропускают последовательно через катионит, содержащий в обменной форме водородные ионы (Н+ - катионит}, и анионит, содержащий гидроксид ионы (ОН- - анионит). В итоге вода освобождается как от катионов, так и от анионов солей. Такая обработка воды называется ее обессоливанием. Когда процесс ионного обмена доходит до равновесия, ионит перестает работать, так как утрачивает способность умягчать воду. Однако любой ионит легко подвергается регенерации. Для этого через катионит пропускают концентрированный раствор NaCl, Na2SO4, HCl, H2SO4. При этом ионы Са2+ и Мg2+ выходят в раствор, а катионит снова насыщается ионами Nа+ или Н+. Для регенерации анионита его обрабатывают раствором щелочи или соды (последний, вследствие гидролиза карбонат - иона также имеет щелочную реакцию). В результате поглощенные анионы вытесняются в раствор, а анионит вновь насыщается ионами ОН- . |
