Сборник лаб. раб по общей химии new. Методические указания по выполнению лабораторных работ и организации самостоятельной работы для студентов всех форм обучения
 Скачать 1.56 Mb. Скачать 1.56 Mb.
|
|
Лабораторная работа № 5 Водородный показатель и гидролиз солей Введение Использование водородного показателя имеет большое практическое значение для оценки кислотности и щелочности всевозможных водных сред: природных, промышленных, физиологических и прочих. В связи с этим в настоящее время разработаны прецизионные инструментальные методы измерения водородного показателя и соответствующие приборы – так называемые рН-метры. Лабораторная работа нацелена на изучение кислотно-основных свойств растворов, которые широко используются в технологии переработки пищевых продуктов и в процессах изготовления и использования различных машин и механизмов. 1. Цели и задачи 1.1. Изучить гидролиз средних солей и реакцию среды этих растворов, условия протекания реакций гидролиза в водных растворах, влияние различных факторов на степень гидролиза. 1.2. Научиться определять рН среды при помощи индикаторов, составлять уравнения гидролиза солей. 2. Теоретическая часть 2.1. Ионное произведение воды, рН - растворов Чистая вода является слабым электролитом, так как обладает измеримой электрической проводностью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид ион: Н2О → H+ +ОН- Тогда константа диссоциации воды: или Так как степень диссоциации воды очень мала, то концентрация недиссоциированных молекул Н2О в воде практически равна общей концентрации воды -55,55 моль/л: 1 л содержит 1000 г Н2О, т.е. 100:18=55,55 молей. Kg - воды – величина постоянная при данной температуре. Поэтому заменив в уравнении (2) произведение двух постоянных: новой константой – константой воды будем иметь: Полученное уравнение показывает, что для воды и разбавленных растворов при неизменной температуре произведение концентрации ионов водорода и гидроксогруппы есть величина постоянная. Она называется ионным произведением воды. В чистой воде при 25°С [Н+] = [ОН-] = 1.10-7 моль/л, поэтому для указанной температуры: Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами. При повышении температуры 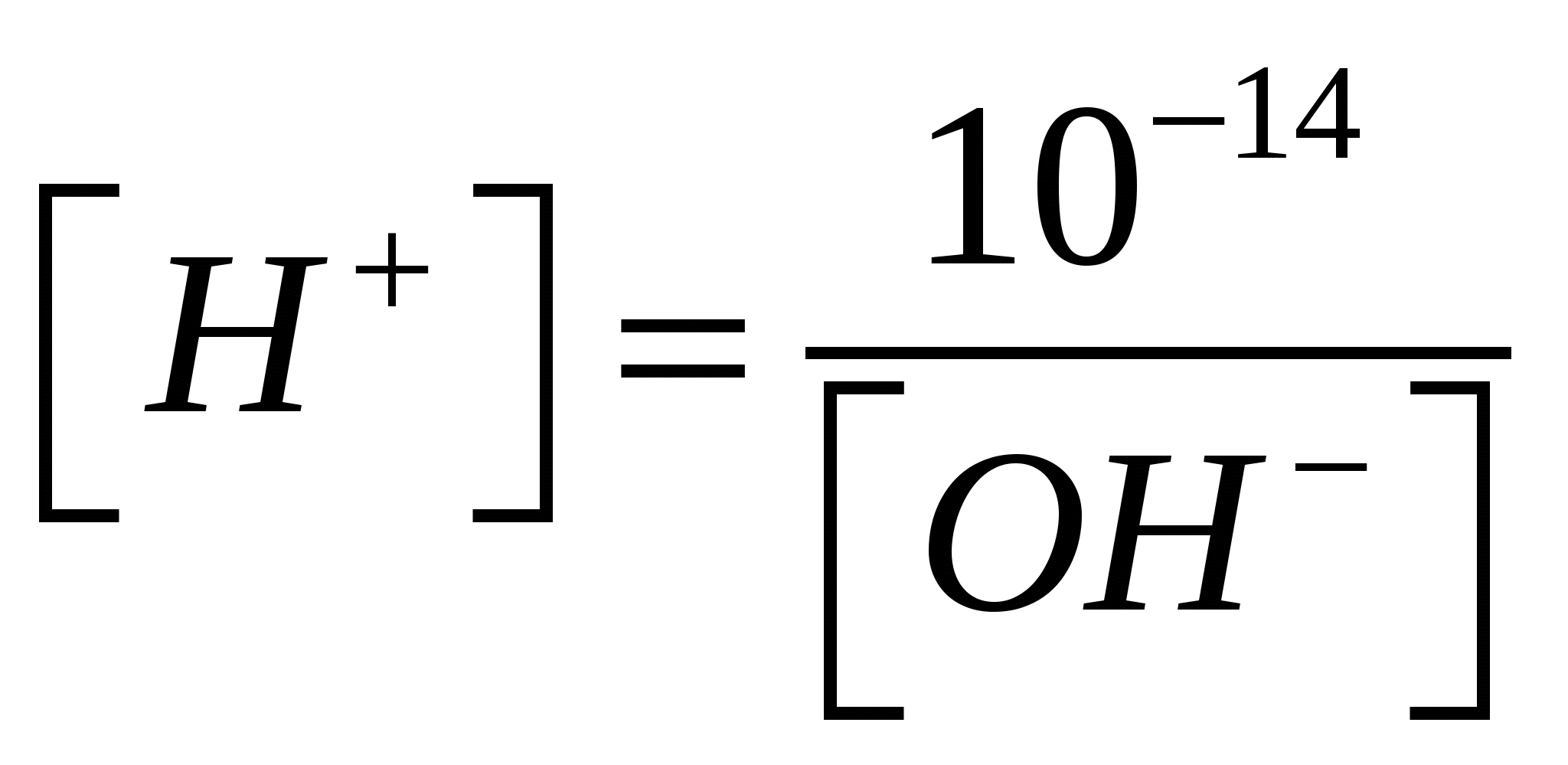 или или 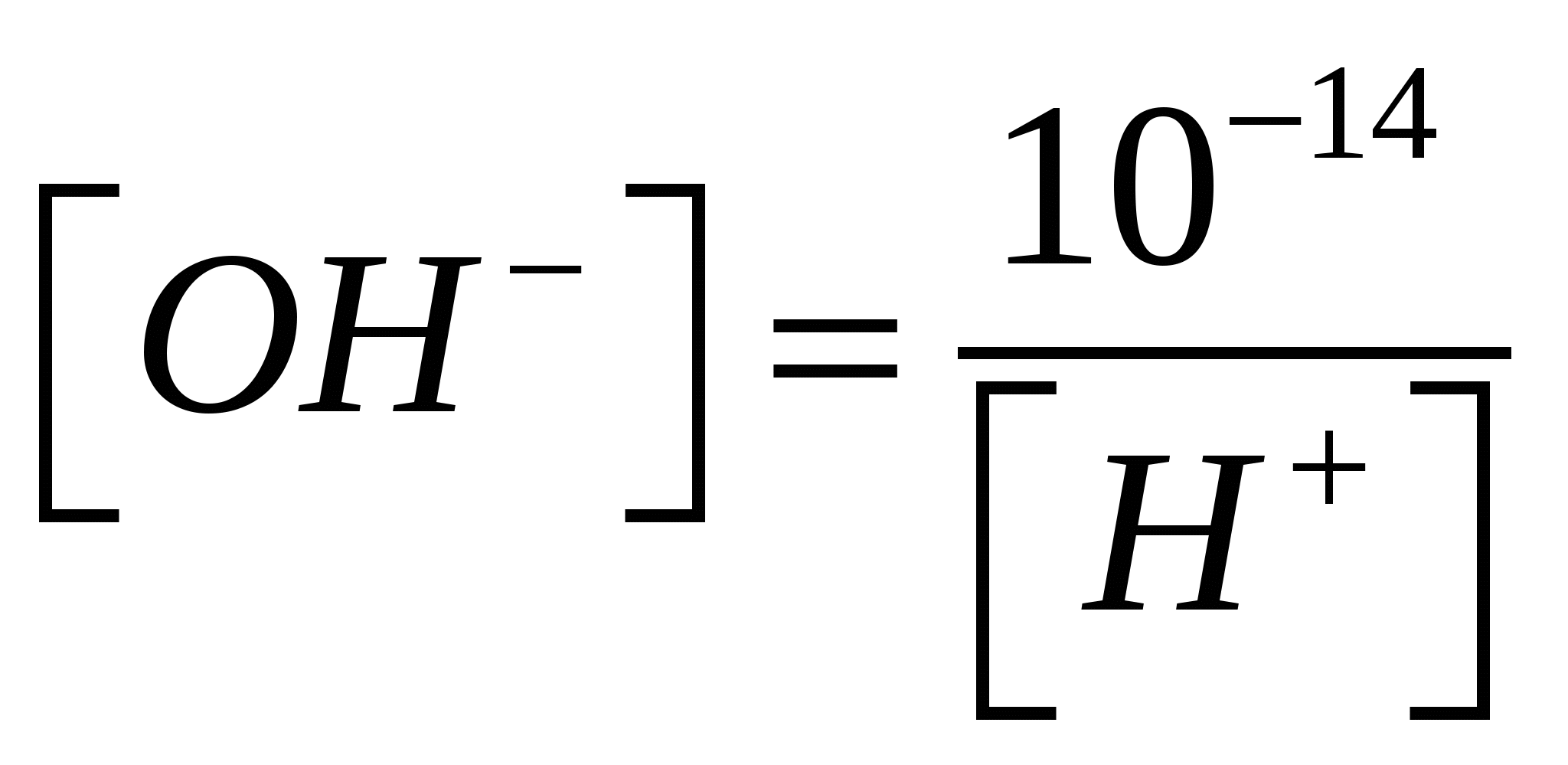 . .Если концентрация ионов водорода в водородном растворе известна, то тем самым определена и концентрация ионов [ОН-]. Так, если [H+] =10-14 моль/л, то [OH-] = 10-14/10-4=10-10моль/л, и наоборот, если [ОН-] = 10-5 моль/л, то [Н+] =10-14/10-5 =10-9 моль/л. Поэтому как степень кислотности, так и степень щелочности раствора можно количественно охарактеризовать концентрацией ионов водорода: Нейтральный раствор [Н+] =10-7 моль /л, Кислый раствор [Н+] > 10-7 моль/л, Щелочной раствор [Н+] < 10-7 моль / л. Более удобно пользоваться десятичным логарифмом концентрации ионов водорода, взятых с обратным знаком. Эта величина называется водородным показателем и обозначается рН. pH = - lg[H+] , если рН = 7 - среда нейтральная, если рН < 7 - среда кислая, если рН >7 - среда щелочная. Приближенную реакцию раствора можно определить с помощью специальных реактивов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее распространенные индикаторы - метиловый оранжевый, метиловый красный, фенолфталеин, лакмус. 2.2. Гидролиз солей Гидролизом солей называется процесс взаимодействия ионов соли с ионами воды. Обязательным условием гидролиза является образование слабого электролита в результате реакции. Если слабый электролит не образуется, то такая соль гидролизу не подвергается. Гидролизу подвергаются соли, образованные: 1) слабыми кислотами и сильными основаниями; 2) слабыми основаниями и сильными кислотами; 3) слабым и основаниями и слабыми кислотами. При обычных условиях гидролиз идет только по первой стадии. 1. Гидролиз солей, образованных слабыми кислотами и сильными основаниями:
2. Гидролиз солей, образованных слабыми основаниями и сильными кислотами:
3. Гидролиз солей, образованных слабыми основаниями и слабыми кислотами:
В данном случае Соли очень слабых кислот и нерастворимых оснований не могут существовать, так как подвергаются глубокому полному гидролизу: Cr2S3 + 6Н2О = Сr(ОН)3 + 3H2S. Соли, образованные сильными основаниями и сильными кислотами, не содержат ионов, способных связывать ионы воды в слабые электролиты, и практически гидролизу не подвергаются. Гидролиз соли, образованной слабой кислотой НА и сильным основанием, характеризуется константой гидролиза К: КГ = [ОН-] [НА] / [А-] = КH2O/ Ккисл., где КH2O – ионное произведение воды. Последнее соотношение показывает, что чем слабее кислота, т.е. чем меньше константа ее диссоциации, тем больше константа гидролиза образованной ею соли. Аналогично для соли слабого основания МОН и сильной кислоты: КГ = [Н+] [МОН] / М+ = КH2O / Косн. Отсюда следует, что КГ тем больше, чем меньше Косн, т.е. чем слабее основание МОН. Степенью гидролиза h называется доля электролита, подвергшаяся гидролизу. Она связана с константой гидролиза КГ уравнением, аналогичным закону разбавления Оствальда для диссоциации слабого электролита: KГ = h2 CM / (1 - h). Чаще всего гидролизованная часть соли очень мала, а концентрация продуктов гидролиза незначительна. В подобных случаях h << 1, и в знаменателе последней формулы этой величиной можно пренебречь. Тогда связь между КГ и h выразится более простыми соотношениями: КГ = h2 См или h = Из последнего уравнения следует, что степень гидролиза данной соли тем больше, чем меньше ее концентрация, иначе говоря, при разбавлении раствора гидролизующейся соли степень ее гидролиза возрастает. Примеры решения задач 1. Концентрация ионов водорода в растворе равна 4.10-3 моль/л. Определить рН раствора. Решение. Округляя значение логарифма до 0,01, получим: рН= - lg(4.10-3) = 2,40. 2. Чему равна концентрация гидроксид-ионов в растворе, рН которого равен 10,80. Решение. Из соотношения рН + рОН = 14 находим: рОН = 14 - рН = 14 - 10,80 = 3,20. Отсюда, -lg [ОН-] = 3,20 или lg [ОН-] = -3,2. Этому значению логарифма соответствует значение [ОН-] = 6,31.10-4 моль/л. 3. Вычислить степень гидролиза ацетата калия в 0,1М растворе и рН раствора. Решение. Уравнение реакции гидролиза: СН3СОО- + Н2О Для вычисления степени гидролиза найдем, прежде всего, константу гидролиза. Для этого воспользуемся значением константы диссоциации уксусной кислоты (1,8 . 10-5), взятой в справочнике: KГ = KH2O / Kкисл. = 10-14 / (1,8.10-5) = 5,56.10-10. Теперь найдем степень гидролиза: h = Для вычисления рН следует принять во внимание, что в результате гидролиза каждого аниона СН3СОО - образуется один гидроксид-ион. Если исходная концентрация гидролизующихся анионов СМ моль/л, а гидролизу подверглась доля h этих ионов, то при этом образовалось hСМ моль/л ионов ОН-. Таким образом: [OH-] = hCM = 7,5.10-5 . 0,1 = 7,5.10-6 моль/л. Следовательно, рОН = - lg [ОH-] = - lg (7,5.10-6) = 5,12. Отсюда, рН= 14 – рОН = 14 - 5,12 = 8,88. 4. Определить рН 0,1 М раствора ортофосфата калия. Решение. Будем считать, что гидролиз практически протекает только по первой ступени: К3РО4 + Н2О = К2НРО4 + КОН РO43- + Н2O = НРО42- + ОН-. Константа гидролиза по этой ступени определяется константой диссоциации образовавшейся слабой кислоты НРО42-, т.е. третьей константой диссоциации ортофосфорной кислоты (1,3.10-12): КГ = КH2O / КД3 = 10-14 / (1,3.10-12) = 7,7.10-3. Находим степень гидролиза: h = Концентрация образовавшихся гидроксид-ионов равна hСM, т.е. [ОН -] = 2,8.10-3, откуда pOH = - lg (2,8.10-3) = 2,55. Окончательно получаем: рН = 14 - рОН = 11,45. 5.Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN, б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей. Решение. а) Цианид калия KCN – соль слабой одноосновной кислоты HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы К+ и анионы CN-. Катионы К+ не могут связывать ионы ОН- воды, так как КОН – сильный электролит. Анионы же CN- связывают ионы Н+ воды, образуя молекулы слабого электролита HCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза: CN- + Н2О = HCN + ОН- или в молекулярной форме. KCN + Н2О = HCN + КОН. В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, поэтому раствор KCN имеет щелочную реакцию (рН > 7). б) Карбонат натрия Na2CO3 – соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли СО32-, связывая водородные ионы воды, образуют анионы кислой соли НСО3-. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза СО или в молекулярной форме Na2CO3 + Н2О = NaHCO3 + NaOH. В растворе появляется избыток ионов ОН-, поэтому раствор Na2CO3 имеет щелочную реакцию (рН >7). в) Сульфат цинка ZnSO4 – соль слабого многокислотного основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катионы Zn2+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH+. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза: Zn2+ + Н2О = ZnOH+ + Н+, или в молекулярной форме: 2ZnSO4 + 2Н2О = (ZnOH)2SO4 + H2SO4. В растворе появляется избыток ионов водорода, поэтому раствор ZnSО4 имеет кислую реакцию (рН < 7). 6.Какие продукты образуются при смешивании растворов Аl(NО3)3 и К2СО3? Составьте ионно-молекулярное и молекулярное уравнения реакции. Решение. Соль Аl(NО3)3 гидролизуется по катиону, а К2СО3 – по аниону: Аl3+ + Н2О = AlОH2+ + H+. СО32 - + Н2О = НСО3- + ОН-. Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, т.к. ионы Н+ и ОН- образуют молекулу слабого электролита Н2О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием Al(ОН)3 и СО2. Ионно-молекулярное уравнение: 2Аl3+ + 3СО32 - + 3Н2О = 2Аl(ОН)3 + 3СО2, или молекулярное уравнение: 2Al(NO3)3 + 3К2СО3 +3ЗН2О = 2Аl(ОН)3 + 3СО2 + 6KNO3. |
